【トピックス】
逆ミセルを利用したリフォールディング
迫野昌文、神谷典穂、後藤雅宏
理研・前田バイオ工学、九大院・工、九大院・工
1.はじめに
バイオテクノロジー技術の発展により、外来の遺伝子を別種の発現媒体 (宿主) へ組換えることにより、目的タンパク質の発現を簡便に行うことが可能となった。異種タンパク質発現のための遺伝子組換え技術は近年目覚しく発展しており、医薬、食品、化学工業などあらゆる分野において基盤的な技術として広く利用されている。しかし、この異種タンパク質発現系においてしばしば問題とされるのが、不溶でかつ不活性なタンパク質凝集体、インクルージョンボディ (封入体) の蓄積である1)。このため、インクルージョンボディを本来の活性を有するタンパク質へと高効率で再生 (リフォールディング) する技術が求められている。インクルージョンボディはタンパク質の凝集体であるから、高濃度の変性剤溶液に可溶化することが出来る。遺伝子組換え発現系では、回収されたタンパク質溶液中に宿主由来のタンパク質が高濃度で共存しているため、目的タンパク質のみを回収するには高度の精製技術が必要とされる。しかし、インクルージョンボディは、共雑タンパク質に比べ目的タンパク質が極めて高濃度に含まれることから、再生操作後の精製操作が簡便に行えるという利点がある。従って、インクルージョンボディからのタンパク質リフォールディングは工学的に極めて重要であるといえる2)。
2.希釈法とその問題点
タンパク質のリフォールディング法において、最も一般的な手法である単純希釈法の概要は以下の様である3,4)。
高濃度の変性剤溶液に溶解したタンパク質溶液を調製し、数十から数百倍の希釈を行うことにより変性剤の濃度を下げる。変性剤の効果が弱まることで、タンパク質の自発的なフォールディングが促進され、高次構造を回復する。この一連の作業は、変性タンパク質溶液を調製し、それを希釈するだけであるから操作が非常に簡便である。しかし、変性剤の効果の低減のために大希釈が必要であり、回分式操作においては、反応系の規模が大きくなることが問題点として挙げられる。また、大希釈に伴い目的タンパク質の濃度も希釈されることから、タンパク質の回収操作に影響を及ぼす。一方、変性タンパク質溶液中のタンパク質濃度を上げると、タンパク質の再凝集が十分に抑制できないという問題が生じる。これは、タンパク質濃度が高くなるにつれて再生過程にあるタンパク質分子間の距離が近接し、分子間相互作用の影響で、正確な折りたたみが困難になるためである。よって、効果的なタンパク質リフォールディングのためには、分子間相互作用の抑制が一つの鍵となる。
3.逆ミセルを用いたリフォールディング法
3.1 ナノ集合体逆ミセル
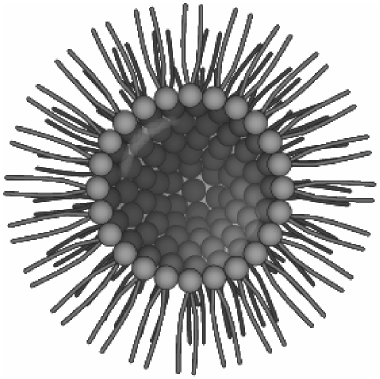
逆ミセルは、有機溶媒、界面活性剤及び微少量の水から構成されるナノサイズの分子集合体である (図1)。界面活性剤の疎水性部位は有機溶媒に、親水性部位は微小水滴表面に配向することで、有機溶媒中に球状のナノ集合体が構築される5)。
図1 ナノ集合体逆ミセルの模式図
逆ミセルの微小水滴空間は内水相 (water pool) と呼称され、様々な水溶性物質を可溶化することが可能である。このナノスケールの水相中の水分子は、逆ミセル界面付近に存在する結合水と、内水相の中心付近に存在するバルク水の二種類の性質を有する。結合水は界面活性剤の電荷により水分子の自由運動が強く束縛された状態にあるのに対して、バルク水は界面による束縛を受けにくく、水溶媒と同様に水和に要する自由運動を得やすい6)。このことから逆ミセルの内水相に溶解した水溶性の高い物質は、内水相中心に存在すると考えられている。逆ミセルは、抽出分離操作、特に水溶性の生体分子の抽出媒体としての利用について、これまで多くの研究がなされている7,8)。
3.2 手法概要
逆ミセルはその内水相にタンパク質を1分子溶解するように調製することが可能である。この特徴を用いて、Hagen らは逆ミセルを利用したタンパク質リフォールディング法を考案した9)。
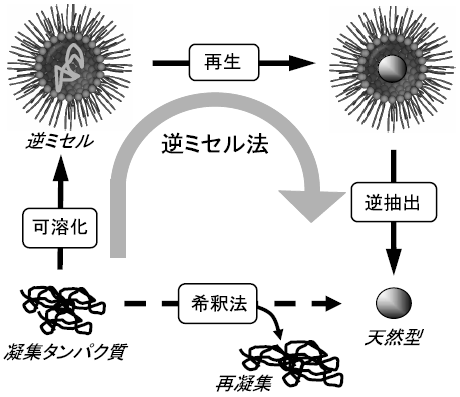
逆ミセル法は、逆ミセル内水相に変性タンパク質を個々に分離し、タンパク質が自発的に機能再生する場を提供することでリフォールディングを達成するというものである (図2)。つまり、逆ミセルへの可溶化により擬似的な無限希釈状態を作り、変性タンパク質の再生過程におけるタンパク質相互作用を抑制しようというアイデアである。この方法は大きく3つの段階から構成されており、変性タンパク質を逆ミセルに取り込む「可溶化」、変性タンパク質のリフォールディングが行われる「再生」、そして逆ミセルから再生タンパク質を回収する「逆抽出」から成る。Hagenらは変性リボヌクレアーゼA (RNase A) 溶液を調製し、アニオン性界面活性剤di-2-ethylhexyl sulfosuccinate sodium salt (AOT) を溶解した有機相 (イソオクタン) との液液抽出により変性タンパク質の可溶化を試みた。変性剤溶液に溶解したRNase A溶液を、アニオン性界面活性剤AOTに溶解したイソオクタン溶液と二相接触し、変性RNase Aを溶解した逆ミセルを調製した。ここに酸化還元試薬 (GSSG/GSH) を添加しジスルフィド結合の再結合を促進し、タンパク質の再生反応を行った。これにより、変性溶液中では完全変性状態にあったRNase Aは、逆ミセル中において活性回復を果たすことができた。しかし、変性RNase Aを逆ミセル溶液に取り込む段階で、変性剤が逆ミセル形成の阻害となりRNase Aの抽出率が非常に低いという問題点があった。
図2 逆ミセル法を用いたリフォールディング法のスキーム図
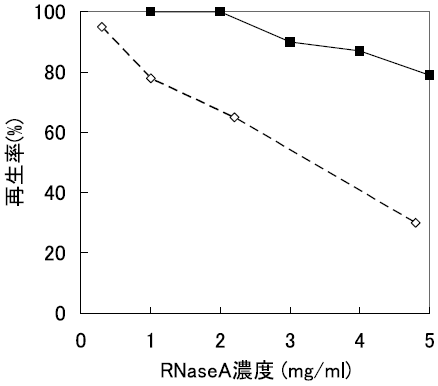
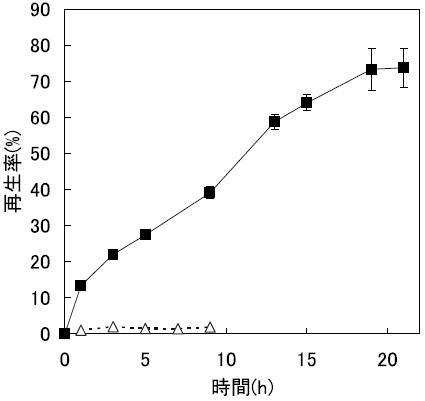
この問題点に対し、我々は、逆ミセルへの可溶化率を大幅に向上する手段として、固体変性タンパク質を用いた逆ミセル溶液への固液抽出法を確立した10,11)。これは、あらかじめ調製したAOT系逆ミセル溶液に、固体状態の変性RNase Aを直接添加し、超音波照射により変性RNase Aを逆ミセル中に溶解するというものである。固液抽出法により可溶化した変性RNase Aは逆ミセル内で完全に再生し、希釈法よりも高濃度でのリフォールディングを達成した (図3)。同様の手法によりcytochrome cのリフォールディングも可能であった12)。以上の結果から、高濃度タンパク質リフォールディング手法として、逆ミセル法が適用可能であることが示された。

次に、AOT以外の界面活性剤により形成される逆ミセルが、有効なリフォールディング場を提供するかという点について検討した。例えば、カチオン性の界面活性剤であるcetyltrimethylammonium bromide (CTAB) を用いて変性RNase Aのリフォールディングを試みたところ、AOT系と同様に100%のリフォールディングが確認された (図4)13)。しかしながら、AOT系と同程度の再生率を得るためには、約4倍の時間を要した。その1つの理由として、CTAB系逆ミセルはAOT系に比べ逆ミセル間の衝突が少ないため、酸化還元剤の供給が律速となっていることが推察された。
図4 CTAB逆ミセル法におけるRNaze Aの再生
また、変性carbonic anhydrase B (CAB) のリフォールディングをAOT及びノニオン性界面活性剤 (tetraethylene glycol dodecyl ether) 系逆ミセルで行ったところ14)、CABのリフォールディングはAOT系では促進されなかったのに対し、ノニオン性逆ミセル系では20時間後に約80%の再生率を得た (図5)。同スケールにおける希釈法では再凝集により約40%の再生率しか得られないことから、逆ミセルによる凝集抑制が再生率の向上に効果的に働いていることがわかる。この時、AOT系でリフォールディングが進行しなかったのは、界面活性剤とタンパク質間の相互作用が強すぎて、フォールディングに対して阻害的に働いたためと考えられる。一方、非イオン性界面活性剤からなる逆ミセルを用いるとリフォールディング効率が向上したことから、タンパク質の特性により界面活性剤をそれぞれ使い分けることによって、本手法が様々なタンパク質に適用可能であることが示唆された。
![]()
3.3 逆ミセルへの分子シャペロン添加効果
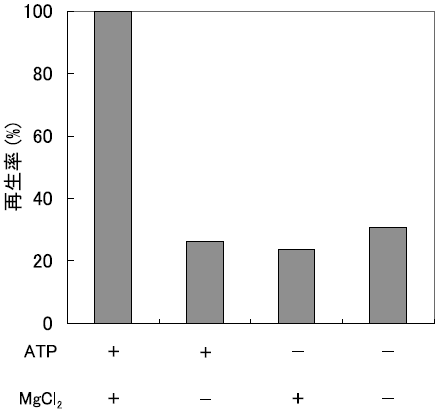
生体内でフォールディングを補助するタンパク質である分子シャペロンは、生体外においてもその効果を持つことが知られている。中でもよく研究されている分子シャペロンの一つであるGroELは、分子量57000のサブユニット7つからなるリング状の巨大タンパク質複合体が二つ重なった14量体構造を取ることで、タンパク質のフォールディングを補助するナノスケールの空洞を形成している15)。GroELは工業的に用いるにはまだ非常に高価であるので、少量を有効に用いる手段を開発することが重要である。逆ミセルは微量の水中でリフォールディングが可能であることから、バルク水中で用いるよりも少量のGroELでその効果を得ることが期待できる。そこで、AOT系において、ATP、MgCl2、GroELを溶解した緩衝液を、界面活性剤を含むイソオクタン溶液に添加する微量注入法により、GroEL内包逆ミセル溶液を調製し、固液抽出法により固体変性RNase Aを可溶化した16)。GroELを添加することによって、大幅なRNase A再生率の向上が確認され、逆ミセル内でGroELがフォールディングを効率的に補助していることが示された。また、GroELのフォールディング補助効果を誘引するための必須因子 (ATP、MgCl2) のいずれが欠損しても、この補助効果が見られないことから (図6)、GroELはバルク水中と同様の機能を逆ミセル中でも発現しているものと考えられる。
![]()
4.インクルージョンボディのリフォールディング
以上の検討においては、人工的に調製した変性タンパク質を用いてきた。一方、実際に生細胞内で生じたRNase Aインクルージョンボディを出発物質として用いることは、逆ミセル法をより実際的な高効率リフォールディング法として確立する上で重要である。そこで、大腸菌を宿主細胞として牛膵臓由来RNase Aを大量発現することによりRNase A封入体を調製し、これをリフォールディング対象として検討を行った。
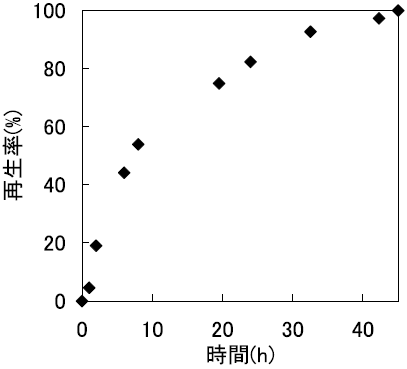
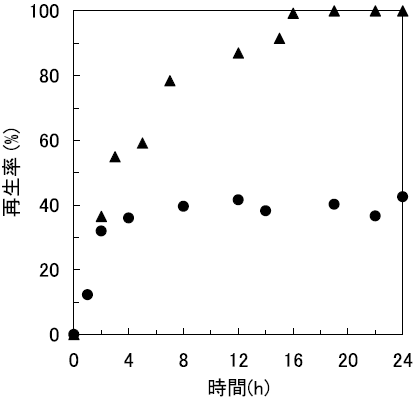
まず、逆ミセル法と希釈法によるRNase A封入体のリフォールディング挙動の違いを経時的に調べた17)。その結果、逆ミセル法による操作では約18時間で完全に再生が達成された。一方、希釈法では再生率は40%程度にとどまり (図7)、凝集体の形成が目視により確認されたことから、大部分は水溶液に不活性型として蓄積されたことが示唆された。すなわち、逆ミセル系は、インクルージョンボディに対しても有効に機能することが示唆された。また、再生したRNase Aの逆ミセルからの回収についても、逆抽出操作を行うことによって、活性を保持したまま完全に回収することが出来た。以上の結果より、逆ミセルを用いたリフォールディング法が、インクルージョンボディや変性タンパク質のリフォールディング媒体として、一つの有望な選択肢であることが示された。

5.おわりに
逆ミセル法は、逆ミセルの内水相に再生過程のタンパク質を効果的に個々に分離することで、タンパク質の再凝集に対し極めて高い抑制能力を示す。この特徴が希釈法に勝る高いタンパク質再生率を生み出す要因となっている。「可溶化」「再生」「逆抽出」という逆ミセル法の一連の操作は、分子シャペロンが行っているフォールディング補助機構と似通っており、本系は一種の人工シャペロン系であると言える。また、有機溶媒中における界面活性剤の自己集合形成を利用していることから、リフォールディング場を極めて簡便に構築できる点に大きな特色がある。実用的な観点からは、リフォールディング時間の短縮が大きな課題となるであろう。この点に対し、界面活性剤の種類や、逆ミセルへの添加物がリフォールディング速度に与える影響について、より詳細な検討を行うことが重要であると考えられる。
文献
1) Fischer, B., Sumner, I., Goodenough, P.: Biotechnol. Bioeng., 41, 3 (1993).
2) De Bernardez Clark, E.: Curr. Opin. Biotechnol., 12, 202 (2001).
3) Haque, M. E., Debnath, D., Basak, S., Chakrabarti, A.: Eur. J. Biochem., 259, 269 (1999).
4) Orsini, G., Goldberg, M. E.: J. Biol. Chem., 253, 3453 (1978).
5) Bratko, D., Luzar, A., Chen, S. H.: J. Chem. Phys., 89, 545 (1988).
6) 竹山友潔、林良茂、Talukder, M. M. R., 清水宣明、川西琢也、荻野千秋: 化学工学論文集, 29, 124 (2003).
7) 久保井亮一、森義昭、駒沢 勲: 化学工学論文集, 16, 763 (1990).
8) Adachi, M., Harada, M., Shioi, A., Sato, Y.: J. Phys. Chem., 95, 7925 (1991).
9) Hagen, A. J., Hatton, T. A., Wang, D. I. C.: Biotechnol. Bioeng., 35, 966 (1990).
10) Hashimoto, Y., Ono, T., Goto, M., Hatton, T. A.: Biotechnol. Bioeng., 57, 620 (1998).
11) Goto, M., Hashimoto, Y., Fujita, T., Ono, T., Furusaki, S.: Biotechnol. Prog., 16, 1079 (2000).
12) Sakono, M., Goto, M., Furusaki, S.: J. Biosci. Bioeng., 89, 458 (2000).
13) 河嶋優美、迫野昌文、一瀬博文、後藤雅宏、古崎新太郎: 膜, 28, 29 (2003).
14) Sakono, M., Maruyama, T., Kamiya, N., Goto, M.: Biochem. Eng. J., 19, 217 (2004).
15) Ranson, N. A., White, H. E., Saibil, H. R.: Biochem. J., 333, 233 (1998).
16) Sakono, M., Ichinose, H., Goto, M.: J. Biosci. Bioeng., 96, 275 (2003).
17) 迫野昌文、河嶋優美、一瀬博文、丸山達生、神谷典穂、後藤雅宏: 化学工学論文集, 30, 468 (2004).