【トピックス】
メタン生成古細菌の酵素系
鎌形洋一、榎 美歩
産総研・生物機能工学研究部門
1.はじめに
メタンは全く異なる二つの顔を持つ。大気に広く薄く拡散すれば二酸化炭素よりも分子あたり20倍の温室効果ガスとなり、濃縮した形であればエネルギー資源である。天然ガスはメタンを主成分としており、石油とともに最も重要なエネルギー資源である。温室効果ガスとして大気に放出されるメタンの大部分は微生物起源であり、天然ガスは地熱作用による有機物分解起源のものと微生物による有機物分解起源のものが知られている。メタン生成菌はメタンを生成しエネルギーを獲得する微生物の総称であり、そのすべては分子系統上Archaea (古細菌) に属しており、現在およそ27属のメタン生成菌が知られている。
メタン生成菌は絶対嫌気性微生物の代表であり、嫌気的な環境にのみ分布している。嫌気的な環境は地球上でも限られた場所にしかないと思われる方も多いであろうが、その実、きわめてありふれた環境である。水田、蓮田、湖沼底泥、海洋底泥、湿地、ルーメンなどの動物消化管、シロアリ消化管など、どれもが身近な嫌気環境である。海底熱水孔はメタン生成菌のかっこうの住み処として良く知られているが、これは上記のようなありふれた環境から言えば特殊な場所といえる。このようにメタン生成菌はさまざまな環境に存在し、生育温度範囲も低温環境から高熱環境 (100℃を越える環境) まで幅広い。
メタン生成菌はArchaea であることによる特徴のほかに、いくつかの独自の性質を有している。最大の特徴はエネルギー源かつ炭素源として用いることのできる基質がきわめて限定されているという点である。あるメタン生成菌は水素および二酸化炭素しか利用しないし、あるメタン生成菌は酢酸しか利用できない。このほかにメチル化合物 (メタノール、メチルアミン類など)、低級アルコール、ギ酸などがメタン生成菌の数少ない基質である。純粋分離されたメタン生成菌はこのような基質を用いれば実験室的には単独での培養が可能である。しかし、現実の環境においてはメタン生成菌はさまざまな微生物と共存しており、メタン生成菌の基質となりうるもののほとんどすべては他者、すなわち他の微生物が供給している。有機物分解の連鎖を考えた場合、メタン生成菌は最後に位置していることになる。酸素のない環境においてメタンはもはや分解されることのない物質である。メタン生成菌はそれゆえ無酸素環境における最終有機物分解者としてきわめて重要な役割を担っていると言うことができる。
メタン生成菌について研究を行っている研究者は日本では大変少ない。嫌気性微生物の取り扱いは少々厄介なのであえてこの微生物群を扱おうと思わないからかもしれない。しかし欧米においてはメタン生成菌の研究は半世紀以上に渡って活発に行われてきた。メタン生成菌の研究の裾野は大変広く、地球温暖化物質としてのメタンの発生メカニズムの解明、メタン発酵など有機性廃棄物からのエネルギー回収、膨大な未知メタン生成菌の探索分離、そしてメタン生成という全く独自の性質をもつ微生物としての生化学と遺伝学など、多岐に渡っている。
本稿では水素と二酸化炭素からのメタン生成を例に挙げ、その経路について簡単に紹介するとともに、併せて私たちの研究の一端についても紹介する。
2.水素と二酸化炭素からいかにメタンはつくられるか?
水素と二酸化炭素からのメタン生成は全体の反応式で示すと
4H2 + CO2 → CH4 + 2H2O ΔG0' = -131 kJ mol-1 -------- (a)
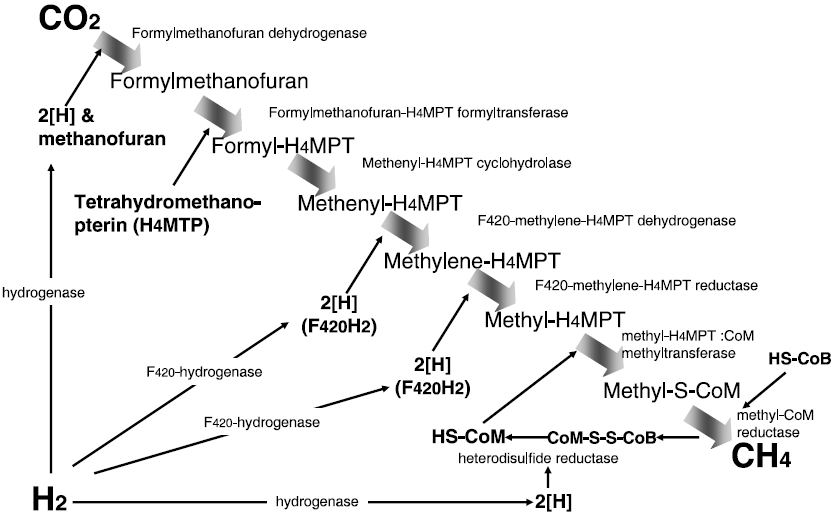
と極めて単純であるが、実際は二酸化炭素の還元がH2によって順次行われる大変複雑なものである (図1)。この一連の反応に関わる酵素、補酵素のすべてがメタン菌に特有なものである。メタン生成の生化学は1980年代における生化学研究の中でも最も輝かしい成果の一つと言って良い。メタン生成菌の研究は絶対嫌気性であるという大きな壁に阻まれていたし、主要酵素の大部分は酸素に対して著しく感受性であったため、嫌気チャンバーの中での精製が必須であった。ドイツとアメリカのいくつかのグループはこの極めて困難な課題を克服し次々とこれらの酵素を精製しその性質を調べていった1-3)。
図1 水素・二酸化炭素からのメタン生成経路
二酸化炭素はまず、第一のH2によって還元されformylmethanofuran (formyl-MFR) となる。methanofuranはメタン生成菌特有のフォルミルキャリアーである。
CO2 + MFR + 2[H] → formyl-MFR ΔG0' = +16 kJ mol-1 -------- (b)
Formylmethanofuran dehydrogenase
生成したformyl-MFRのフォルミル基はtetrahydromethanopterin (H4MPT)に受け渡され、formyl-H4MTPが生成する。H4MPTはメタン生成菌固有の補酵素であるが、テトラヒドロ葉酸のアナログと考えて良い。
formyl-MFR + H4MPT → formyl-H4MPT + MFR ΔG0' = -4.4 kJ mol-1 -------- (c)
Formylmethanofuran: H4MPT formyltransferase
生成したformyl-H4MPT はメテニル基に変換されたのち (d)、第二、第三のH2によって順次還元されてゆく (e, f)。ここで登場するF420とは電子キャリアーの一種でメタン生成菌固有の補酵素であり、構造的にはデアザフラビン骨格を持つ蛍光性補酵素である。
Formyl-H4MPT + H+ → methenyl-H4MPT + + H2O ΔG0' = -4.6 kJ mol-1 -------- (d)
Methenyl-H4MTP cyclohydrolase
Methenyl-H4MPT + + F420H2 → methylene-H4MPT + F420 + H+ ΔG0' = +5.5 kJ mol-1 -------- (e)
F420-dependent methylene-H4MTP dehydrogenase
Methylene-H4MPT + F420H2 → CH3-H4MPT + F420 ΔG0' = -6.2 kJ mol-1 ------- (f)
F420-dependent methylene-H4MTP reductase
還元反応の結果生成するCH3-H4MPTはコエンザイムM (coenzyme M, HS-CoM) に渡され、methylcoenzyme M (CH3-S-CoM) が生成する (g)。
CH3-H4MPT + HS-CoM → CH3-S-CoM + H4MPT ΔG0' = -30 kJ mol-1 -------- (g)
Methyl-H4MPT : coenzyme M methyltransferase
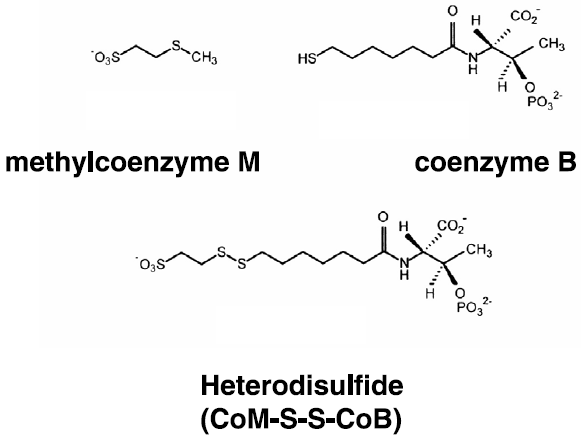
CH3-S-CoMはコエンザイムBによって還元され初めてメタンが生成する (h)。CH3-S-CoM、コエンザイムB、ヘテロジスルフィド (CoM-S-S-CoB) の構造は図2に示した通りである。
図2 メタン生成経路の最終段階に関与する補酵素群
CH3-S-CoM + HS-CoB → CH4 + CoM-S-S-CoB ΔG0' = -45 kJ mol-1 -------- (h)
Methyl-CoM reductase
ここで生成するヘテロジスルフィドは還元され、再びコエンザイムMとコエンザイムBとなり、上記g, hの反応に用いられる。
CoM-S-S-CoB + 2 [H] → HS-CoM + HS-CoB ΔG0' = -40 kJ mol-1 -------- (i)
Heterodisulfide reductase
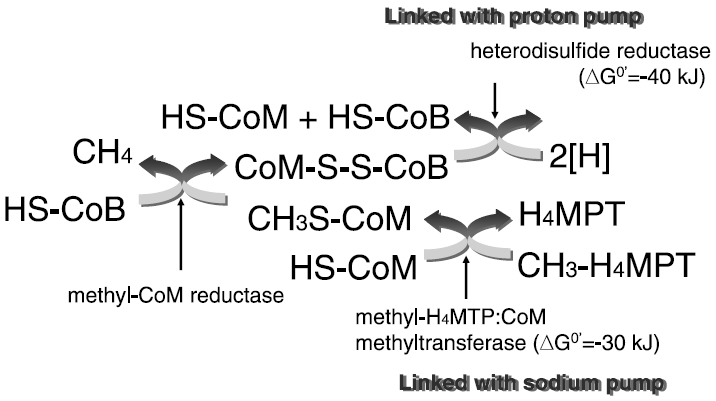
メタン生成のことをメタン発酵と呼ぶのが一般的だが、実はメタン生成は発酵ではなく、明らかに膜電位に依存したエネルギー獲得系であり、二酸化炭素を最終電子受容体とする炭酸呼吸ということができる。エネルギー獲得と共役した反応はgとiである (図3)。水素から得られる電子は、通常の電子伝達系とはおそらく異なる電子キャリアーによって受け渡されてゆくと考えられている。少なくとも水素と二酸化炭素からのメタン生成にはチトクローム様のたんぱく質は見つかっておらず、電子伝達の詳細は依然不明である。
図3 メタン生成経路の最終段階におけるエネルギー獲得様式
3.メタン生成系遺伝子の制御
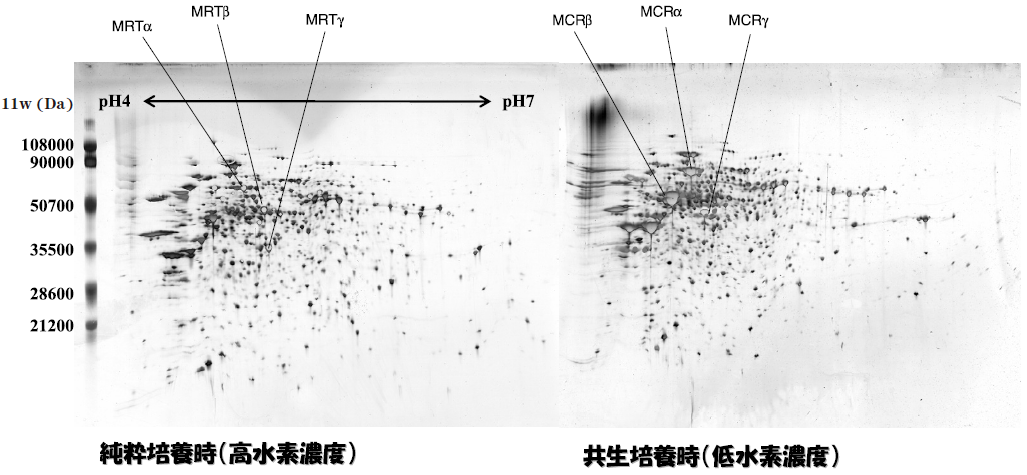
メタン生成経路に関してもうひとつの興味深い現象は、メタン生成経路中に機能が同一ではあるが異なった遺伝子にコードされたアイソザイムがいくつか存在する点である1)。これは水素資化性のメタン生成菌であるMethanothermobacter thermautotrophicusでよく知られている。例えば上記の反応 (b) を触媒する酵素 (formylmethanofuran dehydrogenase) にはモリブデン酵素 (FMD) とタングステン酵素 (FWD) の2種類のアイソザイムが存在する。また反応 (e) を触媒する酵素 (methylene-H4MPT dehydrogenase) にもMTDおよびMTHの2種類が存在している。さらに反応 (h) を触媒する酵素 (methyl-CoM reductase) にもMCRおよびMRTの2種類のアイソザイムがある。MCRとMRTはそれぞれmcrBDCGAならびにmrtBDGAにコードされている。いずれの酵素もα2 β2γ2のサブユニット構造をもっている。大変興味深いことにMCRとMRTの発現は水素濃度によって強く制御を受けている (図4)。すなわち、低水素濃度培養下ではMCRが、高水素濃度培養下ではMRTが特異的に発現する4)。この現象はメタン生成菌を高水素分圧 (およそ2 atm) で培養したときと、メタン生成菌を他の水素供与微生物と共生培養した時にもはっきりとした差となって現れる。共生培養時には水素を直接の基質にするのではなく、酢酸や酪酸といった有機酸を基質として培養する5-8)。これらの低級脂肪酸は水素供与型の細菌によって酸化され水素が発生する。生成する水素は速やかにメタン生成菌が資化するので、見かけの水素濃度は常に0.001 atm 以下に保たれる。このような条件においてはMCRが高発現する。これらの結果はメタン生成菌が水素の濃度を検知して遺伝子の発現制御を行っていることを示唆している。我々は現在プロテミクスの手法を用いて、共生培養時と純粋培養時のメタン生成菌の遺伝子発現の差異を詳細に解析しているところである。
図4 メタン生成菌M. thermautotrophicusのプロテオーム解析
4.メタン生成系遺伝子はメタン生成菌に固有のものか?
メタン生成に関わる酵素や遺伝子はメタン生成という極めて特異な反応に特化したものであり、他の微生物にはまったく類似の酵素系や遺伝子系は存在していないと考えられてきた。しかし、比較的最近、メチロトロフ (methylotrophs) の一種であるMethylobacterium extorquens にメタン生成系と極めて類似性の高い遺伝子と酵素が発見された9,10)。メチロトロフはメタノールなどのメチル化合物をエネルギー源かつ炭素源として生育する好気性の細菌 (Bacteria) で、メチル化合物を順次酸化し最終的には二酸化炭素まで酸化する (図5)。ここでF420-dependent methylene-H4MPT dehydrogenase, methenyl-H4MPT cyclohydrolase, formylmethanofuran: H4MPT formyltransferase, ならびにformylmethanofuran dehydrogenase が見いだされたのである。これらの反応は上述のメタン生成経路のe, d, c, bの反応の逆反応である。Methylobacterium は好気性の細菌であり、Archaeaであるメタン生成菌とは系統進化上全く別の微生物である。メタン生成系の酵素遺伝子系はメタン生成菌に極めて固有だと信じて疑っていなかった著者にはこの発見は大変驚きであった。ドメインを越えて (すなわち細菌とArchaea間で) C1代謝の中核的遺伝子が共通の祖先を持っていたというのは非常に興味深い。
5.おわりに
メタン生成菌は環境やエネルギーと極めて深いつながりのある微生物である。いかにメタン生成菌の活性を抑制し大気中へのメタン放出を抑えるか、一方でエネルギー回収型の水処理プロセスでいかにメタン生成菌によってメタンを高効率で作り出せるか?この相反する目的のために多くの研究者がメタン生成菌の研究に取り組んでいる。さらにメタン生成菌は上述したように極めて固有な酵素や補酵素群を有しているがゆえに多くの研究者の生化学的材料になってきた。しかし、上述のように水素濃度に応答した遺伝子の発現制御機構の解明などの重要課題についてはまさに端緒についたばかりである。
文 献
1) Thauer, R. F.: Microbiology UK, 144, 2377 (1998).
2) Schaefer, G., Engelhard, M., Mueller, V.: Microbiol. Mol. Biol. Rev., 63, 570 (1999).
3) Acharya, P., Goenrich, M., Hagemeier, C. H., Demmer, U., Vorholt, J. A., Thauer, R. K., Ermler, U.: J. Biol. Chem., on line published (2005).
4) Morgan, R. M., Pihl, T. D., Noelling, J., Reeve, J. N.: J. Bacteriol., 179, 889 (1997).
5) Hattori, S., Kamagata, Y., Hanada, S., Shoun, H.: Int. J. Syst. Evol. Microbiol., 50, 1601 (2000).
6) Luo, H-W., Zhang, H., Suzuki, T., Hattori, S., Kamagata, Y.: Appl. Environ. Microbiol., 68, 1173 (2002).
7) Hattori, S., Luo, H-W., Shoun, H., Kamagata, Y.: J. Biosci. Bioeng., 91, 294-298 (2001).
8) Hattori, S., Galushko, A. S., Kamagata, Y., Schink, B.: J. Bacteriol., in press (2005).
9) Chistosedova, L., Vor holt, J. A., Thauer, R. K., Lidstrom, M. E.: Science, 281, 99 (1998).
10) Ermler, U., Grabarse, W., Shima, S., Goubeaud, M., Thauer, R. K.: Science, 278, 1457 (1997).