【トピックス】
DNAマイクロアレイを用いた大腸菌の有機溶媒耐性関連遺伝子の探索
清水一憲、栗本昌樹、林 修平、花井泰三、大河内美奈、小林 猛、本多裕之
名大院・工
1.はじめに
化学プロセスの一部をバイオプロセスで代替することで、省エネルギーで低コストなトータルプロセスを開発するグリーンバイオテクノロジーという視点が注目されている。実際の化学プロセスを考えた場合には、様々な物質を溶解できるという利点から極性が高くて疎水性が低い溶媒、すなわち微生物に対して毒性の高いトルエン、p-キシレン、シクロヘキサンといった有機溶媒が使用されることが多く、これらの溶媒存在下でも活性を示す酵素の探索、有機溶媒存在下で生育可能な菌株の育種が必要不可欠と考えられる。
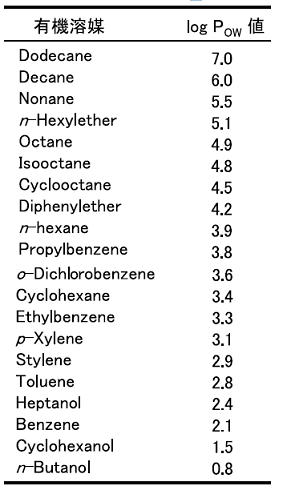
微生物に対する有機溶媒の毒性は、log POW値に相関があることが知られている1)。log POW値とは、水とn-オクタノールとの二相間における分配係数POW値の常用対数であり、物質の極性を表す。代表的な有機溶媒のlog POW値を表1に示した。log POW値が低いものほど毒性が強い有機溶媒と考えられる。有機溶媒はまず、微生物の細胞膜 (特に原形質膜) に作用すると考えられる。脂質二重膜で構成された原形質膜には、様々な酵素や輸送タンパク質が存在し、物質の透過、エネルギー代謝、細胞内圧の調節、シグナル変換などの細胞内環境の調節を行っている。有機溶媒は、このような重要な役割をもつ原形質膜に入り込み、細胞の生存能力を弱めるといわれている2)。
表1 有機溶媒とlog POW値
1989年、高濃度のトルエン中で生育可能な微生物の存在が報告され1)、これを契機に様々な微生物の有機溶媒耐性機構に関する研究が進んだ。特に、Pseudomonas属や大腸菌で研究が進んでおり、その有機溶媒耐性機構としては、有機溶媒排出ポンプの存在、急速な細胞膜修復機構、細胞膜透過性の低下、細胞膜の硬化、細胞表面の疎水度の低下などが知られている3)。大腸菌でも、突然変異あるいは形質転換によって有機溶媒耐性能を向上できることが示された。青野らが既に取得したJA300株の自然突然変異株ではシクロヘキサン抵抗性を示す4)。これはmar-soxレギュロンに関連した変異であることが分かっている5,6)。MarAは、129アミノ酸からなるタンパク質でmar-sox レギュロンの転写因子である。mar-sox レギュロンには、acrAB、tolC といった排出ポンプタンパク質をコードする遺伝子が存在するため、marAが高発現になると、acrAB、tolC も高発現となり、有機溶媒耐性が向上する。また、大腸菌の有機溶媒耐性関連遺伝子としてimp/ostA7-9)、pspA10)といった、marAとは別の遺伝的要因も報告されている。
われわれは、大腸菌の新規有機溶媒耐性関連遺伝子の発見にDNAマイクロアレイが有効であると考え、研究を行ってきた。これまでに、大腸菌JA300株とその変異株OST3410のDNAマイクロアレイデータより、生化学的知見なしに有機溶媒耐性関連遺伝子としてmarAを選び出すことに成功した11)。本稿では、JA300、OST3410に加え、JA300より新たに獲得した変異株TK33、TK31を用い、そのDNAマイクロアレイデータより複数の新規有機溶媒耐性関連遺伝子を見つけることに成功したので紹介する12,13)。
2.有機溶媒接触後の遺伝子発現データ
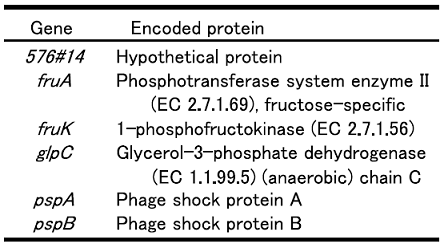
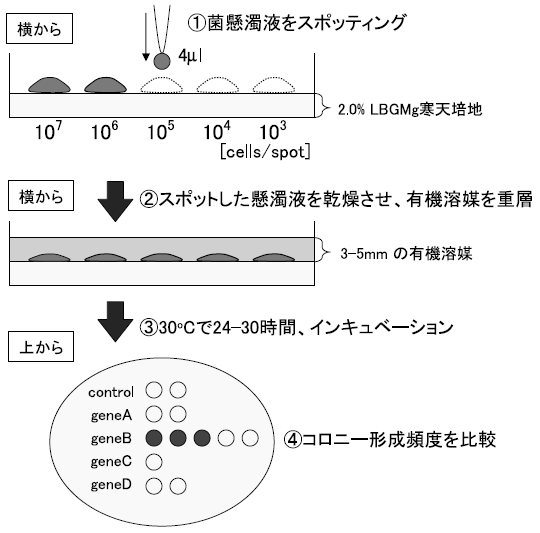
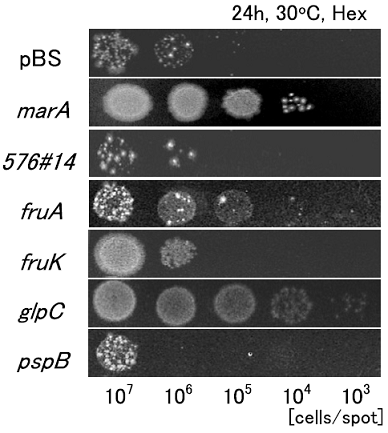
OST3410、TK33、TK31の有機溶媒接触前と接触後の遺伝子発現を、DNAマイクロアレイを用いて比較した。それぞれの菌株をシクロヘキサン、シクロヘキサン:p-キシレン=1:1混合溶媒、p-キシレンに接触させた。その結果、有機溶媒接触30分後に2倍以上高発現した遺伝子数は、OST3410で129個、TK33で17個、TK31で11個になった。この中から3株に共通して高発現した遺伝子と、耐性度の強い2株で共通して高発現した遺伝子を耐性関連候補遺伝子として選んだ。表2が選ばれた遺伝子である。この中の、pspAは有機溶媒耐性との関連性がすでに報告されていた10)。そこでpspAを除く5つの候補遺伝子をそれぞれJ A300内で高発現させ、LBGMg寒天培地による耐性度評価を行った。評価方法の概要を図1に示す。その結果、図2に示すようにglpC を高発現させたJA300で有機溶媒耐性度が顕著に向上した。
表2 選択した高発現遺伝子
図1 耐性度評価方法
図2 耐性度評価の結果①
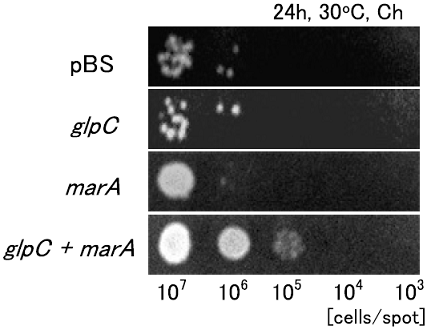
glpC がmar-sox レギュロンに含まれるという報告はない14)。そこで、marAとglpCを同時に高発現させると、さらに有機溶媒耐性度が向上するのではないかと考えた。marAとglpCを同時に高発現するJA300を作製し、LBGMg寒天培地による耐性度評価を行ったところ、図3のようにmarA、glpCをそれぞれ高発現させるよりも強い有機溶媒耐性度を示した。
図3 marAとの組み合わせ
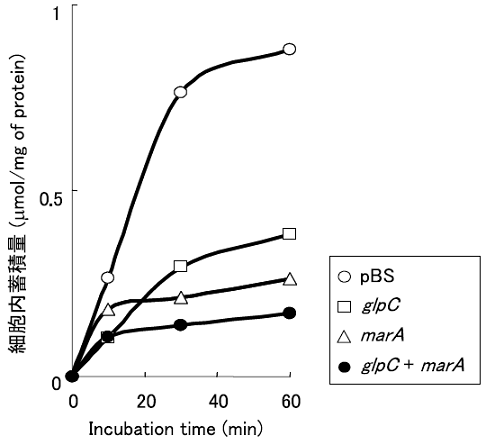
有機溶媒に耐性をもつ株では、細胞内有機溶媒蓄積量が低く抑えられていることが知られている15)。そこで、marAとglpCを同時に高発現させた株の細胞内有機溶媒蓄積量を測定した。図4に示すように、marAとglpCを同時に高発現させた株の細胞内有機溶媒蓄積量は、glpC、marAをそれぞれ高発現させた株よりも低く、コントロールである空のプラスミドを導入したJA300の4分の1ほどであった。
図4 細胞内有機溶媒蓄積量
以上のことから、glpCは大腸菌の有機溶媒耐性度を向上させることがわかり、その耐性機構はこれまでに知られているMarAによる耐性機構とは違うものであることが示唆された。予備的な実験の結果からではあるが、glpC高発現株の細胞表面疎水度の低下が耐性度の向上に寄与しているのではないかと考えている。
3.時系列遺伝子発現データ
有機溶媒接触30分後にglpC、pspAといった有機溶媒耐性関連遺伝子の発現が誘導されることがわかった。しかし、その遺伝子発現が何によって誘導されるのかはわかっておらず、そこには有機溶媒耐性機構を作動させる『引き金』になるような遺伝子が存在することが考えられた。
そこで、TK31の有機溶媒接触0分後、1分後、2分後、5分後、10分後、30分後のDNAマイクロアレイデータを獲得した。接触させた有機溶媒は、シクロヘキサン: p-キシレン=6:4の混合溶媒である。
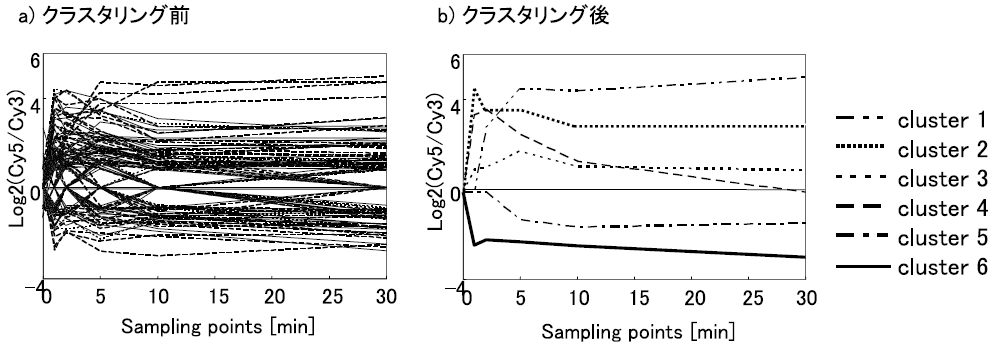
得られた時系列DNAマイクロアレイデータは、Fuzzy Adaptive Resonance Theory (Fuzzy ART) を用いて解析した。Fuzzy ARTは本研究室で開発した時系列遺伝子発現データのクラスタリング手法で、たくさんの遺伝子の中で発現パターンの似ている遺伝子をひとつのクラスターとして考えることができる16-18)。獲得した時系列遺伝子発現データにFuzzy ARTを適用したところ、6つのクラスターに分類された (図5)。高発現した遺伝子はクラスター1から4に、低発現した遺伝子はクラスター5、6に分類された。
図5 Fuzzy ARTの結果
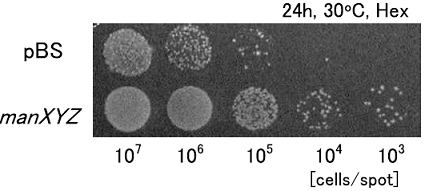
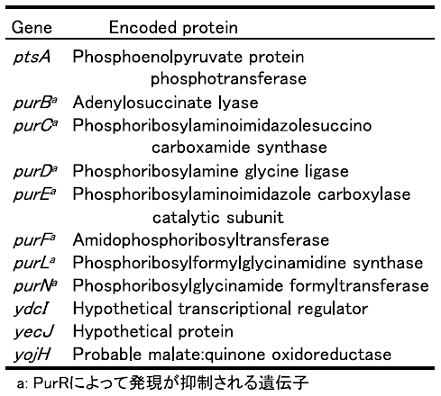
これらのクラスターについては現在解析中であるが、これまでにわかったことを一部紹介する。有機溶媒接触後、徐々にその発現量が多くなる遺伝子が分類されたクラスター1には、pspA、pspB、ibpA、ibpB といったストレスによって誘導される遺伝子が含まれていた。接触1分後から徐々に高発現となるクラスター2には、glpCが含まれていた。有機溶媒耐性関連遺伝子であるpspAとglpCが違うクラスターに分類されたことから、大腸菌の有機溶媒耐性には複数の機構が存在することが示唆される。クラスター4に含まれたmanXYZをJA300内で高発現させ、耐性度評価を行ったところ有機溶媒耐性度が向上した (図6)。manX、manY、manZをそれぞれ単独で高発現させても耐性度に変化がなかった。また、クラスター6には11個の遺伝子が含まれ、そのうちの7遺伝子がプリン生合成系のリプレッサーであるpurRに発現を抑制される遺伝子であった (表3)。purR高発現株、purR欠損株を用いてLBGMg寒天培地による耐性度評価を行ったところ、purR高発現株では有機溶媒耐性度が向上し、purR欠損株では、有機溶媒耐性度が低下した (図7)。引き続き解析を続け、大腸菌の有機溶媒耐性の『引き金』となる遺伝子を発見したいと考えている。
図6 耐性度評価の結果②
表3 cluster6に含まれた遺伝子
図7 耐性度評価の結果③
4.おわりに
近年、化学反応プロセスへの生体触媒の利用が進んでいる19)。化学反応プロセスの基質は多くが疎水性であるため、水と有機溶媒の二相系反応が多く用いられる。二相系反応では、有機溶媒相中の疎水性基質がわずかずつ水相に溶け出し、その基質を水相中の生体触媒が変換する。その際、生体触媒に対する有機溶媒の毒性が問題となるが、有機溶媒耐性微生物は、それ自体が生体触媒あるいは酵素遺伝子の宿主として、有機溶媒相の毒性に影響されず様々な化学反応を触媒することができるため、工業的に利用されることが多くなると考えられよう。
本稿で紹介したような方法を用いると、これまで明らかにされていなかった遺伝子の新たな機能が解明できる。大腸菌で得られた知見が微生物間でCommon principleになっている機能もあろう。そういった原理を組み合わせ、工業上有用な微生物の有機溶媒耐性機構を増強することで、有機溶媒耐性微生物の化学反応プロセスでの利用がさらに広がっていくことを期待している。
謝辞
本稿は、経済産業省の産業科学技術プロジェクト『生物機能を活用した生産プロセスの基盤技術開発』の一環として、新エネルギー・産業技術総合開発機構 (NEDO) から委託を受けて実施した研究成果をまとめたものである。
本研究を推進するに当たり、有機溶媒耐性のメカニズムや遺伝子発現結果の解析に関して数々の有益なご助言をいただいた故 青野力三東京工業大学教授に深謝申し上げます。また、青野先生と同様議論に加わっていただき、細胞内の有機溶媒量を測定していただいた道久則之先生 (現東邦大学助教授) に感謝いたします。また、大腸菌変異株を快く分譲くださいました森浩禎奈良先端科学技術大学院大学教授、馬場知哉慶應義塾大学講師に感謝いたします。
文献
1) Inoue, A., Horikoshi, K.: Nature, 227, 264 (1989).
2) Sardessai, Y. N., Bhosle, S.: Biotechnol. Prog., 20, 655 (2004).
3) Ramos, J. L., Duque, E., Gallegos, M. -T., Godoy, P., Ramos-Gonzales, M. I., Rojas, A., Teran, W., Segura, A.: Annu. Rev. Microbiol., 56, 743 (2002).
4) Aono, R., Aibe, K., Inoue, A., Horikoshi, K.: Agric. Biol. Chem., 55, 1935 (1991).
5) Nakajima, H., Kobayashi, M., Negishi, T., Aono, R.: Biosci. Biotech. Biochem., 59, 1323 (1995).
6) Asako, H., Nakajima, H., Kobayashi, K., Kobayashi, M., Aono, R.: Appl. Environ. Microbiol., 63, 1428 (1997).
7) Aono, R., Negishi, T., Nakajima, H.: Appl. Environ. Microbiol., 60, 4624 (1994).
8) Aono, R., Negishi, T., Aibe, K., Inoue, A., Horikoshi, K.: Biosci. Biotech. Biochem., 58, 1231 (1994).
9) Abe, S., Okutsu, T., Nakajima, H., Kakuda, N., Ohtsu, I., Aono, R.: Microbiol., 149, 1265 (2003).
10) Kobayashi, H., Yamamoto, M., Aono, R.: Microbiol., 144, 353 (1998).
11) Hayashi, S., Aono, R., Hanai, T., Mori, H., Kobayashi, T., Honda. H.: J. Biosci. Bioeng., 95, 379 (2003).
12) Shimizu, K., Hayashi, S., Kako, T., Suzuki, M., Tsukagoshi, N., Doukyu, N., Kobayashi, T., Honda, H.: Appl. Environ. Microbiol., 71, 1093 (2005).
13) Shimizu, K., Hayashi, S., Doukyu, N., Kobayashi, T., Honda, H.: J. Biosci. Bioeng., 99, 72 (2005).
14) Barbosa, T. M., Levy, B. S.: J. Bacteriol., 182, 3467 (2000).
15) Tsukagoshi, N., Aono, R.: J. Bacteriol., 182, 4803 (2000).
16) Tomida, S., Hanai, T., Honda, H., Kobayashi, T.: Bioinformatics, 18, 1073 (2002).
17) Takahashi, H., Tomida, S., Kobayashi, T., Honda, H.: J. Biosci. Bioeng., 96, 154 (2003).
18) Kato, N., Kobayashi, T., Honda, H.: Cancer Sci., 94, 644 (2003).
19) Schmid, A., Dordick, S. J., Hauer, B., Kiener, A., Wubbolts, M., Witholt, B.: Nature, 409, 258 (2001).