【トピックス】
薬剤排出蛋白質の構造と機能~多剤耐性の克服を目指して
村上 聡
阪大・産業科学研
1.はじめに~“薬が効かない!”
1929年の微生物学者フレミングによるペニシリンの発見以後、多くの抗生物質や化学療法剤が種々の微生物から発見、単離されてきた。またこれらを人工的に化学修飾した誘導体も数多く開発されてきた。これらは広く臨床の現場で用いられ、感染症の治療に多大なる貢献を果たしてきた。しかし、あまりにも広範、かつ頻回の使用はこれら化学療法剤の効かない病原性微生物の選択、すなわち薬剤耐性菌の選択という負の結果ももたらした。
我が国では2002年1月に東京都内の病院で薬剤耐性セラチア菌 (Serratia marcescens) による院内感染で7人が死亡したことに続き、翌2月には新潟市内の病院で多剤耐性緑のう菌 (Pseudomonas aeruginosa) による国内で初の死亡例が確認された。こういった薬剤耐性菌は、院内感染や市中感染により広がりをみせ、現在では感染症の約8割が何らかの薬剤耐性菌であると言われている。また最近では、単一の薬剤だけではなく、化学構造や作用機序が全く異なる複数の薬剤に対して耐性を持つ多剤耐性菌が相次いで発見され、臨床の現場においても大きな問題となってきている。
病原性細菌が抗生物質などの化学療法剤に対して、耐性となる機構としては、(1) 細菌細胞外への薬剤の能動的排出、(2) 薬剤作用点の薬剤親和性低下、(3) 修飾酵素、分解酵素による薬剤不活化、(4) 細菌細胞表層の変化による薬剤透過性低下、(5) 薬剤により阻害を受ける酵素の代替酵素の生産、の5つに分類できる。多くの多剤耐性化はこれらの要因が複雑に絡み合った結果であるが、このうち能動的排出による薬剤耐性のみは、単一の要因によって多剤耐性をもたらす。この多剤の能動的排出に関わる原因蛋白質こそが、多剤排出蛋白質である。また、薬剤を排出するものを単に多剤排出蛋白質とよぶ。
このような薬剤排出蛋白質は原核細胞から、我々ヒトの細胞にいたるまで生物界広範にわたって存在する最も基本的な生体防御機構であることが昨今のゲノム解析の成果により明らかとなった。ヒトの細胞で薬剤排出蛋白質が発現する場合の問題として、抗癌剤耐性が挙げられる。癌の治療としても種々の化学療法剤が使用されているが、抗癌剤が初めから効かない、または治療の進行に伴って抗癌剤の治療効果が低下し効かなくなっていくという事例が増加している。抗癌剤耐性の原因としても、薬剤の能動的排出による耐性化が最も大きな要因であることが知られている。抗癌剤耐性に関わる薬剤排出蛋白質は、全く構造式の異なる種々の抗癌剤を排出する特徴を有している。
これら臨床の現場で問題となっている多剤耐性を克服するためには、多剤排出蛋白質の基質認識機構を明らかにし、この蛋白質によって認識されないような化学構造を持つ新しい化学療法剤を開発すること、あるいは、多剤排出蛋白質の阻害剤を開発することが必要であると考えられる。従って、多剤耐性の克服のためには、まずこのような一群の薬剤排出蛋白質の構造-機能連関を明らかにする必要がある。膜輸送体において基質がどの部位で認識されるのか? 化学構造の異なる多種多様な薬剤をどのような仕組みで基質として認識しているのか? という課題に対しては、現在でも多くの研究努力が捧げられている。
また一般に酵素化学の教えるところによると、酵素蛋白質は基質分子を立体構造的に極めて厳密に認識するとあり、それは、“鍵と鍵穴”の関係に例えられている。しかし、多剤排出蛋白質は、この法則に反する一見ルーズな基質認識機構を持つといえる。しかし、一方で細胞の育成や恒常性維持のために必要な有用物質を誤って漏らしてしまうことは無いという厳密さも兼ね備えている。このユニークな基質認識機構の解明は、多剤耐性化克服などの臨床応用への意義ばかりでなく、基礎生化学的にみても大変興味深い課題である。これらの問題に対して最も直接的な解を与える情報は、高解像度の立体構造である。しかし、薬剤排出蛋白質に限らず膜輸送体は、その疎水性の高さのため結晶化が非常に困難であり、筆者による構造解析成功以前には高解像度の立体構造解析は全く行われていなかった。
2.膜輸送蛋白質
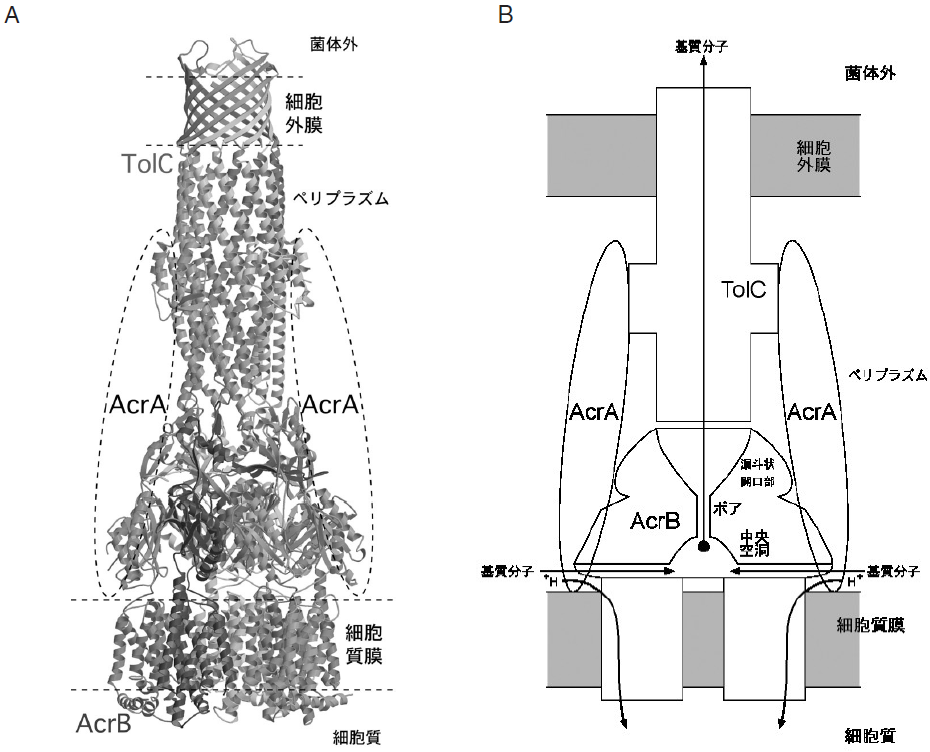
大腸菌のゲノム解析の結果、大腸菌には薬剤排出蛋白質と推定される遺伝子が、34個存在していることが明らかとなった。これらのうちAcrAB系は、菌体内で恒常的に発現している最も主要な薬剤排出系であり、大腸菌の薬剤自然抵抗性の主因でもある。それは、膜蛋白質で能動的排出に関わるポンプ本体のAcrB の他に、膜融合蛋白質と呼ばれるAcrA、外膜貫通チャネルTolCと三者複合体を形成し機能している1)。AcrBは、膜を介したプロトン濃度勾配をエネルギー源として化学構造や静電的特徴が異なる抗生物質、抗癌剤、色素系毒素や界面活性剤など多種多様な化合物を能動輸送する膜輸送蛋白質 (トランスポーター) と呼ばれる膜蛋白質である。AcrAは光散乱による知見から細長い分子であると推定されており、細胞膜と外膜とを繋ぐか、あるいは融合させると推定されている。基質が結合することによってAcrAB複合体はTolCを誘引し一時的に三者複合体をつくり、細胞膜、外膜の両方を貫通する大きな複合体を形成すると考えられている。TolCの結晶構造は2000年ケンブリッジ大学のKoronakisらによって解明されたが2)、それによると、TolCは、40 Åの厚みを持つβバレルからなる外膜貫通チャネル部分と100 Åもペリプラズムにつきだしたα-へリックスの束からなるトンネル構造がつながった大きな筒状の構造をしていた。
膜蛋白質の結晶構造決定は大変困難であるこ とは良く知られている。それは、全蛋白質構造解析例における膜蛋白質のしめる割合が、1%に満たないことからも想像できる。膜蛋白質結晶化が困難であることがその要因である。筆者らは組換え大腸菌を使って多剤排出蛋白質AcrBを大量生産させ、界面活性剤ドデシルマルトシドを使って膜から抽出し純化した後、その結晶化に成功した。大型放射光施設SPring-8 (播磨・兵庫県) の強力な高輝度放射光を結晶に照射し、回折強度データを収集し、構造解析計算を行い、解像度0.35 nm で立体構造を明らかにした。この成果は多剤排出蛋白質として世界初の立体構造解析となったが、膜輸送体としてもまた初めての構造解析例であり、英科学誌Natureの表紙を飾った3)。
3.立体構造
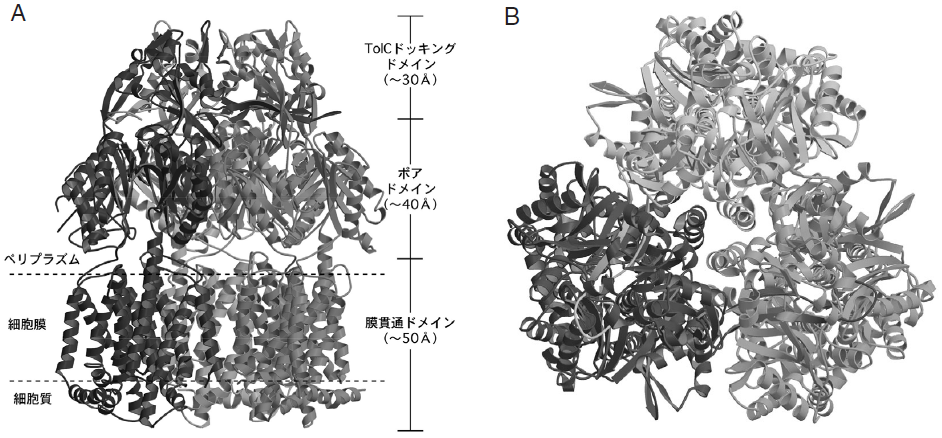
AcrBは1049アミノ酸から成るポリペプチドを一つのモノマーとして、それらが三個絡み合った三量体蛋白質である (図1)。結晶化前の溶液状態でも三量体で存在することが示されており、生理的条件下でも三量体を形成していると強く示唆している。三量体は膜と垂直な三回対称性を持ち、全体としてはクラゲのような形をしていた。細胞膜からペリプラズムに突き出した親水性部分と、膜貫通部分を形成しているクラゲの足の部分から成り、各々約70 Åと約50 Åの厚さを持つ。親水性部分および膜貫通部分の最大径は、各々約100 Å、約80 Åである。頭の部分は横から見るとほぼ台形をしており、さらに上下二層に分かれている。外膜チャネルであるTolCは細胞外膜よりペリプラズムに約100 Å突き出ていることが結晶構造より解っており2)、ペリプラズム側に突き出ているAcrBと合わせると約170 Åとなる。これはペリプラズム空間を横切るのに十分な長さを持つ (図2)。またAcrBの先端部の直径とTolC底部の直径とはほぼ等しい2)。これらのことより、AcrBとTolCは直接結合することが示唆され、そのため、ペリプラズム上層ドメインをTolC結合ドメインと名付けた。TolC結合ドメイン先端には膜面に対して垂直なヘアピン構造が単量体あたり2本存在する。また同じくTolC下端にも2本のヘアピン構造が存在する。これらは歯車のように相補的に対合し、密着した結合部を形作ることが構造的に示唆された3)。そしてこの程、システイン残基導入による共架橋体形成実験により、AcrBとTolC 分子の直接的相互作用が実験的にも明らかとなった4)。


親水頭部の下層には、3つのα-ヘリックスからなるチャネル様の構造を持つ“ポア”が存在した。このポアは、三量体各々から1本ずつα-ヘリックスを出しあって形成されている。ポアの下端は細胞膜の界面近くに存在する空間に達し、上端はTolC結合ドメインにあるロート状開口部の底と連結している。今回得られた結晶構造中ではこのポアは閉じており、おそらく結合基質が存在しないためと思われる。このポアを持つペリプラズム下層ドメインをポアドメインと名付けた。ポアヘリックスに含まれるすべてのアミノ酸を一つずつシステイン残基に変異させる部位特異的変異導入と、それらの活性測定からも、ポアが薬剤排出活性に重要な役割を持つことが明らかになっており5)、さらにそのポアが動くことが活性に必須であるということもこの程明らかになった。
4.基質輸送経路
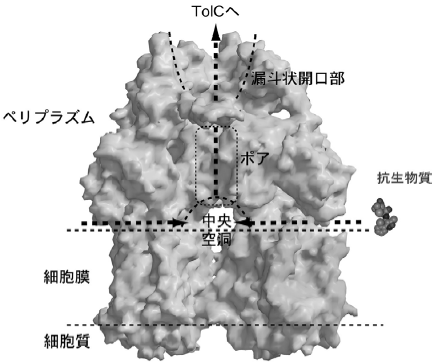
図3にAcrBの溶媒接触表面を示す。内部の構造を示すために三量体のうち紙面手前側にある単量体を取り除き描いた。頭頂部のロート状開口部の底は狭くなり、そしてポアへと接する様子がわかる。ポア下端の分子中央部より下側には三量体の隙間が存在する。それは細胞質にも及んでいる。その穴のうち、膜貫通部分に相当する空間はリン脂質で満たされているはずである。さもなくば、AcrBは膜に穴をあけ、脱供役させてしまうだろう。そうイメージすると、ポアの終端と膜表面との間に15 Åほどの大きさの空洞が形成される。その空間へ向かって、細胞膜のペリプラズム側すれすれのところから通路が形成されている様子が図3でも分かる。ペリプラズムあるいは脂質二重膜外葉表面に存在する基質はそこから分子内部に入ると考えている6)。細胞質からの基質輸送経路についてはどうだろうか? いまのところ、細胞膜を介した輸送経路を同定出来ていない。あるいは存在しないのではないかという議論さえある。AcrBの基質となる生体異物が細胞内に進入してくる経路は、単純拡散による細胞膜への分配から始まり、フリッププロップによる内葉への移動、そして細胞質への拡散へと続く。従って細胞膜外葉からの能動的排出のみで、薬剤の細胞内からの排除も説明がつくのかもしれない。
![]()
5.膜輸送蛋白質による薬剤排出機構
我々は、AcrB結晶構造に基づく多剤輸送の分子メカニズムを提案した3,6)。またAcrBとTolCが直接相互作用することを示した。基質が輸送されるとき、AcrBはTolCを誘導して結合し、細胞質から細胞外環境までを直接繋ぐようなダクトを形成するのだろう (図2)。AcrAB-TolC系は化学構造が異なる多種多様な薬剤を基質とし、ペニシリンを始めとするβ-ラクタム系抗生物質に対しても耐性化を付与する特徴を持つ。β-ラクタム系抗生物質の標的は、細胞壁の生合成に関わるペリプラズム酵素である。AcrBのような膜輸送体は内膜に存在し、膜を介した水素イオン濃度勾配をエネルギー源にしているため、細胞質膜の外側であるペリプラズムに存在し機能する基質に対して能動的排出を行うことは出来ないとこれまで考えられていた。しかし、AcrBはこれらペリプラズムで働く薬剤に対しても耐性を与える。この矛盾に対してカリフォルニア大学の二階堂らは、1994年にAcrBには2種類の基質取り込み口があるに違いないというDual-Entrance Modelを提唱した。このモデルでは、質二重膜の内葉と外葉の両方から基質を取り込むとされていた7)。この仮説に対して今回のAcrBの結晶構造解析が初めて直接的な裏付けとなった。前述のように、ペリプラズム側方に開く通路が発見され、ペリプラズムと脂質二重膜の外葉に存在する基質を分子内の空洞に取り込む可能性が明らかになった。分子中央の空洞に集められた基質は、ポア、漏斗状開口部を経て、それからTolCへと輸送されているのだろう (図2)6)。
膜貫通部分に存在するイオン対は、膜を介したプロトン輸送経路の候補だろう。これらのアミノ酸同士の結合状態の変化が、それを含むヘリックスの構造変化を引き起こし、遠隔構造変化伝搬によりポア部分に構造変化が起こる。これが能動輸送の鍵となる部分であると考えている。
これまで立体構造が明らかになった他のファミリーに属する膜輸送体の膜貫通部分8,9)には、細胞膜を介してどちらかに対して開いたV字型の構造がみられた。開いた側から基質を取り込み、ATPの加水分解や、プロトンエネルギーとの共役で構造変化を起こし、反対側に対して開いた (逆V字) 構造になり、親和性の変化により基質を放出すると考えられており、古くから考えられていた膜輸送体による基質分子の膜輸送モデルが概ね正しかったことが構造をもとに解ってきた。一方でAcrBの膜貫通部分には、このようなVの字型構造は見られなかった。しかし、これと同様の構造が水溶性ドメインの中央に位置するポアに存在した。
つまり驚くべきことに、能動的膜輸送は、膜貫通部分でなく水溶性ドメインのポアで起こっていた。しかし、このことはAcrBが細胞質や膜中に存在する基質だけでなく、ペリプラズムに存在する基質もまた等しく排出する事実を考えると、極めて合理的な構造であることに気づく。また、ペリプラズムから薬剤を排除するには、外膜貫通チャネルの助けも借りなければならず、全体として細胞内膜、外膜を貫く大きな複合体を形成して働くのだろう。ペリプラズム空間にはペプチドグリカン層という多糖類で出来た細胞壁が存在する。ペリプラズムに100 Åも突き出たTolCの水溶性のトンネル部分は、おそらくこのペプチドグリカン層によって捕捉されることにより側方拡散を抑制され、AcrAB複合体のみが側方拡散が可能であるように思われる。詳細な反応機序は今後明らかになることが期待されるが、AcrABが構造変化を起こし、ペプチドグリカン層から足を覗かせているTolC分子を捜して一時的に結合し、細胞内膜から外膜を一気に貫く巨大な超分子複合体を形成し、基質の受け渡しが行われる。基質の受け渡しが終わると複合体は解離し、ターンオーバーが完結するのだろう。またこれらの結合解離過程をAcrAが側方から媒介するのだろう6)。
今後、さらに構造解析の精度を上げることにより、より詳細なメカニズム解明を目指すほか、薬剤や他の構成成分であるAcrAやTolCとの複合体の構造解析を行うことにより、多剤の認識とそれに続く排出メカニズムの本質的理解に迫りたいと考えている。こうして薬剤排出蛋白質の構造情報を得たということで、薬剤結合部位、プロトン透過経路、薬剤の輸送経路、外膜チャネルとの結合部位、AcrAとの結合部位など、AcrAB-TolC系の機能に関わる重要な部分、言い換えると薬剤設計のための“攻めどころ”の情報が多く得られた。このことにより多剤耐性化問題克服のために、さらに戦略的にドラッグデザインなどの知識を応用することができるようになった。これらの知見が薬剤耐性化問題の克服につながることを期待したい。
謝辞
本研究は、阪大産研の中島良介博士研究員と、山口明人教授、阪大蛋白研の山下栄樹助手との共同によるものである。阪大蛋白研の月原冨武教授、中川敦史教授の支援と協力をいただいた。著者は深く感謝の意を捧げます。執筆の機会を与えて下さった松浦友亮博士に感謝いたします。
文献
1) Nikaido, H.: Trends Microbiol., 8, 481 (2000).
2) Koronakis, V., Sharff, A., Koronakis, E., Luisi, B., Hughes, C.: Nature, 405, 914 (2000).
3) Murakami, S., Nakashima, R., Yamashita, E., Yamaguchi, A.: Nature, 419, 587 (2002).
4) Tamura, N., Murakami, S., Oyama, Y., Ishiguro, M., Yamaguchi, A.: Biochemistry, 44, 11115 (2005).
5) Murakami, S., Tamura, N., Saito, A., Hirata, T., Yamaguchi, A.: J. Biol.Chem., 279, 3743 (2004).
6) Murakami, S., Yamaguchi, A.: Curr. Opin. Struct. Biol., 13, 443 (2003).
7) Nikaido, H., Basina, M., Nguyen, V., Rosenberg, E. Y.: J. Bacteriol., 180, 4686 (1998).
8) Reyes, C. L., Chang, G.: Science, 308, 1028 (2005).
9) Abramson, J., Smirnova, I., Kasho, V., Verner, G., Kaback, H. R., Iwata, S.: Science, 301, 610 (2003).