【トピックス】
ペプチドベクターを用いた細胞内移送
二木史朗
京大・化研
1.はじめに
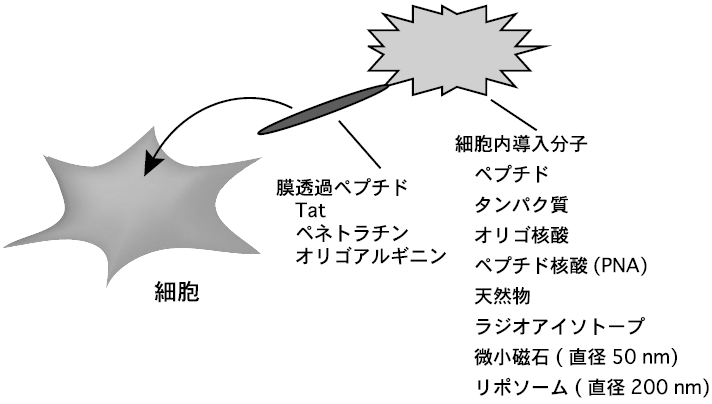
近年、膜透過性を有するペプチドベクターを用いて、細胞内にタンパク質を導入する手法が注目されている (図1)1)。細胞内に導入したいタンパク質にベクターを化学的に結合させるか、あるいは遺伝子工学的にこれらの分子を融合したタンパク質を調製し、細胞培養液に単に加えることにより、細胞への導入は達成される。タンパク質に限らず、薬物、オリゴ核酸、リポソームなどの様々な物質がこの方法を用いて細胞内に導入されたことが報告され、細胞生化学的な基礎的研究のみならず、臨床的応用も視野に入れて研究が進められている。本稿では、ペプチドベクターを用いるタンパク質の細胞内導入法とその最近のトピックスに関して概説する。
図1 膜透過ペプチドベクターを用いる細胞内移送
2.従来のタンパク質細胞内導入法とペプチドベクターを用いる導入法
現在、細胞内でのタンパク質の働きを調べるために最もよく行われている方法は、目的タンパク質をコードする遺伝子を細胞内に導入し、発現させる方法である。この際問題になるのは導入効率と毒性である。前者に関しては、例えばカチオン性リポソームなどを用いてトランスフェクションする場合には、通常、たかだか数十%の細胞に目的タンパク質が発現するに過ぎない。特に、神経細胞など分裂しにくい細胞においては、導入効率の低さが問題になる場合が多い。また、遺伝子導入の際に用いられるリポソームやポリマーなどの導入補助剤は、多くの場合、細胞毒性を伴う。ウイルスベクターを用いて導入する方法には、感染性や抗原性などの問題が未解決である。
ペプチドベクターを用いる方法では、あらかじめ、目的タンパク質とペプチドベクターとの化学的架橋体あるいは遺伝子工学的に調製した融合タンパク質を作製せねばいけないが、上手く行けば、ほぼ全ての細胞に数分から数十分程度の短時間で目的タンパク質を導入できる。遺伝子導入の際には、血清存在下ではしばしば導入効率が低下することが多いが、ペプチドベクターを用いる方法では血清は細胞内移行効率にさほど影響しない。また後述のTat ベクターなどにおいては、数十µM程度の濃度で細胞を処理しても顕著な毒性はみられない。
ペプチドベクターを用いる方法のもう一つの利点は、天然アミノ酸からなるタンパク質以外の様々な分子や原子団を細胞内に導入できることである。化学的に合成・修飾した分子を導入することが可能であり、たとえば、親水性が高すぎるためにそのままでは細胞膜を透過できない薬物、細胞内での活性強化のためにD-アミノ酸や非天然アミノ酸を組み込んだペプチド・タンパク質、細胞内可視化のための蛍光物質やこれらでラベルしたタンパク質などの導入も可能である。もちろん、ペプチドベクターを用いる方法の限界はあるものの、上記の利点は細胞導入への新しい可能性を示すものといえる。
3.膜透過ペプチドベクター
それでは、実際にどのようなペプチドが導入ベクターとして報告されているだろうか?膜透過ペプチドを用いるアプローチが注目を集めるにつれ、様々な新規ベクターが報告されてきているが、代表的なものとして、(1) アルギニンなどの塩基性アミノ酸に富むもの: HIV-1 Tatタンパク質のアミノ酸配列48-60位に対応するペプチド配列 (Tatペプチド) やオリゴアルギニンなど、(2) 塩基性部分と疎水性部分を有する両親媒性ペプチド: Drosophila のAntennapedia タンパク質由来ペプチド (penetratin) など、(3) 疎水性配列に若干の塩基性配列を含むペプチド:神経ペプチドgalanin とハチ毒mastoparan のキメラペプチドであるtransportan、(4) 疎水性ペプチド:膜タンパク質のシグナルペプチド由来ペプチドMTS、などがあげられる (表1)。これらのペプチドはcell-penetrating peptide (CPP) あるいはprotein transduction domain (PTD) とも総称されている。Tat、オリゴアルギニンあるいはAntennapedia由来ペプチドは、これらの中でももっとも頻繁に使われており、以下、本稿では特に断らない限りは、(1) のTatあるいはオリゴアルギニンを用いた導入法に関して解説する。
表1 代表的な膜透過性ペプチドベクター
4.細胞内導入への応用例
Tatあるいはオリゴアルギニンをベクターとして、培養細胞へ生理活性タンパク質を導入することにより、たとえば、p53タンパク質などの送達によるガン抑制2)や、Bcl-2ファミリーのタンパク質、Bcl-xLの送達による虚血性脳損傷における神経細胞死の軽減3)など様々な細胞機能が調節・制御できたことが報告されている1)。また、タンパク質以外にも、小分子薬物やリポソーム、微小磁石、ファージといった種々の物質が細胞内に導入されたことが報告されている (図1)。ペプチドベクターを用いて細胞機能を制御したことを報告する論文数は、過去5年で100報を超えており、その増加には目を瞠るものがあり、新しい細胞導入法の一つとして認知されてきているといえる。
導入の際には導入物質とペプチドベクターが化学的に結合していることが重要で、単にベクターと混合するだけでは効率的な導入が見られない場合が多い。また、遺伝子 (プラスミド) の細胞導入には、Tatやオリゴアルギニンを用いても目覚しい効率の上昇は見られないことが多い。この理由として、プラスミドの分子量が数百万と非常に大きくなること、負電荷を帯びたプラスミドと正電荷を帯びたペプチドベクターの相互作用により、不溶性の凝集体を生じてしまったり、細胞内移行に重要な働きを示すベクターのグアニジノ基と細胞表層の相互作用が損なわれたりするためであると考えられている。この問題点を解決する試みのひとつとして、遺伝子を内包するリポソームの表面をアルギニン修飾するアプローチが最近紹介された4)。
5.アルギニンペプチドの細胞内移行機序
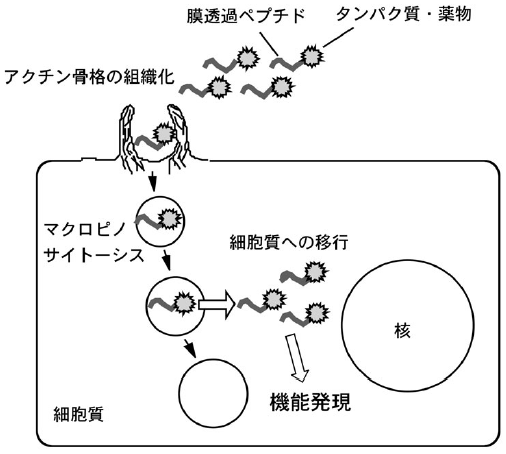
では、どのような機序で、このような効率的細胞内移送が可能になるのだろうか? Tatペプチドの細胞内移行に関して、当初、エンドサイトーシス (細胞の飲食作用) を介さない未知の経路によりペプチドベクターが細胞内に移行し、核へ局在化することが報告されていた。初期の段階では、細胞の顕微鏡観察の際に、パラホルムアルデヒドなどを用いて細胞を固定し観察する手法が一般的に行われていた。その後、この固定処理によりベクターの細胞内局在が大きく変わることが指摘され、導入機序と細胞内局在の見直しがなされてきている5)。実際、ペプチドベクターと細胞をインキュベートし、細胞を固定することなく生きたままの状態で観察すると、エンドソーム様の細胞内粒子が主として観察され、核への局在はほとんど見られない。また、エンドサイトーシスが行われなくなる低温条件下では細胞内への取り込みは大きく減少することが分かってきた。これらの結果から、Tatなどのアルギニンペプチドベクターの細胞内移行には、エンドサイトーシスが関与していることが示唆された。これに関して、マクロピノサイトーシスと呼ばれる特殊なエンドサイトーシス (図2) が主な取り込み経路の一つとして働くことが最近になって指摘された6,7)。マクロピノサイトーシスは細胞膜周辺のアクチンフィラメントが重合することにより細胞外へ膜が突き出し、細胞外液を細胞内に取り込む機序である。細胞膜が細胞内に陥没する形でエンドソームが形成される一般的なエンドサイトーシスと様式を異にしており、また、後者のエンドソームの直径がたかだか100 nm程度であるのに対して、マクロピノサイトーシスの場合はしばしば1µmを越すエンドソーム (マクロピノソーム) が形成されるとされる。この大きさだと直径200 nmを越すTat修飾リポソームやファージが細胞内に取り込まれることを説明可能である。マクロピノサイトーシスを支持する結果として、アルギニンペプチドやTat-Creの融合タンパク質の細胞取り込みがアミロリドと呼ばれるマクロピノサイトーシス阻害剤で効果的に阻害されることや、アクチン重合を阻害するサイトカラシンDによって取り込みが抑制されることが示されている。さらには、ヘパラン硫酸などの細胞表層の硫酸化された糖鎖がTatやアルギニンペプチドの取り込みに重要な役割を果たすことも示唆されており、負電荷を帯びた硫酸化糖との静電的相互作用により、アルギニンなどの正電荷を帯びたペプチドが細胞表層に濃縮され、ついで細胞内に取り込まれることが示唆されている。実際、ヘパラン硫酸などを欠損する細胞へのアルギニンペプチドの取り込みは、これらを有する細胞への取り込みに比べて有意に少ない。
図2 アルギニンペプチドベクターの細胞内移行とマクロピノサイトーシス
Tatなどのアルギニンペプチドの細胞内移行を評価する際に注意しなくてはいけない点は、たとえ、上記のようにエンドサイトーシスでペプチドが細胞内に取り込まれたとしても、ペプチドがエンドソームを抜け出て細胞質に至ることなしには細胞内での機能を発揮できないことである。ところが、実際どのようにしてエンドソーム膜を通過し、ペプチドが細胞質に至るのかに関しては良くわかっていない。おそらく、エンドソーム膜をペプチドが不安定化して、細胞質へと漏出してゆくものと考えられるが詳細は不明である。
最近、膜透過におけるアルギニンのグアニジノ基とカルボキシル基、リン酸基、硫酸基との間に2個の水素結合を介して相互作用することが重要であることが示唆された8,9)。細胞への取り込みにおいて、アミノ基を有するリジンよりもグアニジノ基を有するアルギニンが本質的な役割を果たすという知見とこの結果は一致する。また、細胞内は細胞外と比べて通常-60mV程度の負の電位となっているが、この膜電位が取り込みに重要であることも同時に示唆された8)。
6.今後の展望
Tatやオリゴアルギニンペプチドをはじめとした膜透過ペプチドベクターを用いて様々な物質が細胞内に移送できることが示されてきた。導入の成功例が次々と報告されているが、ペプチドベクターを用いても上手くいかなかった例も恐らくかなりの数であることと思われる。ペプチドベクターの構造や、導入する物質の物性を含めた導入条件と、得られた結果を検討することにより、導入の最適化に関する知見が蓄積されるのではないかと思われる。また、導入機序に関しても、現在様々な説が提唱されており、混乱が見られている。細胞や導入条件、導入物の物性の多様性を考慮せず、ともすれば、膜透過ペプチドはあたかも単一の導入機序で細胞内に移行するように論じられることが、この理由のひとつと考えられる。結果的に効率よく導入されることでそのような理解が生じるものと考えられるが、たとえばTatなどの塩基性ペプチドと疎水性のMTSが全く同じ機序で細胞内に移行するとは考えにくく、また、細胞種や導入する物質の物性 (分子量、親水性の高さ、荷電状態)、あるいは投与量によって機序は少しずつ変わってくると考えるべきである7)。膜透過ペプチドを用いた細胞内導入法は、当初考えられていたオールマイティの系ではないかもしれない。しかし、従来にない新しい概念による細胞内物質移送の手段であることには違いなく、移送機序や応用面に関しての検討を進めることで、いっそう効率的な細胞移送系の合理的設計が可能になるのではないかと筆者は期待している。
文献
1) 最近の総説として、Adv. Drug Deliv. Rev., 特集号: Protein- and peptide-mediated transduction: mechanisms and implications for drug delivery, Adv. Drug Deliv. Rev., 57, 487-665 (2005); 二木史朗: 化学と生物, 43, 649 (2005)などを参照されたい。
2) Noguchi, H., Matsushita, M., Okitsu, T., Moriwaki, A., Tomizawa, K., Kang, S., Li, S. T., Kobayashi, N., Matsumoto, S., Tanaka, K., Tanaka, N., Matsui, H.: Nat. Med., 10, 305 (2004).
3) Asoh, S., Ohsawa, I., Mori, T., Katsura, K., Hiraide, T., Katayama, Y., Kimura, M., Ozaki, D., Yamagata, K., Ohta, S.: Proc. Natl. Acad. Sci. USA, 99, 17107 (2002).
4) Kogure, K., Moriguchi, R., Sasaki, K., Ueno, M., Futaki, S., Harashima, H.: J. Control. Release, 98, 317 (2004).
5) Richard, J. P., Melikov, K., Vives, E., Ramos, C., Verbeure, B., Gait, M. J., Chernomordik, L. V., Lebleu, B.: J. Biol. Chem., 278, 585 (2003).
6) Wadia, J. S., Stan, R. V., Dowdy, S. F.: Nat. Med., 10, 310 (2004).
7) Nakase, I., Niwa, M., Takeuchi, T., Sonomura, K., Kawabata, N., Koike, Y., Takehashi, M., Tanaka, S., Ueda, K., Simpson, J. C., Jones, A. T., Sugiura, Y., Futaki, S.: Mol. Ther., 10, 1011 (2004).
8) Rothbard, J. B., Jessop, T. C., Lewis, R. S., Murray, B. A., Wender, P. A.: J. Am. Chem. Soc., 126, 9506 (2004).
9) Perret, F., Nishihara, M., Takeuchi, T., Futaki, S., Lazar, A. N., Coleman, A. W., Sakai, N., Matile, S.: J. Am. Chem. Soc., 127, 1114 (2005).