【トピックス】
組換え医療用糖タンパク質の生産に向けた宿主細胞の育種
藤山和仁
阪大・生物工学国際交流センター
1.はじめに
医療用タンパク質の組換え生産は、大腸菌、酵母、動物細胞で行われてきた。最近種々のシステムが開発され、昆虫細胞、カイコ、トランスジェニック動植物でも可能となった。医療用タンパク質の多くは、糖鎖修飾など翻訳後修飾を受けていることが多い。翻訳後修飾として、リン酸化、水酸化、アセチル化、糖鎖付加、脂質付加などが知られている。糖鎖部分が生物学的活性発現に重要な糖タンパク質があり、このような糖タンパク質を生産するためには、大腸菌は糖鎖修飾ができないため適さない。その他の真核細胞生産システムは、糖鎖修飾機能を持つ。しかし、その他の翻訳後修飾能力は宿主によりさまざまである。
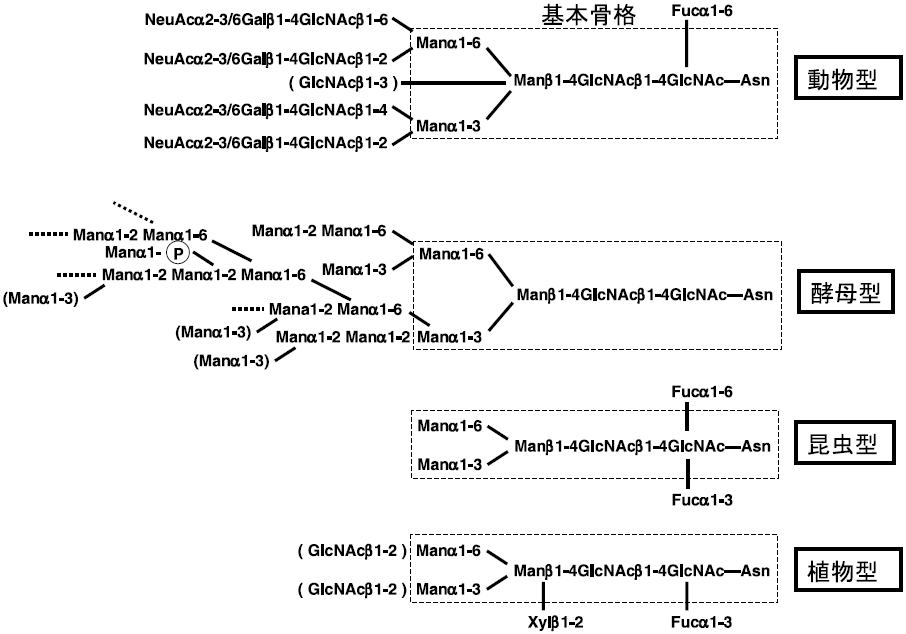
糖タンパク質の糖鎖部分は、タンパク質の生物学的活性を担い、各抗原特異性、血中でのクリアランス、レクチン (様タンパク質) との結合などに関与している。この糖鎖修飾システムは、宿主細胞自身の生物種、あるいはその由来する細胞種によって異なるため (図1)、組換えヒト由来医療用糖タンパク質の糖鎖構造はヒトと必ずしも同一ではない。このため、期待した生物学的機能を発揮できない問題が生じることがある1)。糖タンパク質糖鎖は、糖が結合するアミノ酸残基により大きく2つに分類されている。アスパラギンに結合しているN-結合型糖鎖、とセリン・スレオニンに結合しているO-結合型糖鎖である。ここでは、特にN-結合型糖鎖に焦点を絞りたい。
2.N-結合型糖鎖の生合成
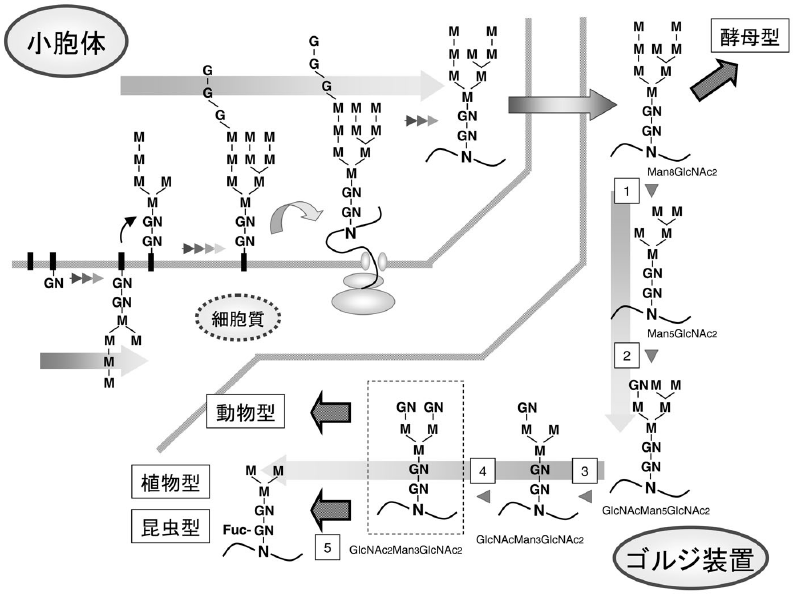
N-結合型糖鎖の生合成は、まず小胞体 (ER) 膜上で、ドリコールリン酸に結合した型で前駆体Glc3Man9GlcNAc2が合成されることから始まる (図1)。ドリコールリン酸上のGlc3Man9GlcNAc2は、翻訳が行われているペプチドのAsn-XSer/Thr のアスパラギン残基に糖鎖転移酵素により移される。糖鎖が付加したタンパク質は、ER内のglucosidase、mannosidaseによる分解を受けてMan8GlcNAc2となり、ERから出て、次のオルガネラであるゴルジ装置に輸送される。このステップまでは、酵母、昆虫細胞、動植物細胞で全く同じである。酵母は、ERから先の糖鎖付加機構が、他の細胞種と異なり、hypermannosy lationと呼ばれるマンノースが非常に多く付加した糖鎖構造へと進む。酵母以外の細胞では、Man8GlcNAc2となった糖鎖はMannosidase-Iにより分解を受けてMan5GlcNAc2型構造となり、N-acetylglucosaminyltransferase-I、mannosidase-II、N-acetylglucosaminyltransferase-IIと逐次的に付加と分解を受けて、GlcNAc2Man3GlcNAc2型構造となる。これ以降、昆虫細胞、動物細胞、植物細胞でプロセスが大きく異なる (図1, 2)。
![]()
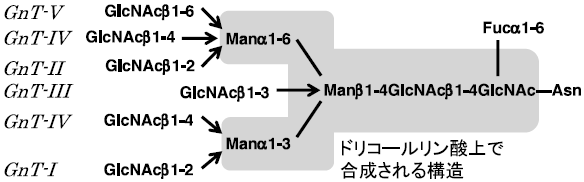
ヒトを含む哺乳動物やニワトリでは、β1,4-galactosyltransferaseやsialyltransferaseによりさらに糖鎖付加が起こり、NeuAc0-2Gal0-2GlcNAc2Man3GlcNAc2型構造となる。またN-acetylglucosaminyltransferase-IIIによりGlcNAc3Man3GlcNAc2型構造と、非還元末端側が3分岐型なる場合もある。さらに、N-acetylglucosaminyltransferase-IV、-V、-VIなどの酵素が作用すると、GlcNAc3-5Man3GlcNAc2型構造と、非還元末端側が3-5分岐型となる (図3)。また、α1,6-fucosyltransferaseがコア部分のN-アセチルグルコサミン残基にα1,6-結合でフコース残基を付加する。その結果、NeuAc0-2Gal0-2GlcNAc2Man3GlcNAc(α1,6-Fuc)GlcNAc型構造やGlcNAc3Man3GlcNAc(α1,6-Fuc)GlcNAc型構造となる。糖タンパク質によっては、非還元末端の方向にさらに糖が付加し、伸長していく場合もある。
図3 動物における糖鎖修飾酵素
植物細胞や昆虫細胞の場合、動物とは付加様式が異なるα1,3-fucosyltransferaseが存在する。この酵素は、GlcNAc2Man3GlcNAc2型構造のコア部分のN-アセチルグルコサミン残基に作用し、GlcNAc2Man3GlcNAc(α1,3-Fuc)GlcNAc型構造へと変換する。昆虫細胞の場合、α1,6-fucosyltrans feraseも存在するので、GlcNAc2Man3GlcNAc(α1,3-Fuc) (α1,6-Fuc)GlcNAc型構造も見出される。植物細胞はα1,6-fucosyltransferaseを持たないが、β1,2-xylosyltransferaseを有する。β1,2-xylosyltransferaseは、β1,4-結合しているマンノース残基にキシロース残基をβ1,2-結合で付加する。その結果、GlcNAc2 (β1,2-Xyl)Man3GlcNAc(α1,3-Fuc)GlcNAc型構造となる。植物細胞や昆虫細胞には、非還元末端N-アセチルグルコサミン残基を分解するN-acetylglucosaminidase活性が認められている (図1)2,3)。この酵素作用を受けると、(β1,2-Xyl)Man3GlcNAc(α1,3-Fuc)GlcNAc型構造やMan3GlcNAc(α1,3-Fuc)GlcNAc型構造となる。現在、動物型糖鎖には見られない植物や昆虫細胞特有な糖鎖α1,3-フコース残基やβ1,2-キシロース残基については、アレルゲンあるいは抗原としての可能性が指摘されている4-6)。
3.宿主細胞の育種
このように、宿主細胞によりそれぞれ糖鎖付加能力にバリエーションがある。そこで、各宿主に応じて、ヒト適応型の糖鎖構造を持った組換え糖タンパク質生産のために、さまざま技術が開発されている。
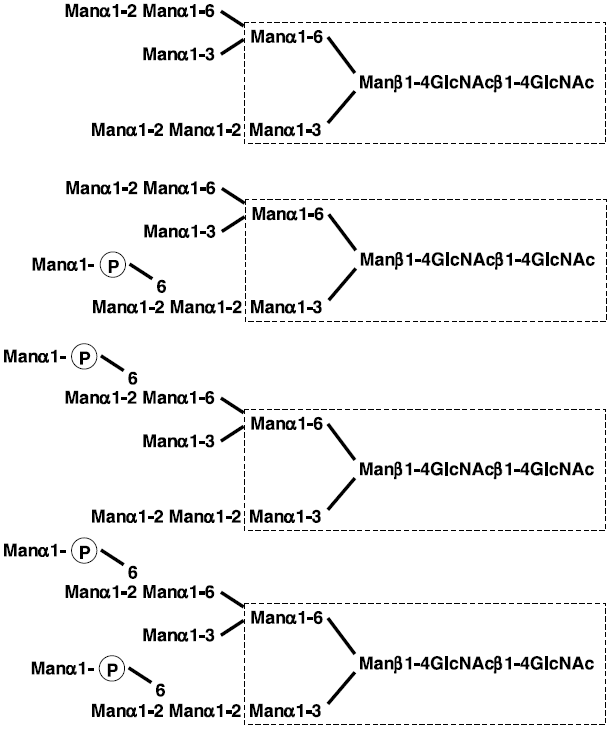
出芽酵母Saccharomyces cerevisiaeは、hypermannosylation化した糖鎖となるので、このプロセスに関わる遺伝子 (OCH1, MNN1) をノックアウトした変異体を作成することが必要である。産総研の地神らのグループは、och1 mnn1をベースに、哺乳類由来糖鎖修飾遺伝子を導入し、ヒト適応型糖鎖付加機能を持った酵母宿主を開発した7)。また、och1 mnn1酵母を用いてファブリー病の治療薬となる組換えα-galactosidase Aを生産した。この酵素の場合、糖鎖にマンノース-6-リン酸残基 (Man-P-) を有することが重要である。出芽酵母S. cerevisiae はマンノース-6-リン酸残基を付加する能力を持つので、組換え酵素にうまくマンノース-6-リン酸残基を付加できた (図4)8)。

米国のベンチャーGlycoFiは、メチロトローフ酵母Pichia pastorisを育種し、ガラクトースを付加することが出来る組換えタンパク質生産宿主細胞を産み出した。最近、この細胞を使って、ガラクトース残基を持ったヒト型糖鎖を持った抗体タンパク質を生産できたことを報告している9)。
昆虫細胞では、米国のJarvisやBetenbaughらのグループが、ヒトとほぼ同じ糖鎖付加機能を持った宿主開発を精力的に行った10-13)。この宿主MimicTM Sf9は、昆虫細胞での組換えタンパク質生産に汎用されているSpodoptera frugiperda由来Sf9細胞をベースに、哺乳類の糖鎖修飾関連遺伝子を導入したもの14)で、現在市販されている。導入された遺伝子は5つで、N-acetylglucosaminyltransferase-I, N-acetylglucosaminyltransferase-II、β1,4-galactosyltransferaseや2種のsialyltransferaseである (図1酵素2から4)。ウマ由来黄体形成ホルモン/絨毛性ゴナドトロピンを生産させると、N-アセチルノイラミン酸 (NeuAc、シアル酸) は付加されていなかった15)。Sf9細胞はシアル酸合成能を持たないためCMP-NeuAcを合成できず、導入した2種のsialyltransferaseの基質が存在しないためであった (後述)。
動物、カイコでは糖鎖付加機能を改変する、あるいは制御することは、致死性につながる16)ので難しいと思われる。しかし、以下に述べるが、植物体では、糖鎖付加機能を操作することは基本的な生育には影響を与えないようである。
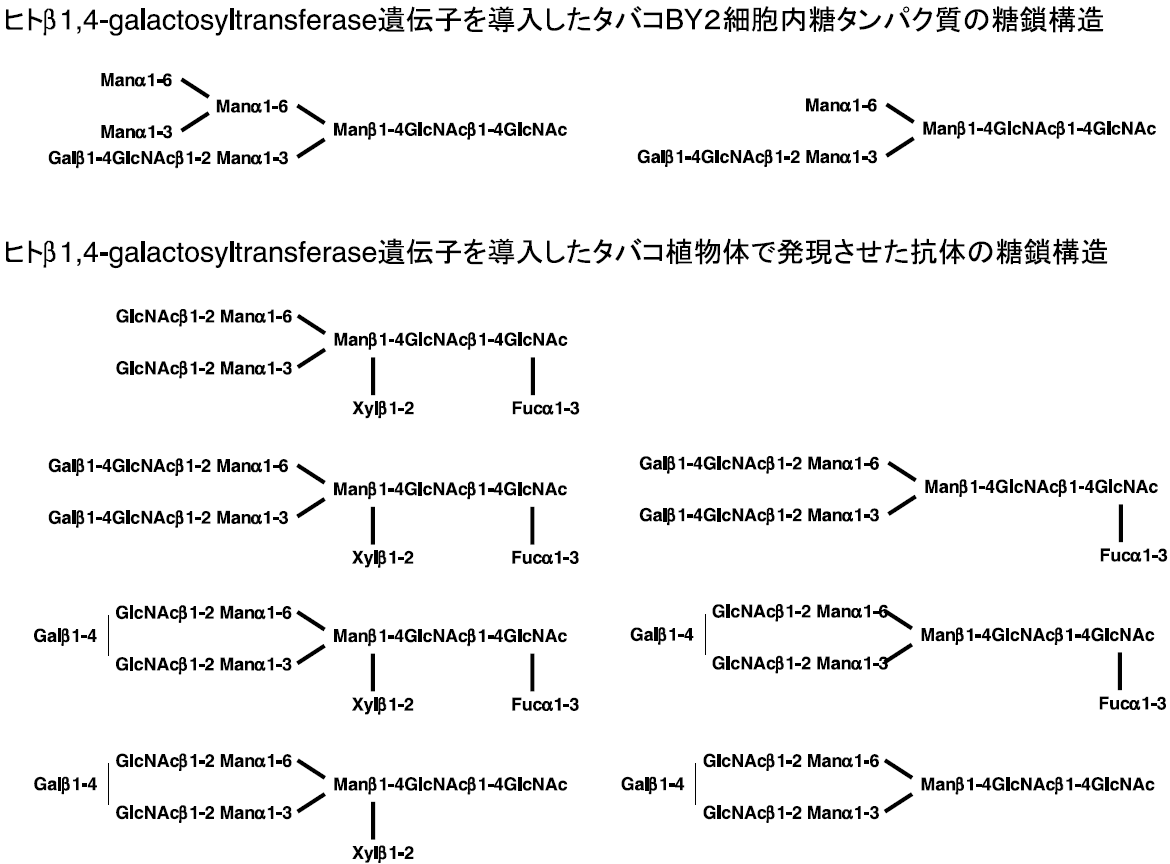
一方、植物のN-結合型糖鎖においても、糖鎖付加機能のヒト型化が試みられている。植物糖鎖の非還元末端には、N-アセチルグルコサミン残基が存在するものの、β1,4-結合したガラクトース残基が存在しない (微量ながらβ1,3-結合したガラクトース残基が存在する)17)。そこで、動物由来のβ1,4-galactosyltransferase遺伝子を導入すると、β1,4-結合したガラクトース残基を持つ糖タンパク質を合成できると期待できる。我々のグループはヒト由来β1,4-galactosyltransferase遺伝子をタバコBY2培養細胞に導入し、糖鎖構造を改変することに成功した (図5)18)。ガラクトース残基が付加した糖鎖が47%に達した。また、興味深いことに、植物特有であるであるキシロース残基やフコース残基が付加した糖鎖の含量が劇的に減少した。β1,4-galactosyltransferase遺伝子を導入することで、細胞内糖鎖付加機構に影響を与えたことになる。オランダのWageningenのグループ19)は、タバコ植物体でβ1,4-galactosyltransferase遺伝子を発現させ、さらに抗体遺伝子を導入して生産させた (図5)。この抗体の糖鎖には、ガラクトース残基が付加していたが、キシロース残基やフコース残基もが付加しており、植物培養細胞とは異なった。
![]()
植物体の糖鎖付加機能改変は、その生長に大きな影響を与えないようである。例えば、Nacetylglucosaminytransferase-I (図1 酵素2) 遺伝子変異体が取得されている20)が、通常の表現型を示している。しかし、哺乳動物におけるこの遺伝子変異は、胎児の段階で支障をきたす16)。また、α1,3-fucosyltransferaseおよびβ1,2-xylosyltransferase遺伝子が変異したArabidopsisthalianaは通常の生長を示し、キシロースやフコース残基のないヒト型糖鎖構造を合成できた21)。このように、植物では、糖鎖付加経路のNacetylglucosaminyltransferase-I付加ステップ以降は生長に大きな影響はないものと思われる。
4.シアル酸の付加
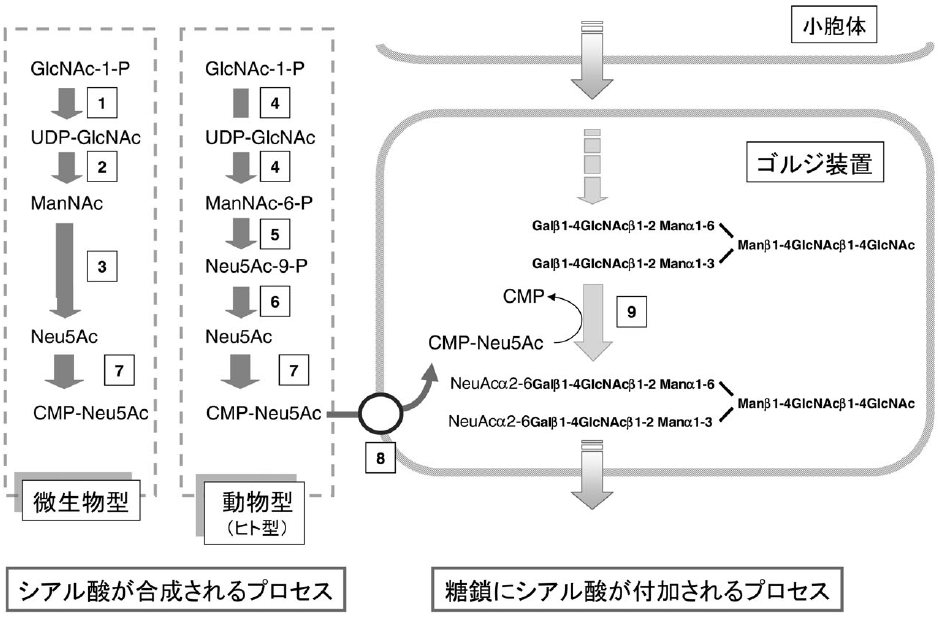
動物では、糖鎖の非還元末端にシアル酸残基が付加している。このシアル酸残基は、エリスロポイエチンなどの例に見られるようにタンパク質の血中安定、生物学的活性発現などに大きく関わる22)。シアル酸合成は大腸菌でも見られるが、動物と微生物におけるシアル鎖合成システムは少し異なる (図6)23)。NeuAcより合成されたCMP-NeuAcは、CMP-NeuAc transporterによりゴルジ装置内に取り込まれ、sialyltransferaseの基質となる。しかし、酵母、昆虫細胞、植物にはシアル酸付加機能がないと考えられている。この理由は、シアル酸合成機能存在しないからである。しかし、昆虫細胞の場合、培地にシアル酸の前駆体があれば、シアル酸を付加することができるという報告がある24)。また、非常に微量ながら本質的にシアル酸が存在するということも示されている25)。植物の場合、これまでシアル酸は存在しないと言われてきたが、2003年シアル酸 (或いはその構造類似体) が存在することを示唆する報告がなされた26)。反対論文27,28)もあり、現在議論されているところである。いずれにしても、昆虫細胞、植物では糖タンパク質に十分なシアル酸残基を付加できる能力はない。そこで、試験管内で生産した糖タンパク質に対して (組換え) ialyltransferaseを用いてシアル酸残基を付加する29)か、あるいはこれら宿主細胞にシアル酸合成機能・付加機能を創設することが望まれる。シアル酸合成・付加プロセスの創設については、いくつかのチャレンジがなされている。我々はタバコBY2細胞を用いて、ヒト由来のCMP-NeuAcsynthetase (図5 酵素7、以下同じ) とCMPNeuActransporter (酵素8) 遺伝子をそれぞれ導入し、機能発現させることに成功している30)。昆虫細胞では、UDP-GlcNAc-2-epimerase/ManAckinase (酵素4)、sialic aicd 9-phosphatesynthase (酵素5)、CMP-NeuAc synthetase (酵素7) 遺伝子を共発現させることで、CMPNeuAcを合成させることに成功した10)。

5.おわりに
以上のように、組換え医療用タンパク質生産に向けていろいろな宿主細胞の育種改良が行われている。現在、糖鎖構造の点から見ると、かなり動物細胞システムに近づいてきたと言える。しかし、糖鎖構造は複雑である。哺乳類由来培養細胞を用いても、糖タンパク質の糖鎖構造は多様である。また、糖タンパク質によっても、生物学的機能発現に必要な糖鎖構造は異なる。それぞれの糖タンパク質に応じて、生産システム (宿主細胞) が選択されるものと考える。
最後に、植物細胞は、コストのかからない無機塩類主体の培地で、閉鎖系培養槽内で増殖させるため種々の条件を管理でき、ヒトに害のあるウィルスなどの混入の心配がない安全なシステムである。分泌生産が可能であるために分泌させた場合、分離が容易で精製コストも安価であるなどの利点を持つ。我々は、今後植物細胞を医療用組換え糖タンパク質生産宿主として扱い、ヒトに優しい糖鎖構造を持った糖タンパク質の効率的な生産系開発を目指したいと考えている。
謝辞
本稿で紹介した、組換え医療用糖タンパク質の生産に向けた植物細胞の育種に関する部分は、大阪大学生物工学国際交流センター吉田敏臣教授 (現在名誉教授) および関達治教授のもとで行われたものであります。また、岡山大学木村吉伸教授、創価大学 (現総研糖鎖工学研究センター) 成松久教授、片倉工業株式会社のご支援と協力を戴きました。最後に、本稿の執筆の機会を与えてくださいました横浜国立大学の武田穣先生に感謝いたします。
文献
1) Matsumoto, S., Ikura, K., Ueda, M., Sasaki, R.: Plant Mol. Biol., 27, 1163 (1995).
2) Altmann, F., Schwihla, H., Staudacher, E., Glossl, J., Marz, L.: J. Biol. Chem., 270, 17344 (1995).
3) Misaki, R., Nagaya, H., Fujiyama, K., Yanagihara, I., Honda, T., Seki, T.: Biochem. Biophys. Res. Commun., 311, 979 (2003).
4) Jin, C., Bencurova, M., Borth, N., Ferko, B., Jensen-Jarolim, E., Altmann, F., Hantusch, B.: Glycobiology, in press (2006).
5) Bencurova, M., Hemmer, W., Focke-Tejkl, M., Wilson, I. B., Altmann, F.: Glycobiology, 14, 457 (2004).
6) Foetisch, K., Westphal, S., Lauer, I., Retzek, M., Altmann, F., Kolarich, D., Scheurer, S., Vieths, S.: J. Allergy Clin. Immunol., 111, 889 (2003).
7) Chiba, Y., Suzuki, M., Yoshida, S., Yoshida, A., Ikenaga, H., Takeuchi, M., Jigami, Y., Ichishima, E.: J. Biol. Chem., 273, 26298 (1998).
8) Chiba, Y., Sakuraba, H., Kotani, M., Kase, R., Kobayashi, K., Takeuchi, M., Ogasawara, S., Maruyama, Y., Nakajima, T., Takaoka, Y., Jigami, Y.: Glycobiology, 12, 821 (2002).
9) Li, H., Sethuraman, N., Stadheim, T. A., Zha, D., Prinz, B., Ballew, N., Bobrowicz, P., Choi, B. K., Cook, W. J., Cukan, M., Houston-Cummings, N. R., Davidson, R., Gong, B., Hamilton, S. R., Hoopes, J. P., Jiang, Y., Kim, N., Mansfield, R., Nett, J. H., Rios, S., Strawbridge, R., Wildt, S., Gerngross, T. U.: Nat. Biotechnol., 24, 210 (2006).
10) Viswanathan, K., Narang, S., Hinderlich, S., Lee, Y. C., Betenbaugh, M. J.: Biochemistry, 44, 7526 (2005).
11) Tomiya, N., Narang, S., Lee, Y. C., Betenbaugh, M. J.: Glycoconj. J., 21, 343 (2004).
12) Viswanathan, K., Lawrence, S., Hinderlich, S., Yarema, K. J., Lee, Y. C., Betenbaugh, M. J.: Biochemistry, 42, 15215 (2003).
13) Tomiya, N., Howe, D., Aumiller, J. J., Pathak, M., Park, J., Palter, K. B., Jarvis, D. L., Betenbaugh, M. J., Lee, Y. C.: Glycobiology, 13, 23 (2003).
14) Hollister, J., Grabenhorst, E., Nimtz, M., Conradt, H., Jarvis, D. L.: Biochemistry, 41, 15093 (2002).
15) Legardinier, S., Klett, D., Poirier, J. C., Combarnous, Y., Cahoreau, C.: Glycobiology, 15, 776 (2005).
16) Ioffe, E., Stanley, P.: Proc. Natl. Acad. Sci. USA, 91, 728 (1994).
17) Melo, N. S., Nimtz, M., Conradt, H. S., Fevereiro, P. S., Costa. J.: FEBS Lett., 415, 186 (1997).
18) Palacpac, N. Q., Yoshida, S., Sakai, H., Kimura, Y., Fujiyama, K., Yoshida, T., Seki, T.: Proc. Natl. Acad. Sci. USA, 96, 4692 (1999).
19) Bakker, H., Bardor, M., Molthoff, J. W., Gomord, V., Elbers, I., Stevens, L. H., Jordi, W., Lommen, A., Faye, L., Lerouge, P., Bosch, D.: Proc. Natl. Acad. Sci. USA, 98, 2899 (2001).
20) von Schaewen, A., Sturm, A., O'Neill, J., Chrispeels, M. J.: Plant Physiol., 102, 1109 (1993).
21) Strasser, R., Altmann, F., Mach, L., Glossl, J., Steinkellner, H.: FEBS Lett., 561, 132 (2004).
22) Takeuchi, M., Kobata, A.: Glycobiology, 1, 337 (1991).
23) Munster-Kuhnel, A. K., Tiralongo, J., Krapp, S., Weinhold, B., Ritz-Sedlacek, V., Jacob, U., Gerardy-Schahn, R.: Glycobiology, 14, 43R (2004).
24) Hollister, J., Conradt, H., Jarvis, D. L.: Glycobiology, 13, 487 (2003).
25) Roth, J., Kempf, A., Reuter, G., Schauer, R., Gehring, W. J.: Science, 256, 673 (1992).
26) Shah, M. M., Fujiyama, K., Flynn, C. R., Joshi, L.: Nat. Biotechnol., 21, 1470 (2003).
27) Seveno, M., Bardor, M., Paccalet, T., Gomord, V., Lerouge, P., Faye, L.: Nat. Biotechnol., 22, 1351 (2004).
28) Zeleny, R., Kolarich, D., Strasser, R., Altmann, F.: Planta, in press (2006).
29) Misaki, R., Kimura, Y., Palacpac, N. Q., Yoshida, S., Fujiyama, K., Seki, T.: Glycobiology, 13, 199 (2003).
30) Misaki, R., Fujiyama, K., Seki, T.: Biochem. Biophys. Res. Commun., 339, 1184 (2006).