【トピックス】
新しいビルトイン型キノン補酵素CTQと分子内チオエーテル架橋構造
― その特異な構造形成機構の解明に向けて―
谷澤克行
阪大・産業科学研
1.はじめに
生体内での多彩な代謝反応を司る酵素は、いうまでもなくタンパク質でできた生体触媒である。しかし、単純タンパク質の酵素は意外と少なく、国際酵素委員会に登録されている約3500種類の酵素の多くは、さまざまな金属イオンや水溶性ビタミンから生合成される補酵素などの有機低分子化合物を含んでいて、それらの存在なしには多様な触媒機能を発揮できない。生物進化の過程で生じたさまざまな代謝反応を触媒するため、20種類のアミノ酸残基には乏しい反応性 (求電子的性質など) を酵素に付与する必要性が補酵素を生んだと考えることもできる。ニコチンアミド補酵素やピリドキサルリン酸など補酵素の多くは、酵素タンパク質とは別の経路で生合成される。動物では補酵素の生合成にそれぞれの前駆体を微量必須栄養素 (ビタミン) として摂取しなければならない。そのようにして生合成された補酵素は不活性なアポ酵素に最終的に組み込まれ、活性型のホロ酵素を形成する。一方、銅含有アミン酸化酵素をはじめとする種々の酵素タンパク質中に、アミノ酸残基のかたちで共有結合している特殊な補酵素が最近の十数年間に相次いで見出されてきた1-3)。求電子的性質を有する官能基として、カルボニル基を含むものだけでも、古くから知られるピルビン酸残基以外に、ホルミルグリシン、トパキノン (TPQ)、リジルチロシルキノン (LTQ)、トリプトファントリプトフィルキノン (TTQ) など様々なものが報告されている。このような補酵素は‘ビルトイン型補酵素’と呼ばれ1-3)、タンパク質の翻訳過程または翻訳終了後に、前駆体となるアミノ酸残基が特異的な修飾反応を受けて生成する。しかし、その生成機構が分子レベルで解明されているものは多くない。本稿では、私どもが見出した新規なビルトイン型キノン補酵素、システイントリプトフィルキノン (CTQ) とヘムとを併せもつキノヘムプロテイン・アミン脱水素酵素 (QHNDH) の特異な構造について述べるとともに、CTQとそれを囲むユニークな分子内チオエーテル架橋構造の形成機構の解明に向けて私どもが得た最近の研究成果を紹介する。
2.QHNDHの立体構造と新規ビルトイン型キノン補酵素CTQ
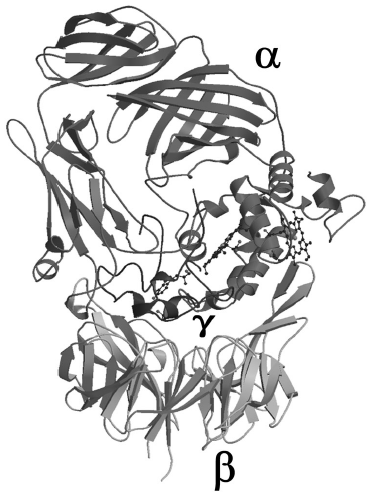
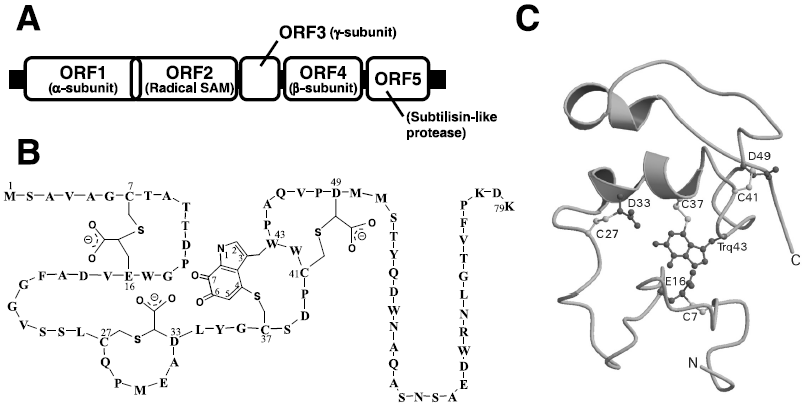
酵素タンパク質中に新規な補酵素が見つかることは、それほどたびたびあることではなく、ビルトイン型補酵素に限っても、1996年に構造決定されたLTQ以来見つかっていなかった。しかし2001年になって、私どもはQHNDHに新しいビルトイン型キノン補酵素CTQを見いだした。補欠分子としてキノンとヘムを併せもつ酵素のQHNDH自身は、2種類のグラム陰性細菌、Paracoccus denitrificans とPseudomonas putidaとから別々に単離されそれらの酵素学的性質が調べられたが、後に遺伝子構造と立体構造が決定されると4-6)、両者は驚くほど似ていた。QHNDHは3つの異なるサブユニット (α, βおよびγ) で構成されており、一級アミン類を脱水素してアルデヒドに酸化する反応を触媒する。両細菌の培地中にn-ブチルアミンやベンジルアミンを加えると、これらをエネルギー源として資化するため、本酵素が細胞膜内のペリプラズム画分に誘導生成される。触媒反応においては、基質アミンに由来する2電子はキノン補酵素、ヘムcを経由して7)、アズリンやチトクロムc550などの電子受容体タンパク質に受け渡され、最終的には末端酸化酵素により分子状酸素の水への還元に使われる。α-サブユニットには2分子のヘムcが結合しており、γ-サブユニットには未知のキノン補酵素が含まれていることが分かっていた。しかし、このキノン補酵素の同定はもとより、γ-サブユニット全体のアミノ酸配列すらもタンパク質化学的に決定することは非常に困難であった。キノン補酵素とそれを含むγ-サブユニットの化学構造に関する疑問は、P. denitrificansとPs. putidaのQHNDHの立体構造が相次いで決定されることによって氷解した。X線結晶解析の結果、両細菌酵素の一次構造の相同性はそれほど高くないが、立体構造 (図1) は非常に類似していることが判明した。すなわち、約60 kDa のα-サブユニットは、互いに独立したフォールディングをもつ4個のドメイン (I~IV) で構成され、おもにα-ヘリックスからなるドメインIはドメイン内に擬2回対称軸をもち、2分子のヘムcはシステイン残基とチオエーテル結合でそれぞれドメインIに共有結合していた。約40 kDaのβ-サブユニットは、メチルアミンデヒドロゲナーゼやメタノールデヒドロゲナーゼなど他の多くのキノプロテイン・デヒドロゲナーゼで見られる7枚羽根のβ-プロペラ構造をもっていた。最も小さなγ-サブユニット (約9 kDa) は、α, β両サブユニット間に挟まれるように分子内に埋もれて存在していた。γ-サブユニット遺伝子の塩基配列から予測されるアミノ酸配列 (79及び82残基) 中では4個のシステイン残基と5個のトリプトファン残基を含むが、遊離のSH基やS-S結合はまったく検出されなかった。慎重な分子モデリングの結果、キノン補酵素は、Trp残基のC6位とC7位とがオルトキノン型に酸化されていると同時に、C4位に同一ポリペプチド内のCys残基の側鎖SH基がチオエーテル結合で架橋したシステイントリプトフィルキノン (CTQ) であることが分かった (図2B, C)。さらに、驚くべきことに、残りの3個のCys残基がその側鎖SH基で、Asp残基またはGlu残基のメチレン炭素にチオエーテル結合していることが判明した (図2B, C)。ガラクトースオキシダーゼでは、Tyr残基のフェノール環炭素にCys残基がチオエーテル結合しているが、酸性残基のメチレン炭素との間のチオエーテル結合はタンパク質中ではこれまでに見いだされていない。このようなチオエーテル結合は一般的なS-S還元剤では切断されない安定な結合であるので、SH基の定量ができないのは当然であった。また、質量分析の結果もこれらの架橋構造を考慮することで完全に解釈することができた。γ-サブユニットはこれら4ヶ所の分子内架橋によって、折れ曲がりの多い立体構造を維持していると考えられた。
図1 QHNDHの立体構造
![]()
3.CTQと分子内チオエーテル架橋構造の形成機構の解明に向けて
QHNDHのγ-サブユニットに見出された分子内チオエーテル架橋構造は、明確な二次構造含量が少ないγ-サブユニットの構造維持に必要であると考えられるが、酵素機能における役割や翻訳後修飾による生成機構は未解明に残されている。一方、QHNDH遺伝子はゲノム上でオペロンを形成している (図2A) と考えられ、その第2番目のORF (ORF2) は、本酵素のどのサブユニットとも対応していない約55 kDa の未知タンパク質をコードしている。タンパク質データベースとの配列比較に基づくと、このタンパク質は、ビタミン類の生合成に関わる酵素や種々の酵素活性化因子を含むラジカルSAMスーパーファミリーに属すると考えられるが、QHNDHとの関係は未解明に残されていた。私どもは、最近P. denitrificans のORF2タンパク質に着目し、QHNDHの生合成過程、特にγ-サブユニット内のCTQ生成やチオエーテル架橋構造の形成に果たす役割を解明することを目的として研究を進めた8)。
先ず、ORF2タンパク質の機能について解析するため、suicide vectorを用いた相同組換えによってP. denitrificansのORF2遺伝子内にカナマイシン耐性遺伝子を導入した。さらに、同様の操作により、カナマイシン耐性遺伝子を除去し、ORF2遺伝子破壊株 (ΔORF2株) を得た。n-ブチルアミンを唯一のC/N源として含有する最小培地において、野生株とΔORF2株の増殖能とQHNDH活性を比較した結果、ΔORF2株はQHNDH活性を欠失しており、この培地中に増殖することができなかった。培地中に炭素源としてコリンを追加したところ、菌体の増殖は回復したがQHNDH活性は誘導されなかった。野生株とΔORF2株においてウェスタンブロットによりORF2タンパク質の発現を比較した結果、野生株において細胞質画分に発現していたORF2は、ΔORF2株において、全く発現していないことが確認できた。また、ORF2タンパク質は最小培地にn-ブチルアミンを添加したQHNDH誘導条件下にその発現が検出されたことから、QHNDH遺伝子と同一のプロモーターに支配されていることがわかった。ΔORF2株の最小培地における増殖能とQHNDH活性は、広宿主域ベクターを用いて構築したORF2タンパク質発現プラスミドをΔORF2株に導入することによって回復させることができた。しかし、鉄硫黄クラスターおよびS-アデノシルメチオニン (SAM) 結合と推定される配列に変異を導入したORF2遺伝子を持つ発現プラスミドでは、ΔORF2株の同培地での増殖能力を回復しなかった。以上の結果から、ORF2タンパク質がラジカルSAMタンパク質としてQHNDH生合成に必須の役割を果たしていることが明らかとなった。QHNDHの各サブユニットの細胞内局在について調べたところ、α-およびβ-サブユニットは野生株と同様にΔORF2株においてもペリプラズム分画に存在していたが、γ-サブユニットは細胞質画分に蓄積していた。このγ-サブユニットはキノン染色に反応しなかったので、CTQ補酵素は形成されていないことがわかった。
次に、ΔORF2株の細胞質に蓄積したγ-サブユニットの翻訳後修飾の状態を解析するため、同サブユニット・ペプチドをHPLCにより精製し、その質量分析を行った。その結果、成熟型γ-サブユニットとは対象的に、ΔORF2株の細胞質内蓄積γ-サブユニットは、補酵素生成とチオエーテル結合形成のいずれの翻訳後修飾も受けていないことが明らかになった。さらに、成熟型γ-サブユニットにはない28残基のプレ配列がN末端に存在することが明らかになった。このプレ配列は、通常のペリプラズムへの輸送シグナルとは異なり、塩基性・酸性残基に富んでいた。また、γ-サブユニット遺伝子欠失株において、このプレ配列を除去したγ-サブユニットはペリプラズムに輸送されず、QHNDH活性も検出されなかった。このγ-サブユニットのプレ配列の役割は不明であるが、セリンプロテアーゼ様のアミノ酸配列をもつORF5タンパク質によって除去される可能性がある (未発表データ)。一方、CTQ補酵素の生成機構に関しては、類似のキノン補酵素であるメチルアミン脱水素酵素のTTQがヘムタンパク質によってペリプラズムにおいて形成される9)ことからCTQもペリプラズムにおいて合成されると推定され、細胞質に存在するORF2タンパク質はCTQ生成には直接関与していないと考えられる。
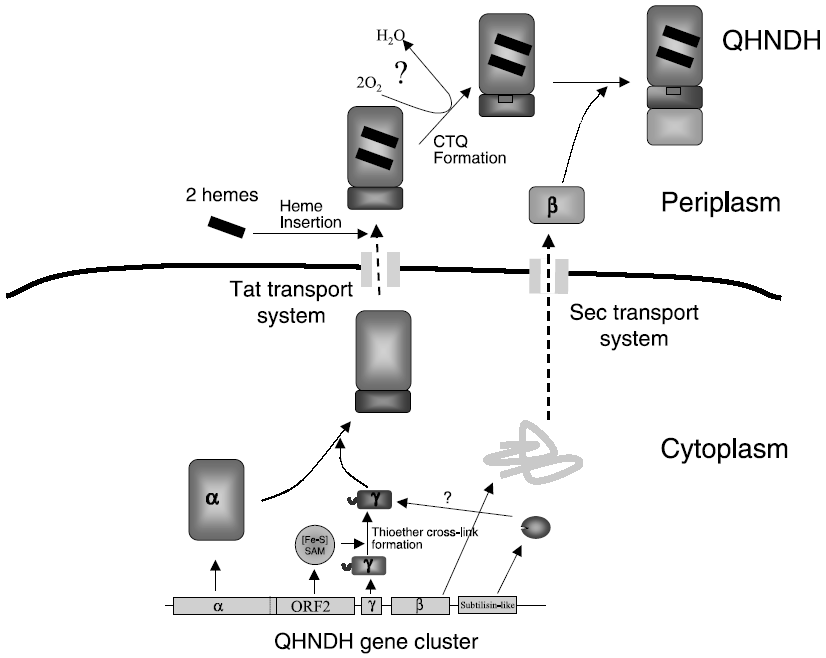
以上のように、γ-サブユニットは細胞質内でチオエーテル架橋構造が形成された後、恐らくα-サブユニットに結合してペリプラズムへと輸送されると考えている。一方、α-サブユニットとβ-サブユニットは異なるタイプのシグナルペプチドを有しており、それぞれ別々に細胞質からペリプラズムに移行すると考えられる。また、α-サブユニットに結合している2分子のヘムはペリプラズム内でα-サブユニットに挿入されると考えられ、ペリプラズム内でのCTQ生成を含め、酵素活性を示す成熟型QHNDHの全体構造形成は極めて複雑な機構で進行すると推定される (図3)。今後、γ-サブユニットの内部に仕掛けられたCTQとチオエーテル架橋構造という「からくり」がどのようにして作られるのか、QHNDH酵素タンパク質複合体の形成機構とあわせて、より詳細に解明してゆきたいと考えている。
図3 QHNDH構造形成機構の仮説
文献
1) 谷澤克行: 蛋白質核酸酵素, 44, 1947 (1999).
2) 岡島俊英、谷澤克行: 蛋白質核酸酵素, 48, 740 (2003).
3) 谷澤克行: ビタミン, 77, 275 (2003).
4) Vandenberghe, I., Kim, J. K., Devreese, B., Hacisalihoglu, A., Iwabuki, H., Okajima, T., Kuroda, S., Adachi, O., Jongejan, J. A., Duine, J. A., Tanizawa, K., Van Beeumen, J.: J. Biol. Chem., 276, 42923 (2001).
5) Datta, S., Mori, Y., Takagi, K., Kawaguchi, K., Chen, Z. W., Okajima, T., Kuroda, S., Ikeda, T., Kano, K., Tanizawa, K., Mathews, F. S.: Proc. Natl. Acad. Sci. USA, 98, 14268 (2001).
6) Satoh, A., Kim, J. K., Miyahara, I., Devreese, B., Vandenberghe, I., Hacisalihoglu, A., Okajima, T., Kuroda, S., Adachi, O., Duine, J. A., Van Beeumen, J., Tanizawa, K., Hirotsu, K.: J. Biol. Chem., 277, 2830 (2002).
7) Sun, D., Ono, K., Okajima, T., Tanizawa, K., Uchida, M., Yamamoto, Y., Mathews, F. S., Davidson, V. L.: Biochemistry, 42, 10896 (2003).
8) Ono, K., Okajima, T., Tani, M., Kuroda, S., Sun, D., Davidson, V. L., Tanizawa, K.: J. Biol. Chem., 281, 13672 (2006).
9) Pearson, A. R., De la Mora-Rey, T., Graichen, M. E., Wang, Y., Jones, L. H., Marimanikkupam, S., Agger, S. A., Grimsrud, P. A., Davidson, V. L., Wilmot, C. M.: Biochemistry, 43, 5494 (2004).