【トピックス】
分裂酵母異種タンパク質生産系の構築とその改良
東田英毅
旭硝子・ASPEX事業推進部
1.はじめに
医薬品原料や産業用酵素としてのタンパク質の利用は、さまざまな異種タンパク質生産系が使用可能になったこともあり、現在でもなお急速な広がりを見せつつある。生産系自体も、原核生物である大腸菌・枯草菌・コリネ型細菌・放線菌、真核微生物である酵母・糸状菌、高等真核細胞である動植物昆虫細胞や動植物昆虫体そのもの、さらには大腸菌や小麦胚芽の抽出物を用いた無細胞生産系など、数多くが開発されている。正確な統計がないので詳細は明らかではないが、使用頻度や生産物の販売額などから推定して、現時点では大腸菌や動物細胞を用いる場合が主流であると思われる。しかしながら多種多様なタンパク質に対応するためにはこれらの系では不十分な場合も多く、上記のような様々な生産系が試行され、その一部は実用化されている。
異種タンパク質生産の基本的な仕組みは、Itakuraらの先駆的な仕事から30年が経過した今も変わっておらず、宿主細胞の複製・転写・翻訳というセントラルドグマをそのまま利用する形で行われている。このため効率的な異種タンパク質生産を行うには、これらの各過程を最適化することが必要である。同時に細胞培養や抽出精製技術の改良も重要であり、また最近では宿主細胞自体の改良もさまざま試みられており、例えばミニマムゲノムファクトリーのような構想も提唱されている1)。
本稿では酵母の一種であるSchizosaccharomyces pombe を宿主細胞とし、それを用いた異種タンパク質生産系の構築と改良、ならびに今後の発展に向けた取組みについて述べる。
2.分裂酵母Schizosaccharomyces pombe
真核微生物である酵母は、一部の病原性のものを除いて、パン・酒類等の食品生産に長年使用されている安全性の高い微生物である。微生物としての取り扱いが可能で、実験操作や培養が簡便であると同時に、大腸菌や枯草菌などの原核生物と異なり、高等動植物細胞と類似する発達した細胞内構造や機能を合わせ持っている。中でも独自の進化を遂げてきた分裂酵母Schizosaccharomyces pombe (S. pombe) は他の酵母と異なる特徴を持ち (近年は糸状菌との類似性を示す研究も多い)、高等動物細胞と似た転写・翻訳機構を持つこと、高等動物の遺伝子機能をよく相補すること、複雑な翻訳後修飾が可能であることなどから、特にヒトに由来する異種タンパク質生産用宿主として注目された2-4)。S. pombeは東アフリカ・ジャワ・サイパンの地酒 (ビール) 製造や、ワインビネガー製造の際に使用されているという例もあるが、いわゆるパンや酒類等の食品工業ではあまり用いられて来なかった。その一方でSaccharomyces cerevisiae (S. cerevisiae) で代表される他属の酵母が出芽して増殖するのに対し、分裂して増殖するという特徴的な性質が注目され、分子遺伝学・細胞生物学研究が今日まで盛んに行われており、染色体の塩基配列決定も終了している5-7)。
3.分裂酵母発現系の構築8)
S. pombe では一部の高等動植物由来のプロモーターが機能する。特にヒトサイトメガロウイルス (hCMV) プロモーターは強い転写活性を持つ。またSV40プロモーターも、hCMVプロモーターの1/10の活性ではあるが、発現に十分な活性を持つことが報告されている9)。目的の異種タンパク質遺伝子は強力なプロモーターで制御されることが望ましく、逆に選択マーカーは弱いプロモーターで制御されることによって、ベクターのコピー数を増大させることが期待される。
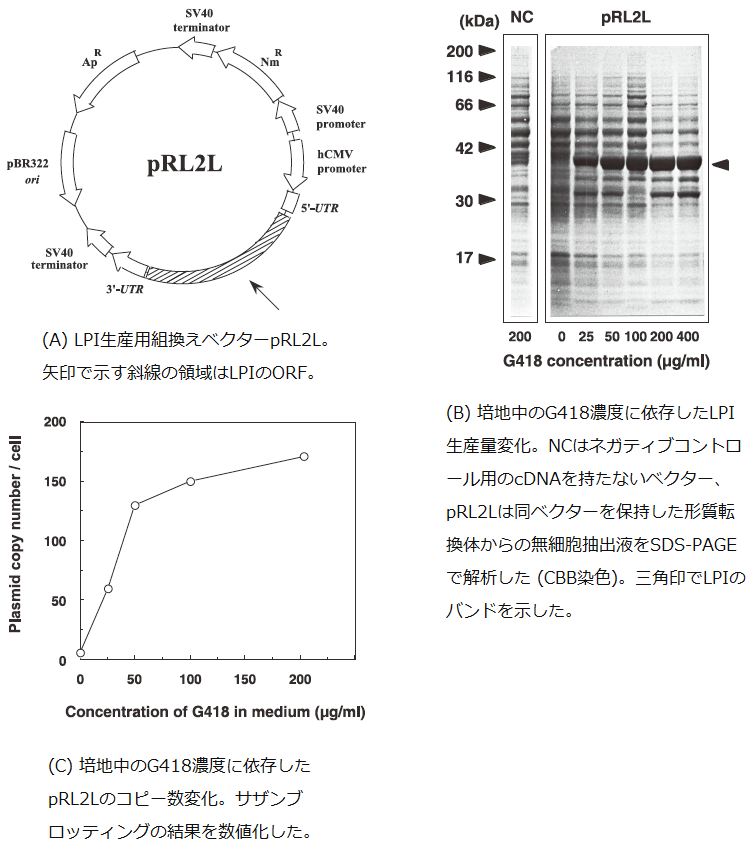
培地中の抗生物質G418濃度に依存してプラスミドコピー数が増加することを、ヒト繊維芽細胞由来のリポコルチンI (LPI) 生産量変化を指標に調べるため、プラスミドpRL2L (図1A) を構築した。このプラスミドは、SV40プロモーターに制御されたネオマイシン耐性遺伝子 (NmR) と、hCMVプロモーターに制御されたLPI cDNAを持つ。S. pombeの形質転換体は、Okazaki らの方法10)に従い、このプラスミドと導入ベクターpAL7 (PstI 消化により線状化) でロイシン要求性のleu1-32 株を同時に形質転換することにより作製した。導入ベクターにはS. cerevisiae のイソプロピルリンゴ酸デヒドロゲナーゼ遺伝子LEU2 (S. pombe のleu1 を相補可能) ならびに複製開始配列と安定化配列であるars1 とstb が含まれており、S. pombe のロイシン要求性を相補し、かつプラスミドが安定に分配される。pRL2LとpAL7とは、S. pombe内で相同組換えによって融合し、一体化したプラスミドとして存在するものと推定されている。この形質転換体を0~400μ g/mlのG418を含有するYPD培地で培養し、得られた菌体の無細胞抽出液をSDSPAGEで解析した (図1B)。LPIを示す37kDのバンドの濃さは、0~100μ g/mlのG418濃度では徐々に増加し、100~400μ g/mlでは飽和に達した。この時の生産量は、ウエスタンブロッティングの結果から、胎盤から精製したものを基準として、全菌体タンパク質の50%以上であると見積もられた11)。S. pombe はG418存在下ではNmR産物を増殖に必要とする。SV40プロモーターの転写活性が比較的弱いため、G418濃度に対して十分量のコピー数を持つ細胞のみが増殖に必要な量のNmR産物を生産し、よって選択的に増殖可能である。サザンブロットの結果から、プラスミドのコピー数はG418濃度が0~50μ g/mlでは直線的に上昇し200μ g/mlで最大に達することがわかった (図1C)。これらの結果から、異種タンパク質であるLPIの生産はプラスミドのコピー数に依存しており、そのコピー数は培地中のG418濃度に依存することが明らかとなった。
図1 ベクターコピー数に依存した異種タンパク質生産量の最大化
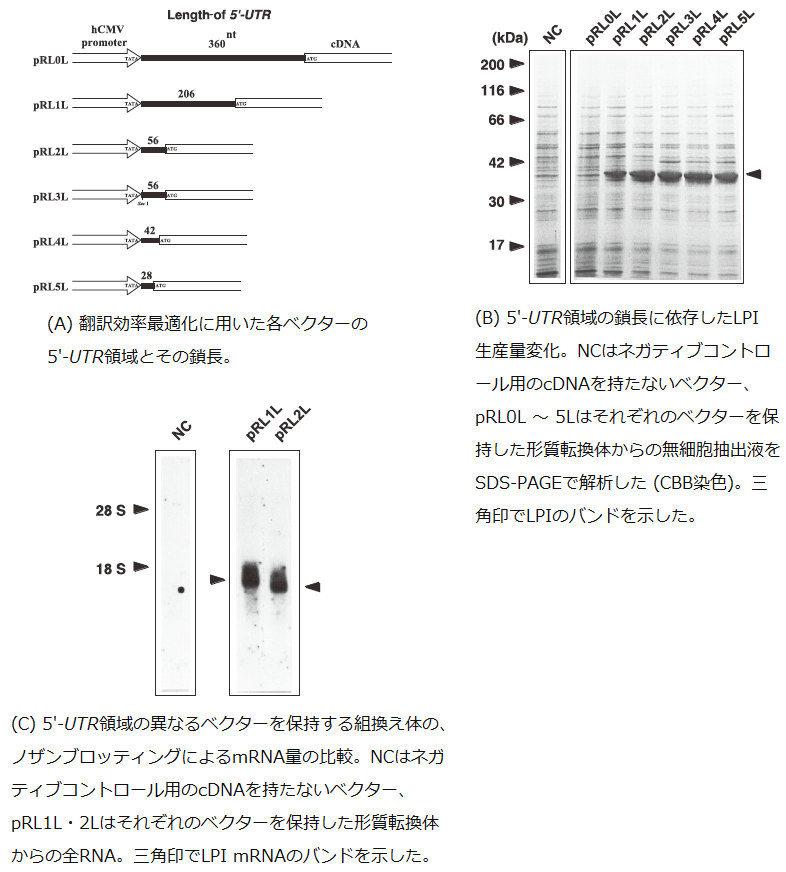
一方、翻訳活性を最適化するために、発現ベクターの5'-非翻訳領域 (UTR) の鎖長の改変を試みた。5'-UTRはhCMVプロモーターのTATA配列と外来遺伝子の開始コドン間と定義し、その長さが異なるプラスミドpRL0L~5L (図2A) を作製し、これらのプラスミドで形質転換した株を100μ g/mlのG418を含有するYPD培地で培養し、得られた菌体の無細胞抽出液をSDSPAGEで解析した (図2B)。その結果、pRL2L~4Lを保持する形質転換体で最も高いLPIの生産量を示した。5'-UTR が比較的長いpRL0L・pRL1Lでは、発現量は低く抑えられた。逆に長さが28塩基対と短いpRL5Lでも発現量は若干低下しており、これは開始コドンからの翻訳開始ではなく、ORF内のメチオニン (第3残基) から翻訳が始まったものであり、正しい翻訳を行うためには短すぎることがわかった。すなわち、5'-UTRの長さは50塩基程度が最適であることがわかった。この結果が翻訳レベルの差異によるものであり、転写量の差によるものではないことをノザンブロットによって確認した。pRL1L・pRL2Lを保持する形質転換体から全RNA画分を調製し、LPI遺伝子をプローブとしてノザンブロットを行い、それぞれのmRNAの量を比較した (図2C)。その結果、mRNAの量はほぼ同等であることがわかった。これらの結果から、5'-UTRの長さに依存して転写効率が変化するのではなく、翻訳効率が変化すること、50塩基程度が異種タンパク質生産に最も適当であることがわかった。
図2 5'-UTR領域の鎖長に依存した異種タンパク質生産量の最大化
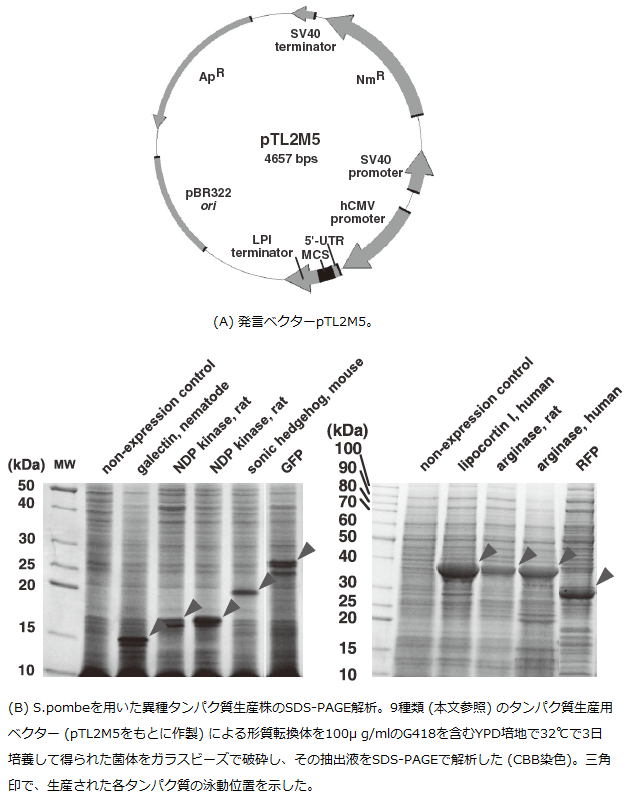
以上の検討をもとに、様々な異種タンパク質の生産を簡便に行える発現ベクターpTL2M5を作製した (図3A)。このベクターわゆるATGベクターであり、ベクターのマルチクローニングサイト (MCS) 上のATGに外来遺伝子の開始コドンを挿入することができる。このベクターを用いて9種類のタンパク質 (リポコルチンI・アルギナーゼ (ヒト・ラット)・NDPキナーゼ (α体・β体)・ガレクチン・ソニックヘッジホッグ・緑色蛍光タンパク質 (GFP) ・赤色蛍光タンパク質 (RFP) ) のそれぞれのcDNAの発現を試みた。その結果、いずれも高い量で生産可能であることがわかった (図3B)。
図3 最適化されたS. pombe用発現ベクターとそれを用いた異種タンパク質生産例
4.誘導型12)・組込型13)を用いた発現系の改良
前項で述べたhCMVプロモーターを用いた生産系は、異種タンパク質の生産に有効であるが、菌体増殖時にも常に外来遺伝子が発現している構成的なシステムであるため、その産物が酵母の生育に悪い影響をおよぼすような場合は、生産量の減少や形質転換体自体の取得が困難になる場合がある。そこで、このようなタンパク質の効率的な生産にも対応するため、菌体増殖と異種タンパク質生産が分離可能である誘導型発現系の構築を試みた。
分裂酵母の培養には、炭素源としてグルコースやフルクトースが主に用いられる。培地中にこれらの単糖が存在しない場合、スクロースをグルコースとフルクトースに分解する酵素であるインベルターゼの発現が誘導され、生育に必要な炭素源を獲得する。S. pombe でもS. cerevisiae と同様の、グルコース濃度の低下によりインベルターゼの合成抑制が解除される脱抑制機構が存在する。そこで、この分裂酵母インベルターゼ遺伝子14)のプロモーター領域の下流に、レポーターとしてGFPをつないだベクターpRI0EGFP (図4A) を作製し、このベクターによるS. pombe形質転換体のGFP生産量 (菌体あたり) を、その蛍光値を指標として調べた。
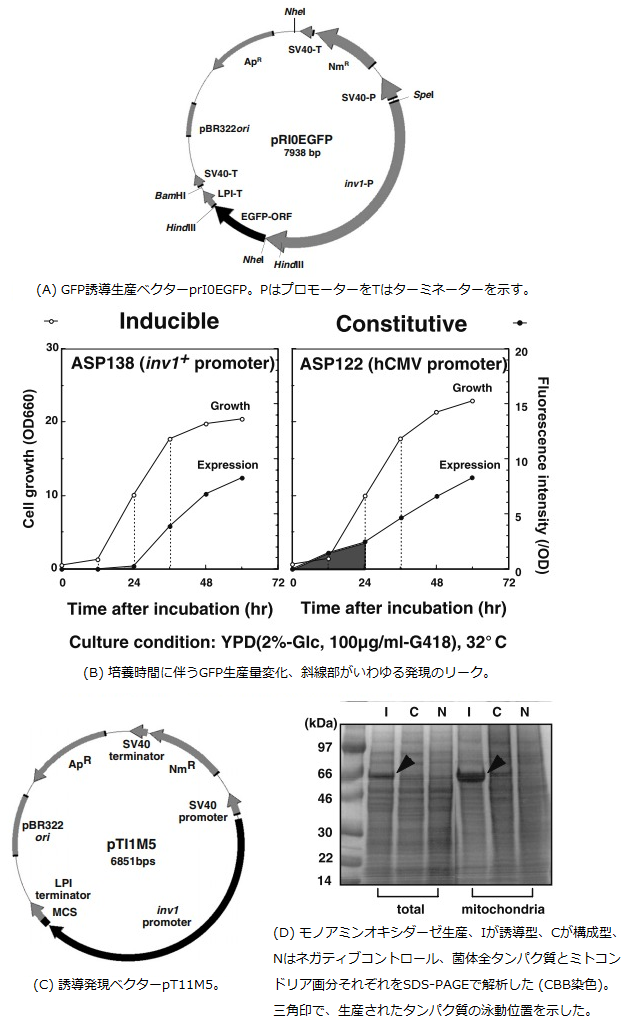
図4 S. pombe誘導型発現系
先と同様の方法で構築された形質転換体ASP138株を100μ g/mlのG418を含むYPD培地に植菌し、32℃で培養した。培養液の発する蛍光値を測定し、GFPの生産量を調べた。その結果、非誘導型であるhCMVプロモーターによって発現させているASP122株に比べ、ASP138株では増殖期中期まで蛍光が観察されず、グルコースが枯渇する増殖期後期になってはじめて生産が開始することがわかった (図4B)。これは誘導型プロモータであるインベルターゼプロモーターからの発現がグルコース存在下で抑制 (ただしこの発現抑制はまだ完全なものではなく、図中斜線部で示すように若干の発現のリークが残っている) され、グルコースが消費されることによって抑制が解除されるためであり、この機構が異種タンパク質であるGFPの生産にも利用できることがわかった。この発現系は、自身の生理活性のために生産量が低く抑えられるタンパク質を生産可能とすることが期待され、実際にpRI0EGFPをもとに発現ベクターとして構築されたpTI1M5 (図4C) を用いて、マウス由来のモノアミンオキシダーゼというミトコンドリアに輸送局在されるタンパク質の生産が可能になった (図4D)。
一方、染色体組込型の外来遺伝子発現系を構築するため、S. pombeのロイシン要求性leu1-32株を相補可能な組込型発現ベクターを作製した。このベクター (pTL2EGFP-nXL、図5A) には1個ないし複数個 (2個・4個・8個) のGFP発現カセットとともに、leu1 遺伝子座に組込むためのleu1+遺伝子を、アンピシリン耐性遺伝子 (ApR) とpBR322由来の複製起点で分断する形で組込んだ。形質転換の結果50世代以上安定な組換え体が得られ、発現カセットが染色体に組込まれていることを確認したが、同時に、それぞれのベクターが複数組込まれた株も取得された (図5B)。発現カセットを1コピーもつXL型のベクターを用いた形質転換体では1~8コピー、2コピーの2XL型では10コピー、4コピーの4XL型では16コピー、8コピーの8XL型では24コピーの導入が確認されており、各組込型ベクターが複数導入されていた。すなわち、容易に高いGFP生産量を示す株を得ることが出来る。GFP生産性も導入コピー数に依存しており、その最大値は染色体外プラスミド型発現ベクターを用いた生産系での値に匹敵する量であった。この方法は、実生産を前提とした非選択培養条件下での異種タンパク質生産に有効であり、ジャーファーメンターを用いた高密度培養でも、プラスミド型の生産系と同等の生産性を示すことが確認された。
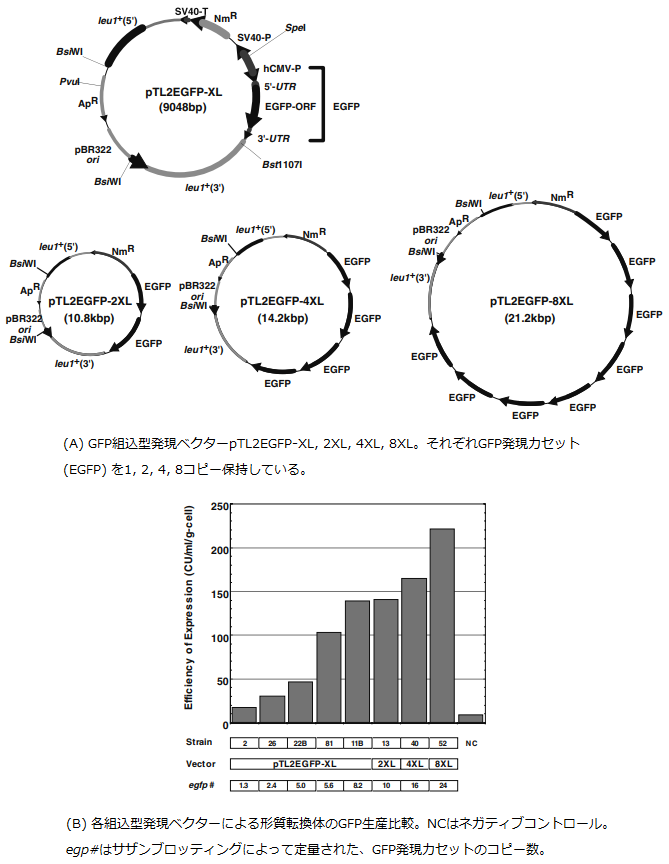
図5 S. pombe組込型発現系
以上のように、目的のタンパク質に応じて、構成型発現・誘導型発現、プラスミド型あるいは染色体組込み型で発現カセットを保持させる、また本稿では述べなかったが、菌体内・分泌型についても分泌シグナルの有無を選択することにより、最適の発現系を選択することが可能となっている。
5.異種タンパク質生産における課題と今後の発展に向けた取組み
本稿でもその一端をとりあげたように、異種タンパク質生産を行う上で、発現系に関する課題は、もちろん完全にではないが、かなりの部分が解決されてきた。新しい宿主細胞を用いる場合にも、短い時間で外来遺伝子発現系が整備されるようになった。しかしながら、個々のタンパク質の生産を最適化するにはまだまだ不十分な点が多く、そのためには宿主細胞自体の改変にまで踏み込んだ研究が行われている。S. pombeにおいてはまだその緒に就いたばかりであるが、次の二つの検討を開始している。
異種タンパク質を生産する場合に、プロテアーゼは不要である。もちろん細胞の生育や機能に必要なものも多いが、異種タンパク質によっては宿主プロテアーゼによる分解が顕著なため、生産量が減少することがある。そこでS. pombeのプロテアーゼ遺伝子を網羅的に破壊した株のセットを作製し、異種タンパク質生産に不利に働くものの検索を行った。サンガー研究所のデータベース ( GeneDB, http://www.genedb.org/genedb/pombe/index.jsp) を用いて、S. pombeのプロテアーゼをコードすると予測される遺伝子を特定した。プロテアソームの構成因子ならびにユビキチン (およびその類縁体) の代謝に関与すると推定されるものは、正常な細胞機能に必要なものであると考え、それらを除外した62個の遺伝子をS. pombe仮想的プロテアーゼ遺伝子 (ppp, S. pombe putative protease) とした。うち18個はすでに機能の一部が解明されているが、残りの44個は実験的には明らかにされていない。このうち52個の遺伝子破壊株の作製を終了しており、それらの単独欠損株に対して、比較的プロテアーゼによる分解を受けやすいタンパク質であるヒト成長ホルモン (hGH) を、分泌型異種タンパク質生産モデルとして検討したところ、20種類近くのプロテアーゼの遺伝子破壊が、生産物分解の抑制に有効であることを確認した15)。さらに、これら単独での有効性が確認されたプロテアーゼの多重欠損株を作製し、hGH生産における有効性評価実験を行い、異種タンパク質生産に適した「ミニマムプロテアーゼ」株の作製を行った。多重欠損候補のプロテアーゼ遺伝子として、上記20種類のなかからcdb4・isp6・mas2・pgp1・ppp16・ppp20・ppp22・ppp51・ppp52・ppp53・ppp80・psp3・sxa2 の13個を選抜し、ura4を選択マーカーとした融合PCR法を繰り返し用いて、多重欠損株を作製した。これらの株を用いてhGH生産試験を行ったところ、SDS-PAGEによる分析結果から、プロテアーゼ遺伝子の多重欠損によってhGHの分泌生産量が著しく増加されたことが確認された。特に6 重破壊株 (psp3, isp6, ppp53, ppp16, ppp22, sxa2) における効果は著しく、野生型株を用いた場合に比べて30倍の生産性増大を確認した16)。
また、生産性が低い異種タンパク質を生産している菌体の状態についての知見を得るため、DNAマイクロアレイを用いたトランスクリプトーム解析を行った。菌体内に可溶性で、大量に生産可能な異種タンパク質を生産している菌体の場合には、翻訳に関連する遺伝子の一部の発現上昇は観察されたものの、トランスクリプトームとしての大きな変化は観察されなかった。しかしながら、細胞質内で不溶性として検出される異種タンパク質や、何らかの原因 (例えば各細胞内小器官に輸送されるべき異種タンパク質が、過剰生産のために細胞質内に滞留する場合など) で生産性が低く押さえられているものの場合には、トランスクリプトームレベルでの大きな変動が生じており、様々な分子シャペロン遺伝子の顕著な発現亢進が観察された。なかでも、hsp16.0 遺伝子の変動は顕著であった。この遺伝子は、分裂酵母に熱ショックを与え、DNAマイクロアレイを用いてそれに応答する遺伝子を網羅的に検索した時にも、最も高い変動幅で発現上昇を示すことが観察された。また、Hsp16.0タンパク質がクエン酸合成酵素の熱凝集をin vitroで効果的に抑制すること、通常の状態で16量体のオリゴマー構造をとっており、これが熱によって2量体と思われる小さな構造に解離することによって、その熱凝集抑制効果を示すと考えられることから、Hsp16.0タンパク質が低分子量熱ショックタンパク質であることが明らかになっている17)。
6.おわりに
動植物個体から無細胞抽出物を用いる系に至 るまで、異種タンパク質生産を行うにあたっては、様々な選択肢が考えられる。しかしながら、目的とするタンパク質の質や量、あるいは用途 (研究用・産業用など) によって、適する系は異なっており、これは、あらゆるタンパク質が効率よく生産可能な汎用宿主細胞が、いまだに開発されていないのが原因である。いずれの生産系を用いても、充分な労力と期間をかければかなりの生産性が期待できるが、系とタンパク質の間の適合性が充分でなければ、思いの外、時間と費用がかかるため、現時点では目的とするタンパク質に合った系を注意深く選択する必要がある。多くの生産系では、発現遺伝子カセットの安定保持や、転写翻訳量の最大化はすでに充分なものになっているため、最も大きな判断基準となるのは、異種タンパク質の分解と不溶化の度合いであろう。前者においては、主に培養時のpHの制御方法の開発やプロテアーゼ多重破壊株の作製によって、生産物の分解がかなり低減される生産系が入手可能になった。後者に関しては、異種タンパク質の生産速度自体が、その宿主の許容量を越えてしまっているか、目的とするタンパク質が正しい構造を形成するための時間が不充分である、と考えられる場合が多いが、例えば大腸菌やその無細胞系のように、適当な分子シャペロンを強化することにより生産性の向上が図られている。
分裂酵母を用いた生産系においても、新規なS. pombe 用発現ベクターであるpTL2M5を作製した。このベクターを用いることで、外来遺伝子の発現を培地中の抗生物質G418によって制御可能とし、ベクターのATG化によって外来遺伝子を効率よく挿入することも可能になった。プロモーターにはS. pombe中で強力な発現を示すhCMV由来のものを用い、5'-UTRの鎖長を調節することによって、転写・翻訳のいずれも最適化されている。様々な異種タンパク質の生産例も得られており、今後もさらに多くのタンパク質の生産に用いることが出来ると考えている。さらに本稿で示したような発現ベクターの改良や、宿主改変に向けたプロテアーゼ多重破壊株の作製や分子シャペロンの同定が急ピッチで進んでいる。今後の研究開発の進展に期待したい。
謝辞
本研究の一部は、新エネルギー・産業技術総合開発機構より委託を受けた、生物機能を活用した生産プロセスの基盤技術開発ならびに微生物機能を活用した高度製造基盤技術開発によって行われた。
文献
1) Fujio, T.: Biotechnol. Appl. Biochem, 46, 145 (2007).
2) Giga-Hama, Y., Kumagai, H. eds.: Foreign gene expression in fission yeast Schizosaccharomyces pombe, Springer-Verlag, Berlin Heidelberg (1997).
3) Giga-Hama, Y., Kumagai, H.: Biotechnol. Appl. Biochem., 30, 235 (1999).
4) Giga-Hama, Y., Tohda, H., Takegawa, K., Kumagai, H.: Biotechnol. Appl. Biochem., 46, 147 (2007).
5) Nasim, A., Young, P., Johnson, B. F. eds.: Molecular Biology of the Fission Yeast, Academic Press, Inc., San Diego (1989).
6) Egel, R. ed.: The Molecular Biology of Schizosaccharomyces pombe, Springer-Verlag, Berlin Heidelberg (2004).
7) Wood, V., Gwilliam, R., Rajandream, M.-A., Lyne, M., Lyne, R., Stewart, A., Sgouros, J., Peat, N., Hayles, J., Baker, S., Basham, D., Bowman, S., Brooks, K., Brown, D., Brown, S., Chillingworth, T., Churcher, C., Collins, M., Connor, R., Cronin, A., Davis, P., Feltwell, T., Fraser, A., Gentles, S., Goble, A., Hamlin, N., Harris, D., Hidalgo, J., Hodgson, G., Holroyd, S., Hornsby, T., Howarth, S., Huckle, E. J., Hunt, S., Jagels, K., James, K., Jones, L., Jones, M., Leather, S., McDonald, S., McLean, J., Mooney, P., Moule, S., Mungall, K., Murphy, L., Niblett, D., Odell, C., Oliver, K., O'Neil, S., Pearson, D., Quail, M. A., Rabbinowitsch, E., Rutherford, K., Rutter, S., Saunders, D., Seeger, K., Sharp, S., Skelton, J., Simmonds, M., Squares, R., Squares, S., Stevens, K., Taylor, K., Taylor, R. G., Tivey, A., Walsh, S., Warren, T., Whitehead, S., Woodward, J., Volckaert, G., Aert, R., Robben, J., Grymonprez, B., Weltjens, I., Vanstreels, E., Rieger, M., Schafer, M., Muller-Auer, S., Gabel, C., Fuchs, M., Fritzc, C., Holzer, E., Moestl, D., Hilbert, H., Borzym, K., Langer, I., Beck, A., Lehrach, H., Reinhardt, R., Pohl, T. M., Eger, P., Zimmermann, W., Wedler, H., Wambutt, R., Purnelle, B., Goffeau, A., Cadieu, E., Dreano, S., Gloux, S., Lelaure, V., Mottier, S., Galibert, F., Aves, S. J., Xiang, Z., Hunt, C., Moore, K., Hurst, S. M., Lucas, M., Rochet, M., Gaillardin, C., Tallada, V. A., Garzon, A., Thode, G., Daga, R. R., Cruzado, L., Jimenez, J., Sanchez, M., del Rey, F., Benito, J., Domiguez, A., Revuelta, J. L., Moreno, S., Armstrong, J., Forsburg, S. L., Cerutti, L., Lowe, T., McCombie, W. R., Paulsen, I., Potashkin, J., Shpakovski, G. V., Ussery, D., Barrell, B. G., Nurse, P.: Nature (London) , 415, 871 (2002) ; Erratum in: Nature, 421, 94 (2003).
8) Tohda, H., Okada, H., Giga-Hama, Y., Okayama, H., Kumagai, H.: Gene, 150, 275 (1994).
9) Toyama, R., Okayama, H.: FEBS Lett., 268, 217 (1990).
10) Okazaki, K., Okazaki, N., Kume, K., Jinno, S., Tanaka, K., Okayama, H.: Nucl. Acids Res., 25, 6485 (1990).
11) Giga-Hama, Y., Tohda, H., Okada, H., Owada, M. K., Okayama, H., Kumagai, H.: BIO/TECHNOLOGY, 12, 400 (1994).
12) 特開平11-192094
13) 特開2000-262284
14) Tanaka, N., Ohuchi, N., Mukai, Y., Osaka, Y., Ohtani, Y., Tabuchi, M., Bhuiyan, M. S., Fukui, H., Harashima, S., Takegawa, K.: Biochem. Biophys. Res. Commun., 245, 246 (1998).
15) Idiris, A., Bi, K., Tohda, H., Kumagai, H., Giga-Hama, Y.: Yeast, 23, 83 (2006).
16) Idiris, A., Tohda, H., Bi, K., Isoai, A., Kumagai, H., Giga-Hama, Y.: Appl. Microbiol. Biotechnol., 73, 404 (2006).
17) Hirose, M., Tohda, H., Giga-Hama, Y., Tsushima, R., Zako, T., Iizuka, R., Pack, C., Kinjo, M., Ishii, N., Yohda, M.: J. Biol. Chem., 280, 32586 (2005).