【トピックス】
中性子を用いた酵素の立体構造解析への取り組み
玉田太郎、黒木良太
原子力機構・量子ビーム応用研究部門
1.はじめに
ポストゲノム時代を迎えた2000年以降、タンパク質の網羅的な立体構造決定を目指したプロジェクトが世界的に進行した。この結果、タンパク質の立体構造解析数は飛躍的に増加し、2007年2月末時点でプロテインデータバンク (PDB) へのタンパク質の構造登録総数は38,000を超えている (変異体構造を除くと12,000程度)。タンパク質の基本モチーフの構造情報が蓄積されてきた現在、構造生物学は「より『大きな』対象の解析」および「より『詳細な』解析」に重点的に取り組む時期を迎えている。前者はGPCR (G protein-coupled receptor) を代表とする膜タンパク質の解析や全体で分子量が100万を超えるような超分子複合体の解析がその主な課題である。後者は水素原子の位置情報を実験的に正確に決定し、側鎖の荷電状態や水分子の正確な配向を求めることを目的としている。後者のアプローチを通じて、酵素が触媒する様々な反応機構を水素原子の情報も含んだ「真の意味での」原子レベルで理解することができるであろう。そこで、酵素の精密な触媒機構を構造的な観点から解明する手法の一つとして中性子を利用した構造解析が注目され始めている。しかし中性子を用いた酵素の立体構造解析例は、わずか3種類 (ウシ・トリプシン1)、ウシ・RNase A2)、ニワトリ・卵白リゾチーム3)) しかなく、全タンパク質でもプロテインデータバンク (PDB) に登録された立体構造は、わずか17件しかない。本稿では、中性子の特徴と中性子の弱点である強度不足を補うための我々の取り組みを紹介し、酵素機能解明への展望を考える。
2.なぜ中性子か?
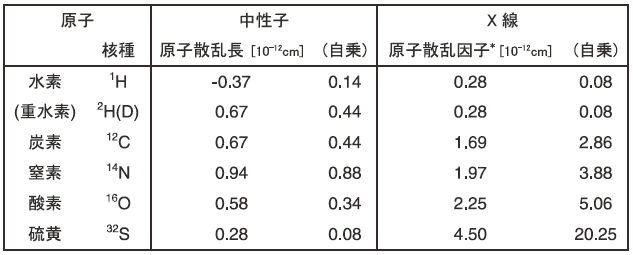
原子核を構成する粒子の一つである中性子はその名のとおり「中性 (電荷をもたない) 」粒子であるため物質に対する透過力に富むという特徴を有している。また、磁性粒子でもあるため、磁性を帯びた物質のスピン状態 (磁気構造) を得ることもできる。ただし、結晶からの回折現象に用いる際はX線と同様に波の性質を利用することになる。X線と中性子の回折現象の違いは、X線が原子核を取り巻く電子からの散乱であるのに対し、中性子は原子核そのものから生じる散乱であるところにある。表1にタンパク質を構成する各原子のX線および中性子の散乱効果を示す。X線の各原子との相互作用の強さは電子の数と比例し、その存在は電子密度として観測される。水素は炭素や窒素などに比べると電子数が少ないので、1Åを超える高い分解能の回折像を得てようやく水素原子の観測が可能となる。特に、水和水や解離基の水素の状態といったタンパク質の機能発現に関わっている水素原子については、0.8Åを上回る非常に高い分解能の解析をしなければ観測は難しい。西播磨のSPring-8、つくばのPhoton Factoryの両放射光施設では高輝度ビームラインの整備が進んでおり、これらのビームラインの稼動によりX線回折による水素の位置情報も含む構造解析例は増加していくと思われるが、原理的にX線が軽元素 (水素原子) の観測が苦手であるという事実は変わらない。
表1 タンパク質を構成する主な原子の散乱能
一方、中性子は各原子の原子核と相互作用し散乱を受けるため、その散乱の度合いは原子番号によらず、個々の原子の性質に由来する。表1から水素原子による中性子の散乱効果は、他の元素と遜色ないことがわかる (それぞれの値を自乗した値が、各原子の観測のしやすさを示す目安である)。このように、中性子は「 (炭素や酸素原子と同じように) 水素原子を観測できる」という特徴を有している。さらに、中性子の水素原子からの散乱は「負」の値を示しているため、観測される原子核密度の分布によっても他の原子と明確に区別できる。また、中性子は「同位体を識別できる」という特徴も有しており、重水素原子は「正」の散乱値を有している。タンパク質結晶を重水溶液に浸漬させることにより、水素原子の存在環境の違いを「正」および「負」の原子核密度として明確に区別できる (図1)。また、水素原子の重水素原子への置換は、回折強度測定の際のバックグラウンド強度軽減という観点で非常に重要であるが、これについては後述する。

ただし、原子中の原子核が占める大きさの割合は10-12程度 (つまりほとんどが電子) であるため、中性子はX線に比べて弱い相互作用しか示さない。このため中性子回折データ収集は長く困難であったが、日本原子力研究所 (現在の日本原子力研究開発機構: (略称) 原子力機構) の新村 (現、茨城大) らは、富士写真フイルムと共同で中性子回折点を感知できる中性子イメージングプレートの開発に成功した4)。現在、原子力機構の研究用原子炉 (JRR-3) 内に、中性子イメージングプレートを搭載した2台の中性子回折計 (BIX-35)および46)) が設置されており、生体高分子の中性子結晶解析用に稼働中である。
3.酵素の中性子解析からわかること
前述のように、中性子を用いた立体構造解析は、水素原子のような軽い元素の観測に適している。酵素には基質に生ずる化学反応を触媒する活性部位と特異的な基質認識に関わる基質結合部位が存在する。触媒残基においてはその解離状態を、基質認識においては水素結合や水和水の構造を知ることが酵素の複雑な機能を解明する上で重要な情報となる。ここでは酵素の中性子構造解析によって触媒機構や基質認識に関してどのようなことがわかるかについて、これまでの研究を紹介したい。
酵素の活性部位には、精密に配置された様々な解離性アミノ酸 (アスパラギン酸 (Asp)、グルタミン酸 (Glu)、ヒスチジン (His) 等) や、NADやFADなどの補酵素が、水素原子をやりとりすることによって基質の化学変化を直接触媒する。したがって、酵素の中性子構造解析によって触媒基の解離状態を知ることは、酵素反応の詳細な機構解明につながる。ニワトリ・卵白リゾチームの中性子構造解析では、異なるpH下で作成した結晶を用いることにより、卵白リゾチームの酵素活性を発揮する2つの重要なアミノ酸残基 (Glu35、Asp52) の解離状態が直接確認された。これら触媒基の解離状態の解明には酵素化学やタンパク質工学的なアプローチが実施され長い年月が必要であった。中性子による立体構造解析によって、触媒基の解離状態を直接観測でき、その役割を直接証明できるようになった。
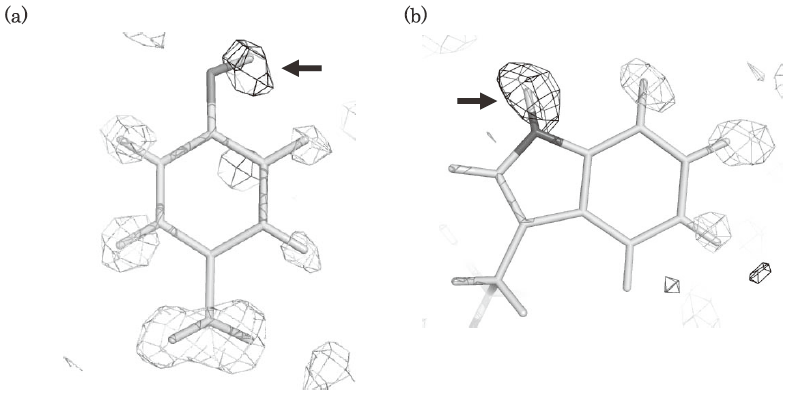
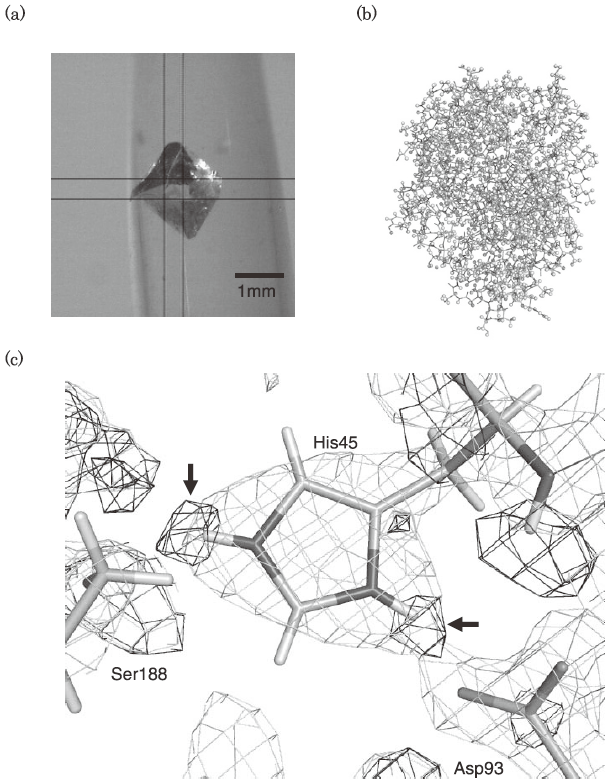
最近、我々は代表的なセリンプロテアーゼの一つであるブタ・膵エラスターゼの大型結晶をマクロシーディングを繰り返すことにより作成し (図2a)、2.3 Å分解能の中性子回折データの収集に成功した8)。現在、構造精密化中であるが、これまでに全原子の半分に相当する約1,700個の水素および重水素原子を確認済みで (図2b)、活性部位の電荷リレーシステムを構成する残基であるHis45のプロトン化の状態を確認している (図2c)。先に述べたようにX線回折法では、水素原子の観測のために1Åを超える高い分解能の回折データが必要である。しかしながら中性子回折では2.0Å台前半の分解能でも水素原子 (この場合は解離基の水素は重水素に置換されている) の存在を確認することができる。このように、中性子構造解析は従来のX線解析では困難であったによる触媒基の解離状態の観測を可能にする。この直接観測により、既知の酵素の触媒機構をより正しく理解することができるのはもちろん、反応機構が詳しく解明されていない新しい酵素の触媒機構の解明についても大変重要な情報が得られる。

酵素の触媒機構においては、その特異的な基質を正確に認識し分子内に取り込むことも重要である。その基質認識において水素結合は、特異性の発揮に重要な役割を演じる。水素結合は、電子供与性の水素が、電気陰性度の大きい酸素や窒素との共有結合によって正に分極し、負に分極した原子との間で静電的な相互作用 (水素結合) を形成するものである。しかしながら従来の構造解析では水素結合に関わる水素原子の構造的な特徴はほとんど議論されてこなかった。中性子回折による水素原子の直接観測から、タンパク質に見られる水素結合は、分子の局所的な環境の影響を受け、様々な特徴を示すことがわかった。中性子構造解析による水素原子の観測により、タンパク質においてはアクセプター原子の位置がドナーと水素原子をむすぶ直線上にはほとんど存在せず、水素結合の存在環境を反映し直線上からずれて存在することがわかった。このように中性子構造解析によって水素結合を正確に観測し、基質結合の様式を正確に把握することは、酵素の機能の解明に大きく貢献することになる。
また、酵素と基質の相互作用においては、基質結合状態の構造ばかりに注目が集まるが、中性子構造解析では、基質が結合していない状態の立体構造にも重要な情報が存在する。それは酵素の基質結合部位に存在する水和水の立体構造である。もちろんX線結晶解析においても、水和水の酸素原子の位置を知ることができる。しかしながら水和水の2つの水素原子の位置情報を知ることは難しい。日本原子力研究所の茶竹ら (現、京都大) は、中性子回折により得られた水和水に由来する原子核密度の分布図を詳しく観察し、その形に様々なものが存在することを見出した9)。茶竹らは水和水を、3つの原子が観測されることによるV字型、3つのうちの2つが観測された棒状、および1つのみが観測された球形に分類した。これらの形の違いはタンパク質表面の水和水の分子運動の自由度の違いを反映していると考えられる。このように中性子回折法により、水和水の位置情報だけではなく、その動的な特性も知ることができる。酵素が基質分子や薬物と結合する際には脱水和を伴うが、水和水の詳細な構造情報を知ることにより、脱水和に必要なエネルギーを正しく見積もることができるかもしれない。そうなれば基質や薬物の親和性をより正確に見積もることができるはずである。ヒトやウイルスに由来するある種の酵素は、創薬標的タンパク質の一つであると同時に、構造情報に基づくドラッグデザイン (SBDD) の重要な対象でもある。SBDD では「鍵と鍵穴」の形状・性質の相補性が留意されてきたが、水和水の脱水和はあまり考慮されてこなかった。中性子回折は「鍵穴」に存在する水和水の情報を提供することができるので、結合する薬物の親和性をより正確に把握することができるようになると考えられる。
これまでに解析されたタンパク質の中性子結晶構造の情報は、原子力機構と科学技術振興機構が共同で開発・運用している生体水素・水和水データベース『HHDB』に収録されている。このデータベースには中性子解析結果だけではなく、1 Åを上回る超高分解能のX線結晶構造も併せて登録されている。登録された水素原子は統計処理により様々に分類できるが、注目した水素原子の構造を直ちに視覚的に閲覧することができる機能も備えている。HHDBは下記のホームページにて公開されているので、是非参照いただきたい。 (http:// hhdb01.tokai-sc.jaea.go.jp/HHDB/)
4.中性子解析のこれから
ここまで述べてきたように、中性子結晶回折法はタンパク質中の水素原子の直接観測に適した手法であり、この手法を用いることによりX線結晶解析ではわからなかった水素原子の関わる様々な現象が明らかになってきた。しかしながら、これまでの構造解析数 (17件) が示すように、未だ構造生物学研究の普遍的なツールにはなりえていない。その原因は、先に述べたように「中性子の回折強度がX線に比べて遙かに弱い」こと、そのために「中性子回折データの収集には非常に大型の結晶を要する」ことにある。また、中性子はその特徴である透過性のため、X線のように集光することにより高輝度化することも難しい。そこで従来とは異なる新しい中性子発生源を開発し、データ収集の効率化が計画されている。それは原子力機構の原子力科学研究所 (東海村) において、建設が進められている大強度陽子加速器 (J-PARC: Japan Proton Accelerator Research Complex) である。J-PARCは2008年の稼動を目指して建設中であるが、J-PARCでは陽子を加速して水銀ターゲットに当てる方法 (核破砕) により得られるパルス中性子を使用することになる。中性子は電子よりも2000倍も重いため、異なる波長の中性子は異なる飛行速度を有する。そこで中性子をパルス状に発生させれば、時間分割することによって波長の異なる中性子を1つの装置で検出できることが原理的に可能となる。現在、これを可能にするTOF (Time of Flight) 型の中性子検出器の開発も行われており、J-PARCが最高出力に達した後には従来のJRR-3に設置した回折計の約50倍の効率でデータ収集が可能になると見込まれている。現在、JRR-3におけるタンパク質結晶からの中性子回折データ収集には1~4ヶ月を要するが、J-PARCにおいてはこれが数日で可能になる計算となる。
ただし、上記はあくまで「 (現在JRR-3の測定で用いている) 2 mm3 以上の大きさを有する結晶」を用いた場合の計算である。すなわち「 (良質な) 結晶の大型化」は今後も中性子構造生物学が取り組み続けなければならない課題である。これまで結晶を大きくする古典的な方法として、結晶化相図を作る方法や、マクロシーディング法が用いられてきた。また、最近ではフェムト秒レーザーおよび攪拌法を使うことによる結晶核生成のコントロールにより、良質の結晶を得ることに成功している。新旧のこれらの技術を組み合わせることにより、良質かつ大きな結晶を取得するハードルは徐々に低くなっていくと思われる。
結晶の大型化と同様に中性子構造生物学にとって重要な技術として、タンパク質の重水素化技術が挙げられる。中性子の特徴は水素原子を直接観測できることであり、先に (軽) 水素と重水素の識別が可能であることから水素原子の環境の違いもわかることについても触れた。ただし、中性子回折実験の際のバックグラウンドに対する影響という観点では水素原子は「無い方が望ましい」。というのは、水素原子は他の原子と比べて数十倍の非干渉性の散乱能を有しているためである。非干渉性の散乱は回折現象には寄与せず、バックグラウンドの上昇のみに影響を及ぼす。一方、同位体である重水素の非干渉性の散乱能は (軽) 水素の約1/40しかないため、タンパク質中の全ての水素原子を重水素に置き換えることができれば、バックグラウンドを軽減でき、よりS/N比の高い回折データ収集が可能になる。我々は現在「重水素化珪藻培地を用いた大腸菌発現」に取り組んでいる。これまでに、大腸菌を完全に重水素化された培地で培養することにより、発現するタンパク質の (軽) 水素をほぼ100%重水素に置換できた試料を得ることに成功している。フランスのラウエランジュバン研究所のPodjarnyらは完全重水素化タンパク質を用いて、約0.2mm3の結晶から2.2 Å分解能の回折データ収集に成功している10)。0.2 mm3程度の結晶は一昔前の実験室系でのX線回折実験では普通に作成していたサイズであり、中性子回折実験が「特別な」実験でなくなることを意味する。
5.おわりに
本稿では、中性子を用いた生体高分子 (特にタンパク質) の結晶解析について、その特徴とその技術の現状および将来について述べてきた。中性子が有する「水素 (重水素) 原子を直接観測できる」という特徴は、これまで困難であった水素原子の情報も含むタンパク質の構造決定を可能にする。我々は中性子構造解析の手法を最も有効に使える研究対象は「酵素」であると考えている。本誌の読者の方々に改めて言う必要はないが、酵素反応の多くは水素原子や水和水が主要な役割を果たしている。タンパク質のX線構造解析の90年代から現在に至る隆盛には放射光と遺伝子組換え技術の利用が不可欠であったことは周知の事実であるが、中性子構造解析もX線解析における90年代初頭の時期をいま迎えようとしている。拙文を読んでいただき、皆様の研究の展開の1つに中性子構造解析も加えていただけたなら、この上ない喜びである。
謝辞
ブタ・膵エラスターゼの中性子構造解析は、大阪府立大学の多田俊治教授、木下誉富博士と共同で実施している。ここに改めて感謝の意を表したい。
文献
1) Kossiakoff, A. A., Spencer, S. A.: Nature, 288, 414 (1980).
2) Wlodamer, A., Sjolin, L.: Proc. Natl. Acad. Sci. USA, 78, 2853 (1981).
3) Niimura, N., Minezaki, Y., Nonaka, T., Castagna, J. C., Cipriani, F., Hoghoj, P., Lehmann, M. S., Wilkinson, C.: Nat. Struct. Biol., 4, 909 (1997).
4) Niimura, N., Karasawa, Y., Tanaka, I., Miyajima, J., Takahashi, K., Saito, H., Koizumi, S., Hidaka, M.: Mucl. Instrum. & Methods Phys. Res., A349, 521 (1994).
5) Niimura, N.: Curr. Opi. Struct. Biol., 9, 602 (1999).
6) Kurihara, K., Tanaka, I., Niimura, N., Refai Muslih, M., Ostermann, A.: J. Synchrotron Radiat., 11, 68 (2004).
7) Kurihara, K., Tanaka, I., Chatake, T., Adams, M. W., Jenney, F. E. Jr., Moiseeva, N., Bau, R., Niimura, N.: Proc. Natl. Acad. Sci. USA, 101, 11215 (2004).
8) Kinoshita, T., Tamada, T., Imai, K., Kurihara, K., Ohhara, T., Tada, T., Kuroki, R.: Acta Crystallogr., F63, 315 (2007).
9) Chatake, T., Kurihara, K., Tanaka, I., Tsyba, I., Bau, R., Jenney, F. E. Jr., Adams, M. W., Niimura, N.: Acta Crystallogr., D60, 1364 (2004).
10) Hazemann, I., Dauvergne, M. T., Blakeley, M. P., Meilleur, F., Haertlein, M., Van Dorsselaer, A., Mitschler, A., Myles, D. A., Podjarny, A.: Acta Crystallogr., D61, 1413 (2005).