【トピックス】
フッ化糖を基質とする糖加水分解酵素の新しい活性試験法 -ALC法-
石原正規、小林厚志、野口真人、正田晋一郎
東北大院・工
1.はじめに
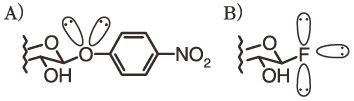
自然界には数多くの糖加水分解酵素が存在しており、地球上の炭素サイクルの一翼を担っている。現在、これら糖加水分解酵素は工業的に幅広く利用されており、食品の加工・製造などは、その最たる例である。糖加水分解酵素の多くは、細菌、酵母、カビなどの微生物が産生したものを用いている1)。所望の糖加水分解酵素を取得するためには、酵素の探索、精製、諸性質の解析が必須であり、そのためには、最適な活性試験を採用する必要がある。これまで、パラニトロフェニル体やウンベリフェリル体に代表される嵩高い発色団を有する合成基質を用いる活性試験が専ら行われてきた。しかし、これらの合成基質は、アノメリック酸素上に2個の非共有電子対しか持たず (図1A)、またアグリコン部位への認識能が糖加水分解酵素に依存するケースが多く、基質認識性の低下による「有効画分の見落とし」をしてしまう潜在的な危険性がある。我々は、フッ素原子の原子半径が小さいこと、ならびにアノメリックフッ素原子が3個の非共有電子対を有する点に着目し (図1B)、フッ化糖を活性試験基質として用いる糖加水分解酵素の新規活性法を開発した。事実、フッ化糖は糖加水分解酵素により認識され、その合成も比較的容易である。さらに、フッ化糖は酵素的糖鎖合成におけるドナー基質として有用であることから2-7)、配糖化反応に適した酵素を選別する手法としても、画期的な技術となりうる。本稿では新規活性試験法の原理、手順とその適用性について解説する。
図1 糖におけるアノメリック原子の非共有電子対A) p-NP誘導体、B) フッ化糖
2.アリザリンコンプレクソン (ALC) 法を利用するフッ化物イオンの定量
従来、フッ化糖を用いた酵素反応の追跡は、反応溶液をHPLCなどで分離して生成物自体を検出8) する方法、あるいは、19F NMRにより基質の還元末端のフッ素に由来するピーク面積の変化を観察することで行っていた9)。また、フッ化物イオンの直接定量法であるイオン電極法10)も、フッ化糖を用いた糖転移反応及び加水分解反応の追跡等に利用されている11,12)。これはフッ化ランタン (Ⅲ) を電極膜に用いたフッ化物イオン選択性電極による定量法である。いずれの方法も一度に一つの反応を追跡することしか出来ないため、カラム精製による酵素のスクリーニングなど、大量の検体を試験するには適さない。そこで、多くの検体を短時間で迅速に処理することの出来る、吸光分光法によるフッ化物イオンの検出に着目した。
フッ化物イオンの直接定量法として1959年にBelcherらによりアリザリンコンプレクソン (ALC) を用いる比色定量法が開発され13)、それ以来多くの研究者により改良が重ねられてきた14)。アリザリンコンプレクソン法 (ALC法) は、ALCとランタン (La3+) の錯体が、フッ化物イオンの存在下、混合配位子錯体を形成して620 nm付近に吸収極大を与えることを利用したフッ化物イオンの比色定量法である。ALC法はこれ以前の間接光度法に比べ感度・再現性がよく、また妨害元素も少ないことが特徴であり、上水試験法や多くの公定法に採用されている15)。
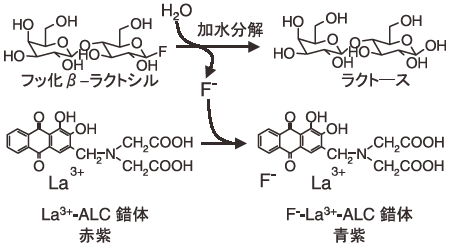
図2に活性試験法の概念図を示す。測定に用いる試薬に関しては、La3+−ALC錯体と緩衝剤 (ヘキサメチレンテトラミン+フタル酸水素カリウム) からなる混合製剤“ アルフッソン (Alfusone) ”が同仁化学より提供されており、水に溶解するだけで簡単にフッ化物イオンの定量への適用が可能である。
図2 フッ化糖を基質とする活性試験法の概要
本来、ALC法においては、増感効果を得るためアセトンなどの有機溶媒を添加した上で定量が行われる16)。しかし、有機溶媒を添加しない場合であっても、感度は低下するものの定量自体は可能である。我々は、感度の高さよりも定量操作の簡易化を重視し、有機溶媒の添加を行わずに定量操作を行った。また、アルフッソン水溶液に関しては、その濃度を本来の定量操作における最終濃度である0.5%にあらかじめ調製しておき、そこにフッ化糖と酵素の反応溶液の一部を添加することとした。
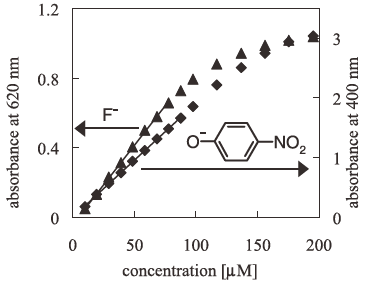
まず、簡易化した操作方法によるフッ化物イオンの定量範囲について検討を行った。ここでは、0.5%アルフッソン水溶液を1 mlを用意し、種々の濃度 (0~20 mM) のフッ化ナトリウム水溶液25µlを添加・撹拌した後、室温にて90分間放置し、試薬ブランクに対する吸光度を測定した。さらに、従来法と比較するためにパラニトロフェノールについても検量線を作成した。
その結果を図3に示す。これより、錯体溶液中のフッ化物イオン濃度が約80µMまでの範囲では定量的であることを確認した。ゆえに、速度論的解析に用いる錯体溶液中のフッ化物イオンの濃度は,本操作方法においては50µM程度が適当であるといえる。また、基質濃度が約80~200µMの範囲であっても、定量性は認められないが酵素活性の強弱を知ることはできるので、定性的な酵素スクリーニングを行うことができる。また、従来法の結果と比較すると、ほぼ同程度の定量範囲を有していることが確認された。
![]()
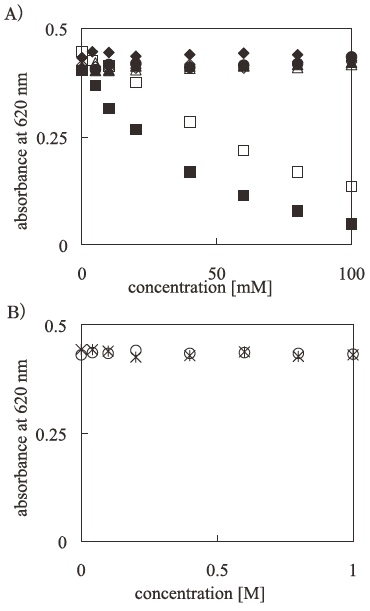
ALC法においては、ある種の塩によって検出感度が低下することが報告されている17)。そこで、酵素反応系において頻繁に用いられる化学種についてその濃度の影響を検討した。0.5%アルフッソン水溶液1 mlに、種々の化学種を含む2 mMフッ化物イオン水溶液を25µl加え、90分間室温にて放置した後、λ=620 nmにおける吸光度を測定した。ブランクは0.5%アルフッソン水溶液1 mlに蒸留水25µlを加えたものとした。その結果を図4に示す。これによりほとんどの緩衝液成分は妨害種とならないことが明らかになったが、燐酸イオン、クエン酸イオンに関しては、大きく妨害することがわかった。しかし、これらのイオンに関しても、20 mM程度の濃度範囲であれば、感度が低下するものの定量性は認められるため、反応溶液と同濃度の塩を含むフッ化物イオン溶液で検量線を作成することにより定量が可能である。さらに、同様の緩衝範囲を有するグッドバッファーは、ALC法に影響を与えないため燐酸イオン及びクエン酸イオンによる妨害の問題を克服できると考える。

3.フッ化糖を糖供与体とする配糖化反応をプロモートする酵素の探索
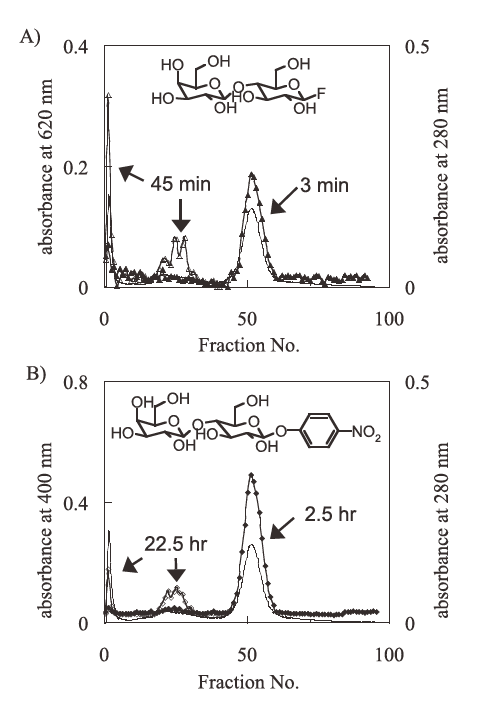
我々の研究室では、Trichoderma viride 由来の粗酵素製剤セルラーゼがフッ化β-ラクトシル (Lac-F) を糖供与体とするラクトシル化反応のすぐれた触媒となることを報告している4,8)。T. viride 由来のセルラーゼは、セロビオヒドロラーゼやエンドβ-グルカナーゼなどの複数の酵素で構成されている。そのため、どの酵素がLac-Fを選択的に認識しているか不明であった。そこで、Lac-Fを特異的に認識する酵素を探索するために、ALC法を用いてセルラーゼの精製を行った。酵素はT. reesei由来の粗酵素製剤セルクラスト (Novozymes) を用いた。まず、陰イオン交換クロマトグラフィー (DEAE Sepharose FF column) を用い粗分画を行った後に、得られた各フラクションについてALC法にて加水分解活性試験を行った。さらに、従来用いられてきたp-ニトロフェニル、β-ラクトシド (Lac-pNP) に関しても同様の活性試験を行い、その反応時間について比較を行った。結果を図5に示す。Lac-Fの場合では非常に短時間に有意な活性を確認することが可能であった。一方で、Lac-pNPにおいては、同程度の活性を確認するのに20~50倍程度の時間が必要であった。活性画分をさらに精製したところ、Lac-Fに対して特異的な酵素としてエンドβ-グルコシダーゼIII (EGIII) を同定した。
上記手法では、フッ化ラクトシルの水解を一定時間行った後、反応混合物をアルフッソン水溶液によって希釈しているだけであるので、厳密な意味での反応停止は行われていない。そのため、速度論解析などの厳密な活性評価に適用することは出来なかった。アルフッソン水溶液に様々な酵素変性剤を加えて反応停止を試みた。その結果、5 Mの尿素を含むアルフッソン水溶液では、フッ化物イオンの検出において増感効果が確認され、フッ化グリコシル加水分解活性試験においても影響がないことがわかった。
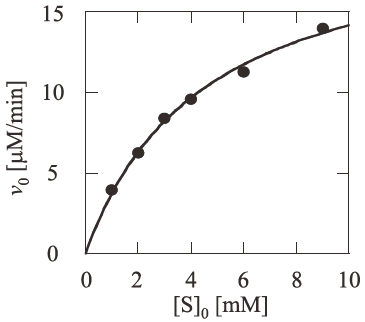
EGIIIのLac-Fに対する比活性は46 U/mg (pH5.5, 30℃) であるのに対し、Lac-pNPは3 mU/mg (pH5.5, 30℃) 以下であった。さらに、Lac-Fに対する反応速度論的解析を行ったところ各パラメーターは、Km=4.6±0.3 mM、kcat=50±1s−1と求めることができた (図6)18)。
図6 ALC法を用いるLac-Fに対するEGIIIの反応速度論的解析
さらに、尿素を用い反応を確実に停止させることで、錯体溶液の比率が低いマイクロプレートアッセイにおいてもALC法が適用できることが確認された (data not shown)。
4.おわりに
フッ化糖を基質とする活性試験法の開発について紹介した。本手法は、p-NP 誘導体などを用いる従来法と同様に操作方法が簡便である。フッ化糖は、C−F結合が高い反応性を有するため、糖加水分解酵素による水解速度が非常に大きい。そのため、ごく微量の酵素に対しても、その活性を短時間で確実に感知することができる。本手法を用いれば、活性の低い酵素であっても「有効成分の見落とし」をすることなく極めて高感度な活性試験を行うことができるので、今後様々な分野への応用が期待される。
文献
1) 岡田茂孝、北畑寿美雄、監修: 工業用酵素ハンドブック、講談社 (1999).
2) Barnett, J. E. G., Jarvis, W. T. S., Munday, K. A.: Biochem. J., 103, 699 (1967).
3) Hehre, E. J., Genghof, D. S., Okada, G.: Arch. Biochem. Biophys., 142, 382 (1971).
4) Shoda, S., Obata, K., Karthaus, O., Kobayashi, S.: J. Chem. Soc., Chem. Commun., 1402 (1993).
5) Mackenzie, L. F., Wang, Q. P., Warren, R. A., Withers, S. G.: J. Am. Chem. Soc., 120, 5583 (1998).
6) 正田晋一郎、泉龍孝: 酵素工学ニュース、47, 5 (2002).
7) Belcher, R., Leonard, M. A., West, T. S.: J. Chem. Soc., 3577 (1959).
8) Shoda, S., Kawasaki, T., Obata, K., Kobayashi, S.: Carbohydr. Res., 249, 127 (1993).
9) André, C., Spangenberg, P., Gentil, E., Rabiller, C.: Tetrahedron : Asymmetry, 12, 779 (2001).
10) Frant, M. S., Ross, J. W. jr.: Science, 154, 1553 (1966).
11) Liu, W., Madsen, N. B., Braun, C., Withers, S. G.: Biochemistry, 30, 1419 (1991).
12) Lougheed, B., Ly, H. D., Wakarchuk, W. W., Withers, S. G.: J. Biol. Chem., 274, 37717 (1999).
13) Belcher, R., Leonard, M. A., West, T. S.: J. Chem. Soc., 3577 (1959).
14) 橋谷 博、吉田秀世、武藤 博、分析化学、16, 44 (1967).
15) 工業用水試験方法JIS K0101、工業排水試験方法JIS K0102、排ガス中フッ素化合物分析方法JIS K0105 など
16) Yamamura, S. S., Wade, M. A., Sikes, J. H.: Anal. Chem., 34, 1308 (1962).
17) Belcher, R., Leonard, M. A., West,,T. S.: Talanta, 2, 92, (1959).
18) Shoda, S., Shintate, K., Ishihara, M., Noguchi, M., Kobayasi, A.: Chem. Lett., 31, 16 (2007).