【トピックス】
フッ素科学での環境持続型循環系の構築
北爪智哉、岩井伯隆
東工大院・生命理工、東工大・フロンティア研
1.はじめに
科学の分野では、90年代の初めからグリーン・サスティナブルケミストリーという立場からのさまざまな取り組み方が行われてきており、さらに物質生産という領域においては、いよいよ資源の枯渇化が現実問題視され、あらゆる化成品の持続可能な循環系による物質生産体制の重要性が提起され始めている。物質生産においても使用した溶剤の再利用という立場からの研究がここ十年来盛んに行われており、そのひとつにイオン液体を反応場として利用するという研究が活発に行われている。イオン液体という物質が合成されたのは、100年も前であるが反応場として利用する試みは、90年代半ばから始まり現在では世界各国の研究者によって活発に研究されており、概観すれば一般的な有機溶媒中で進行する合成反応の反応場としてイオン液体は使用可能である1)。一方、生体触媒、特に加水分解酵素を活用する物質創製にイオン液体は利用出来るのかという点について鳥取大学の伊藤等2)を中心に活発に研究が展開している。我々のグループは、フッ素系物質を研究主題としており、最近では「フッ素科学では環境に配慮された循環型のプロセスの構築が展開されているだろうか?」というような命題に取り組んでいるので、この小文では酵素とイオン液体という観点とフッ素化酵素 (フルオリナーゼ) について紹介したい。
2.生体触媒反応場としてのイオン液体
生体触媒反応で重要なことは、温度とpHの設定であることはよく知られている。80年代から有機溶媒中での生体触媒による合成反応が数多く報告されており、有機溶媒を使用するときには上記の条件が必ずしもコントロールされているわけではない。反応場としてイオン液体を考慮するときには有機溶媒と一種として考えることができ、この考えに立てばイオン液体中での生体触媒反応も進行可能であると推定できる。2000年に入り、イギリスのCull等が水-[bmim][PF6] (1-butyl-3-methyimidazolium hexafluoropho sphate)(4:1)という2相系溶媒中でRhodococusを用いるニトリルのアミド化反応を報告したのが、生体触媒反応とイオン液体との関わりの最初の例である3)。さらに、2相系での酵素thermolysin を用いるアミド化反応も明らかにされたが4)、これら先駆的な報告例では水と混じり合わないイオン液体と水との混合溶剤が用いられており、反応はイオン液体中での酵素反応が起こっているのかどうかははっきりしない。
イオン液体を反応場とする例としては、2000年にSheldon等によって報告された。彼らは、Candida Antarctica から単離されたリパーゼ (CAL-B) を用いてアミド化反応を行っている5)。さらに、CAL-Bとイオン液体の組み合わせにより系内で生成させた過酸化物を利用してシクロヘキセンのエポキシ化反応を報告している5)。酵素の特長である不斉反応ではないが、イオン液体中での実質的な初めての酵素反応ということができる。
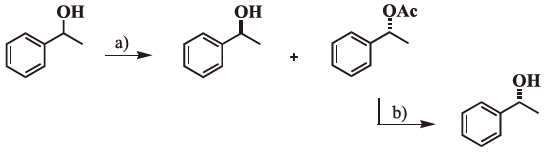
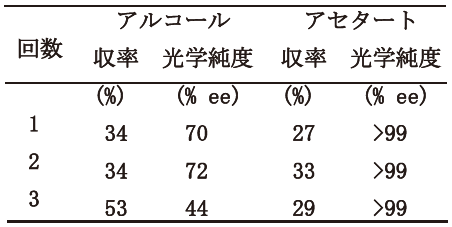
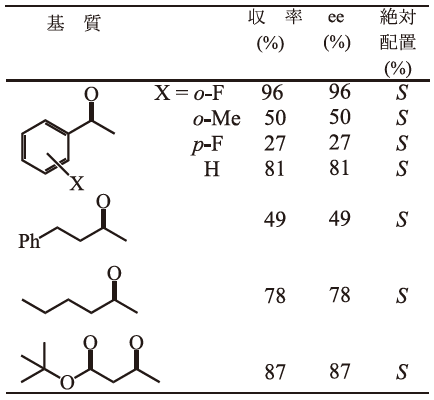
不斉認識という酵素反応の特長を生かした報告は、我々が2000年7月に開催された国際会議で不斉エステル化反応を報告した (図1、表1)6)。

表1 不斉エステル化反応での再利用
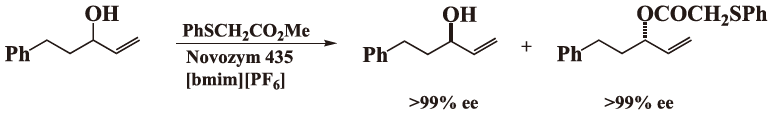
同時期に、鳥取大学の伊藤等をはじめとして諸外国においいても同様な反応が検討されており、これ以後図2に示したようなこの種の反応が活発に展開されている7)。伊藤等の積極的な研究成果は、それ以後のこの領域の研究の中心であり、現在も大きな展開をみせており総説にまとめられている2)。
図2 減圧条件下での光学分割
3.菌体の利用
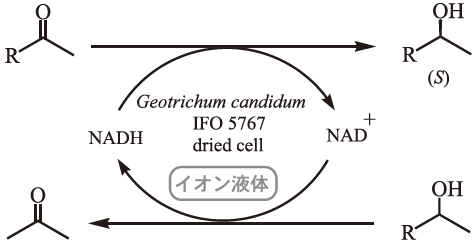
チチカビ (Geotrichum candidum IFO5767) を利用したケトンの不斉還元反応の詳細が筆者等のグループから報告されている。特に、チチカビを利用する不斉還元反応では、水-イオン液体混合溶媒を使用すると親水性のイオン液体[emim][BF4] (1-butyl-3-methylimidazolium tetrafluoroborate) を使用したさいには、反応がほとんど進行せず疎水性のイオン液体[emim][BF4] を使用したさいには収率の向上がみられた。この反応系では、媒体として水層が必要であることが判明したので吸水性ポリマーにチチカビを固定化したのち、様々なイオン液体で不斉還元を試みた結果、ある種のイオン液体では反応が進行しないことが明らかにされている (図3、表2、表3、表4)8)。
![]()
![]()
![]()
表4 固定化Geotrichum candidiumによる不斉還元反応
4.抗体酵素 (aldolase antibody 38C2) の機能発現
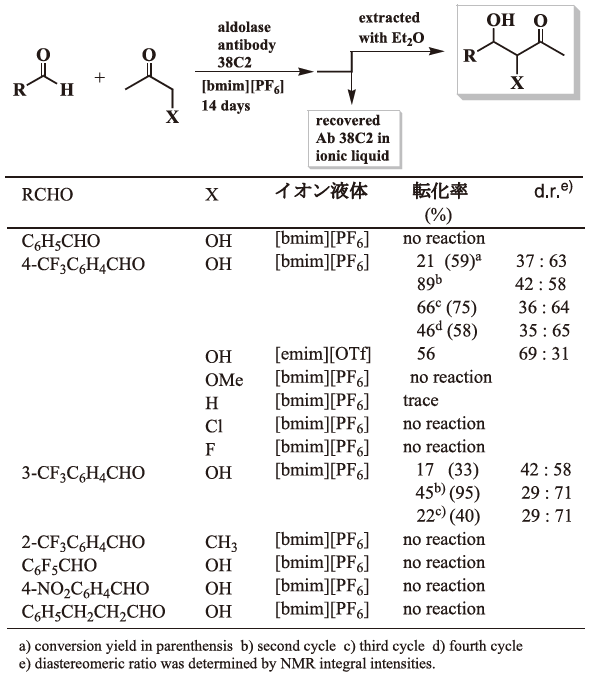
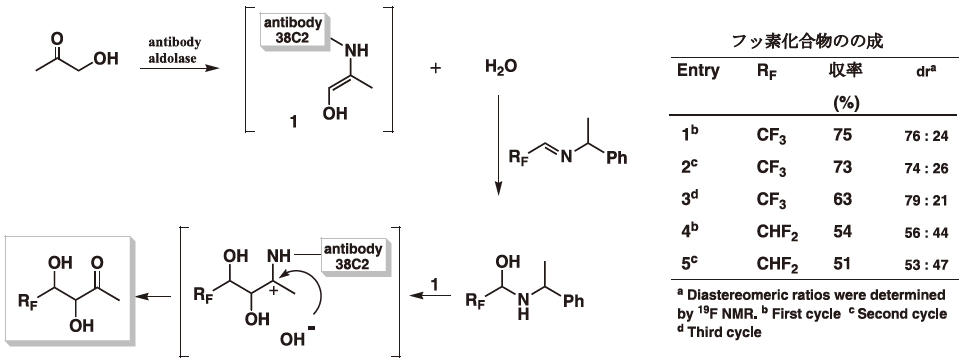
市販されている抗体酵素 (aldolase antibody 38C2) のイオン液体中での機能発現についていくつかの反応で検討した。この抗体酵素は、水中でのアルドール反応では基質として様々なカルボニル誘導体が利用できるがことが詳細に報告されているが、イオン液体中では基質として利用できる物質が制限される。図4の我々の結果から、基質としてはヒドロキシアセトンのみが利用可能でありアルデヒドにも制限があることが判明した。生成物の立体選択性も高いものではないが、イオン液体中でも抗体酵素が機能を発現することが確認された9)。そこで、反応性の高いことが期待されるフッ素系物質を基質として利用し、この抗体酵素を利用するいくつかの反応を試みた。フッ素系イミン類とでは、興味深い反応が進行し他の有機溶媒では生成しない化合物を得ることが出来た (図5)。
図4 イオン液体中での抗体酵素の機能発現
図5 抗体酵素存在下でのイミン類とヒドロキシアセトンとの反応
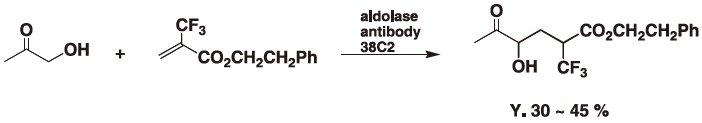
また、フッ素系物質ではマイケル付加反応も低収率ながら進行させることが出来た (図6)。
図6 抗体酵素を用いるイオン液体中でのマイケル不可反応
5.フッ素化酵素 (フルオリナーゼ)
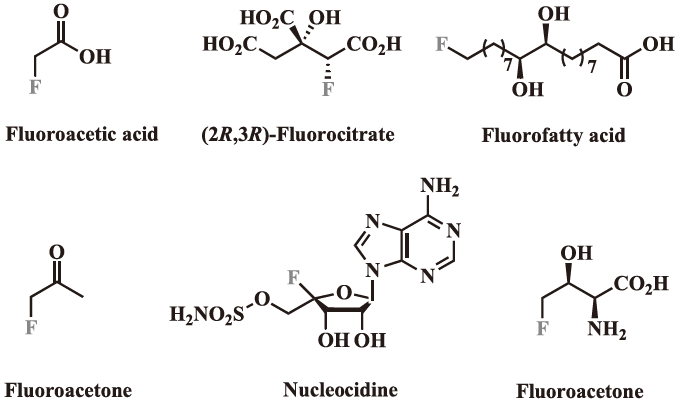
天然にハロゲン化合物は数多く知られているが、天然の有機系のフッ素系物質として知られているものは、たった12種類に過ぎず代表的な化合物を図7に示した10)。
図7 天然化合物として存在している有機フッ素系物質の代表例
フッ素は地球上 (正確には地殻上) で13番目 (クラーク数では、17番目) に多い原子であると言われており、この順位は他のハロゲン原子 (塩素、臭素、ヨウ素) と比べても塩素 (クラーク数: 11番目) の次に当たり、その量は塩素の6分の1程度である11)。しかしながら、海水中に存在するフッ化物イオンの濃度は塩化物イオンに比べて1万分の1にも満たない。無機のフッ化物イオンからフッ素系物質を生成する酵素の構造が解明されたのはつい最近のことであり12)、これまでのハロゲン化合物の合成機構とは全く異なる機構によるフッ素化反応が生体内で起こることが報告された。この酵素 (フルオリナーゼ) が見出された微生物Streptomyces cattleyaは、もともと無機のフッ化物イオンを培地に添加することで、モノフルオロ酢酸やモノフルオロトレオニンを生成することで知られていた細菌である13)。
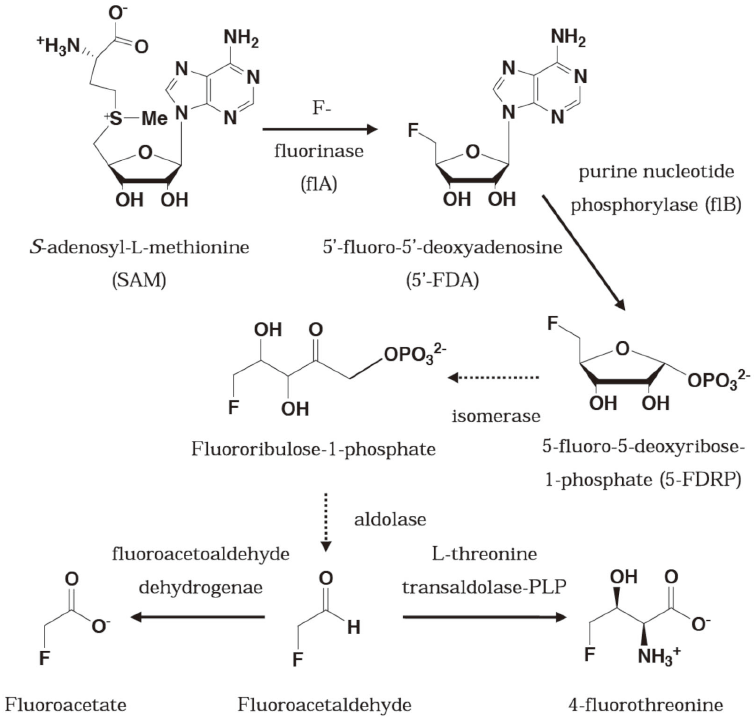
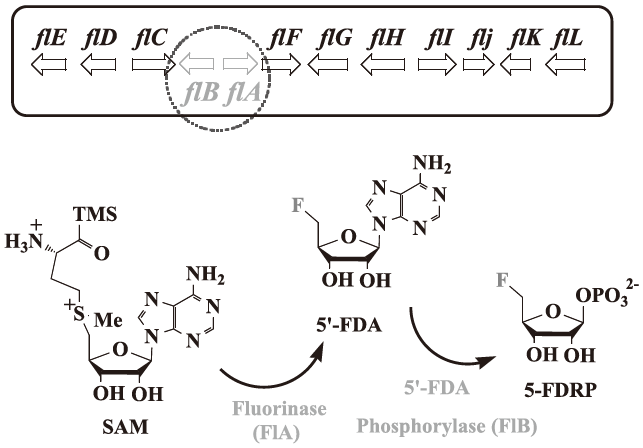
この細菌は放線菌の一種で、フルオリナーゼと名づけられた酵素によって無機フッ化物からC-F 結合を作り、有機フッ素系物質である5'-フルオロ-5'-デオキシアデノシン (5'-FDA) を作り出すことが明らかとされた (図8)。
図8 放線菌S. cattleya内でのフッ素化反応とフッ素系物質の代謝経路
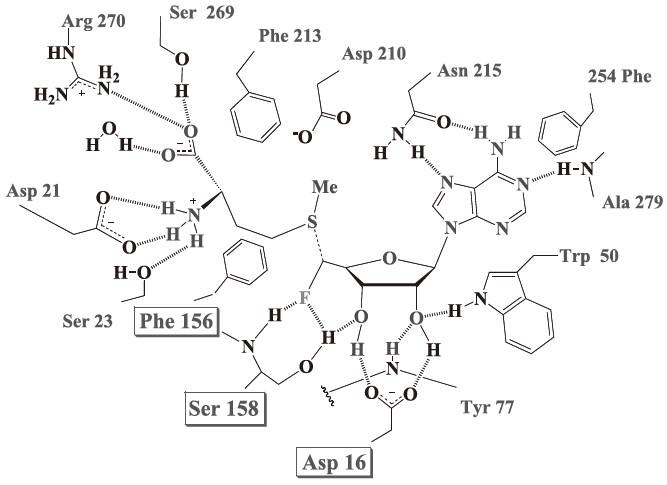
最終産物として報告されていたモノフルオロ酢酸やモノフルオロトレオニンからは予想が出来ない化合物がフッ素化の出発物質であることが明らかとなり、その代謝経路には強い興味が持たれている。残念ながら、この代謝経路はいまだに全容がつかめていないのが現状であるが、驚くべきは出発物質がS-アデノシル-L-メチオニン (SAM) であるということである。SAMは生体内においてはメチル化の基質として供給され、ゲノムDNAのメチル化などに用いられる。DNAのメチル化反応は生物が自己認識をする上で非常に重要な反応であるので、ほとんど全ての生物がSAMをメチル化の基質として用いているが、SAMが全く違う使われ方をした例は、恐らくこのフッ素化反応が初めてではないだろうか。フルオリナーゼは5'位の炭素をフッ素化することによって、アデノシンのフッ素化誘導体5'-FDAを生成する。この反応機構は5'位の炭素を中心にして硫黄原子の背面からフッ化物イオンが求核的に攻撃するSN2型の反応であると考えられている。フッ化物イオンはこのとき水分子から脱溶媒和されていることが必要となり、非常に小さな結合ポケットによりフッ化物イオンは脱溶媒和環境を提供されていることがフルオリナーゼタンパク質のX線結晶構造解析結果より示唆されている。
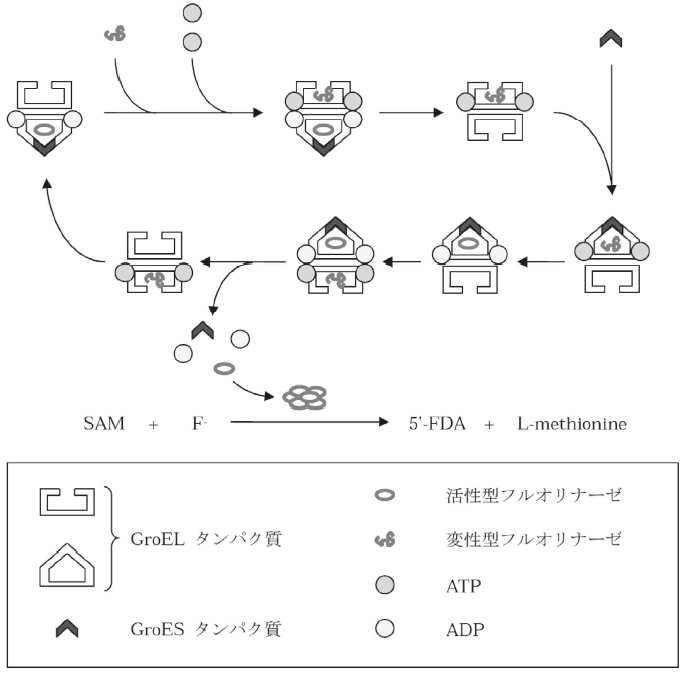
この酵素の問題点として、反応速度論的定数があげられる。回転数や基質との親和性はそれほど高いものではなく、我々の研究室でも組換えのフルオリナーゼタンパク質を大腸菌内で発現して、精製した後、反応速度論的解析を行ったがその反応性は非常に悪いものであった。そこで、熱やその他のストレスにより変性・失活したタンパク質を再生する機構が備わっているシャペロンといわれるタンパク質、その中でもGroE14)タンパク質の導入をフルオリナーゼ組換え系に試みた (図9)。精製したフルオリナーゼを用いて反応速度論的解析を行ったところ、GroEタンパク質の過剰発現系で発現させたフルオリナーゼの方が酵素の回転数において4倍近くの向上が認められたのである15)。この原因ははっきりとは分かっていないが、組換え系のフルオリナーゼは精製を容易にするためにタンパク質のN末端側にヒスチジンタグが付加されていることなどから、翻訳後の自然なフォールディングでは十分な酵素能力が発揮されず、シャペロン内でリフォールディングされることによって、より適切な状態へとタンパク質の立体構造が誘導されているのではないかと推測している。
図9 GroE (GroEL/GroES) タンパク質によるフルオリナーゼの再生サイクル
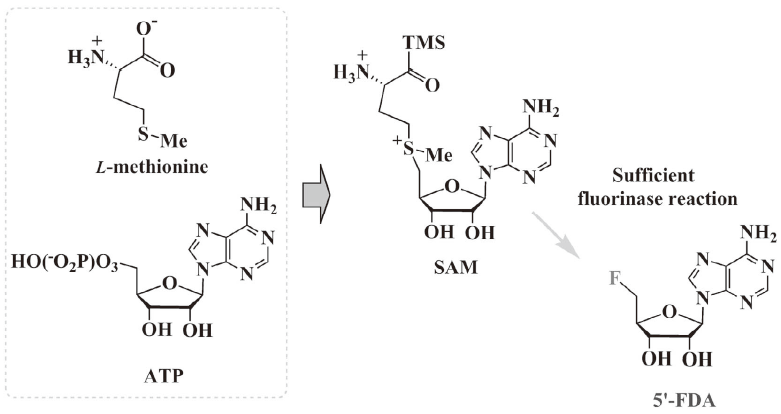
次に我々が改善策として注目したのは基質の供給系である。フルオリナーゼが基質とする化合物はフッ化物イオンとSAMである。SAMは生体内でのメチル化の基質として用いられるため、ほとんど全ての生物の中で合成される化合物である。しかし、フルオリナーゼ用の基質として充分に供給されているわけではない。試験管内でフルオリナーゼ反応を行うには大過剰のSAMを加えて反応する必要がある。SAMが構造上不安定な物質である事に加えて、高価な化合物である事を考えると、SAM合成酵素の共発現が迅速かつ安定的な基質供給を可能にしてくれる事が期待される。この基質供給系の共発現による試験管内フルオリナーゼ反応の促進は、残念ながら現在のところ上手くいっていない。恐らくSAM合成酵素の不安定性によるものと思われているが、幸運なことに生細胞内でのフルオリナーゼ反応の促進にはつながった。すなわち、これまではフルオリナーゼ組換え大腸菌の培養液にフッ化物イオンのみを添加しても生成物であるフッ素化合物 (5'-FDA) は検出できなかったが、SAM合成酵素の共発現によって充分検出が可能な量の生成が可能となった (図10)。
図10 効率的で安定な基質SAMの供給システム
フルオリナーゼはSAMに対しては74µMという高い親和性を示すが、フッ化物イオンに対しては2 mMと30倍近く親和性が低い。我々はフルオリナーゼの完成度が低い原因 (反応性の悪さ) はそこにあるのではないかと考えており、フッ化物イオンに対する親和性の向上が反応の本質的な改善につながるものと考えている。すでに、このタンパク質の立体構造情報が明らかとなり、フッ化物イオンポケットを構成しているアミノ酸残基はほぼ明らかである (図11)。図11 に示すように、フルオリナーゼの反応場は互いに異なるフルオリナーゼのN末端ドメインとC末端ドメインによって挟まれる形で構成されており、N末端ドメイン側のアミノ酸残基によって形成されるフッ化物イオンポケットにフッ化物イオンは収まる。一番コンタクトをとると考えられるのは158番目のセリンであるが、脱溶媒和環境を形成するためには156番目のフェニルアラニンも重要であると推測される。また、SAMのリボース環と水素結合を介すると思われる16番目のアスパラギン酸も158番目のセリン残基であるヒドロキシル基の方向を規定すると思われ、これらのアミノ酸の変換がフッ化物イオンに対する親和性に大きく変化をもたらすことが容易に推測できる。現在我々の研究室では、この推測に従って研究を進めている。酵素が長い年月を掛けて進化してきた賜物であることを考えれば、アミノ酸一置換がもたらす影響は基本的に向上ではなく減衰である。しかし、フッ素化酵素がまだ世の中に多く存在しないものである事を考えると、複数のアミノ酸置換などが面白い効果をもたらす余地があるのではないかと思う。我々もまだ見ぬ完成度の高いフッ化物イオンポケット構造を期待しながらフルオリナーゼの変異体を設計し、進化型フルオリナーゼの構築を試みている。

フルオリナーゼが発見されてからしばらく、その後の反応経路は謎に包まれていたが、2006年にフルオリナーゼをコードするflA 付近の遺伝子が調べられ、次の反応にかかわる酵素が報告された16)。flBと名づけられたこの遺伝子の産物は5'-FDAを脱アデニン化しリン酸化するヌクレオチドホスファターゼの一種であり、5-フルオロ-3-デオキシ-1-リン酸リボース (5-FDRP) を生成する。興味深いことは、flAを挟んで前後に12 kb (11ORF) もフッ素化合物代謝関連遺伝子候補が見つかったにもかかわらず、flB以降の代謝関連遺伝子は一つも見つからないことである。フルオロクラスターと名づけられたこの一連の遺伝子群に含まれていたものは、フッ素化合物に対する耐性を獲得する上で重要となったであろうフルオロアセチル-CoA分解酵素や、フルオリナーゼ反応の阻害剤となるS-アデノシル-L-ホモシステイン (SAH) の分解酵素 (SAHはSAMの脱メチル化合物であり生体内では容易に生じる) だけで、他にORFとして見出されたものは輸送系タンパク質やDNA結合タンパク質 (転写因子候補) のみであった。恐らく、S. cattleyaのゲノム上にまだ他のフルオロクラスターが存在し、最終産物であるモノフルオロ酢酸やモノフルオロトレオニンまでつながる遺伝子がまとまっているのではないかと期待される。flBからの下流反応を効率よくスクリーニングする系が構築できれば、第二のクラスター発見につながるのではないかと考えており、我々もスクリーニング系の構築を目指している。下流代謝経路はフッ素化反応には直接関わらない反応だが、有機フッ素化合物耐性メカニズムや、有機フッ素化合物代謝機構を考える上で非常に重要なヒントを与えてくれるであろう (図12)。これまでにリパーゼのような生体触媒がフッ素化合物を基質とすることが可能である事が示されてきたが、これらは生体にとって本質的なものではなく、フッ素化合物を生体触媒により利用するための核心的な情報にはつながりにくい。
図12 下流代謝経路
フッ素化酵素 (フルオリナーゼ) の概説と我々の研究室での応用化への試みを簡単に紹介してきたが、フルオリナーゼはフッ素のバイオテクノロジーを切り開いていく上での第一歩であると我々は考えている。
同時に、我々は作り出したものを元へ戻す事も考えなければ時代に来ている。有機化学的に、また生物化学的に作り出された有機フッ素化合物を再度フッ化物イオンへと戻すシステムを生物機能により構築することも重要な命題となるであろう。有機フッ素化合物を分解し、脱フッ素化する微生物の探索も我々の研究室のみならず国内外で進んでおり、フッ素資源が生物機能のみで循環できるフッ素化合物循環プロセスの構築が可能となることを期待している。
文献
1) (a)北爪智哉: 化学工業, 57, 6, 437 (2006).
(b)北爪智哉, 渕上寿雄, 沢田英夫, 伊藤敏幸: イオン液体-常識を覆す不思議な塩、コロナ社 (2005).
2) 伊藤敏幸: 現代化学, 432, 3, 28 (2007).
3) Cull, S. G., Holbrey, J. D., Vargas-Mora, V., Seddon, K. R., Lye, G. J.: Biotechnol. Bioeng., 69, 227 (2000).
4) Erbeldinger, M., Mesiano, A., Russell, A. J.: J. Biotechnol. Prog., 16, 1129 (2000).
5) Lau, R. M., van Rantwijk, F., Seddon, K. R., Sheldon, R. A.: Org. lett., 2, 4189 (2000).
6) Kitazume, T.: The 1th International Symposium on Fluorine Chemistry, Durham (UK) (2000).
7) (a)Itoh, T., Akasaki, E., Kudo, K., Shirakami, S.: Chem. Lett., 262 (2001).
(b) Schëter, S. H., Kaftzik, N., Wasserscheid, P., Kragl, U.: Chem. Commun., 425 (2001).
(c) Kim, K-W., Song, B., Choi, M-Y., Kim, M-J.: Org. Lett., 3, 1509 (2001).
8) Matsuda, T., Yamagishi, Y., Koguchi, S., Iwai, N., Kitazume, T.: Tetrahrdron Lett., 47, 4619 (2006).
9) Kitazume, T., Jiang, Z., Kasai, K., Mihara, Y., Suzuki, M.: J. Fluorine Chem., 121, 205 (2003).
10) O'Hagan, D., Harper, D. B.: J. Fluorine Chem., 100, 127 (1999).
11) Paul, E. A., Huang, P. M.: Handbook of Environmental Chemistry, 1, 69 (1980).
12) Dong, C., Huang, F., Deng, H., Schaffrath, C., Spencer, J. B., O'Hagan, D., Naismith, J. H.: Nature, 427, 561 (2004).
13) Sanada, M., Miyano, T., Iwadera, S., Williamson, J. M., Arison, B. H., Smith, J. L., Douglas, A. W., Liesch, J. M., Inamine, E.: J. Antibiotics, 39, 259 (1986).
14) Thomas, J. G., Ayling, A., Baneyx, F.: Appl. Biochem. Biotechnol, 66, 197 (1997).
15) 中島聡, 松下知宏, 岩井伯隆, 北爪智哉: 第30回フッ素化学討論会 (2006).
16) Huang, F., Haydock, S. F., Spiteller, D., Mironenko, T., Li, T-L., O'Hagan, D., Leadlay, P. F., Spencer, J. B.: Chem. & Biol., 13, 475 (2006).