【トピックス】
分析用酵素の工業生産における宿主菌の活用
西矢芳昭、山本和巳、竹嶋誠嗣
東洋紡・バイオケミカル
1.はじめに
遺伝子操作技術が産業面でも一般的な技術となって久しい。酵素の工業生産では、開発の過程で、遺伝子組換えでの大量生産とタンパク質工学技術での酵素機能の更なる改良が定着している。臨床検査やセンサーなどに用いる酵素 (以下、分析用酵素とする) の場合、1980年代後半には商品化に遺伝子操作技術が取り入れられ、更に1990年代前半にはタンパク質工学的手法により改良された酵素が商品となった1)。組換え生産の宿主としては、多くの場合、大腸菌 (Escherichia coli) が利用される。E. coli は宿主として、培養の簡便さ、菌株及びベクターの豊富さ、安全性など多くの利点があり、過去の豊富な応用例を活かすことができる。しかし、E. coliが万能という訳ではない。
E. coli 以外の宿主微生物を検討する動機としては、まずはE. coliでは酵素活性のある形で発現できない場合が挙げられる。酵素のフォールディングや分泌などの構造変化のためのしくみや翻訳後修飾機構がE. coliにない、補酵素の供給や補酵素の酵素への結合がE. coli ではできない、などが理由である。具体的な解決法として、元々の生産菌へのセルフクローニング、若しくは近縁の種を宿主として利用する。この他にも、夾雑酵素の発現レベルが低い菌を宿主として利用すれば酵素精製工程の簡便化が図れる。また、増殖に無関係あるいは増殖阻害要因となる遺伝子を削除した最小ゲノムを有する微生物を利用する、いわゆるミニマムゲノムファクトリーの考え方も広まっており2)、宿主菌としての応用が期待される。
本稿では、目的酵素に相応しい宿主菌を適用することで工業レベルでの酵素生産が可能となった事例として、我々の分析用酵素に対する取組みを紹介する。
2.尿素測定とウレアアミドリアーゼ (UALase)
UALaseは、酵母から抽出、精製することにより得られる酵素で、尿素のATP依存的加水分解を触媒する。実際には、下記の2つの反応を触媒する多機能酵素である3)。
(1) 尿素 + HCO3- + ATP → アロファン酸 + ADP + Pi
(2) アロファン酸 → 2NH4+ + 2HCO3-
(1)の反応を触媒する酵素はウレアカルボキシラーゼ、(2)の反応を触媒する酵素はアロファン酸ハイドロラーゼと、それぞれ別個に定義されている。
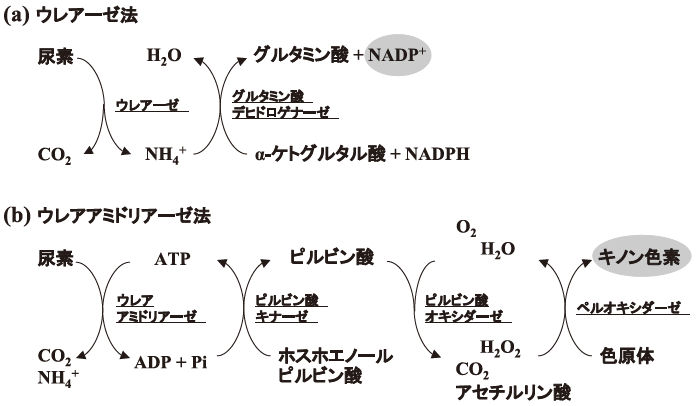
UALaseは、分析用酵素として尿素の測定に利用できる。臨床検査の尿素測定に広く利用されているのは、ウレアーゼを用いた方法である (図1(a))。しかし、この方法はアンモニウムイオンを反応中間体とするため、検体中 (血液,尿) のアンモニウムイオンの影響を受ける。UALaseを用いた方法 (図1(b)) はアンモニウムイオンの影響が無く、測定の正確性に優れている。
図1 尿素測定原理
我々はCandida utilis よりUALaseを見い出し、尿素測定用酵素としての利用を試みた。しかしながら、本酵素の生産性は極めて低く、遺伝子組換え技術による生産性の向上が課題となった。
3.組換え酵母によるUALaseの生産
単離したC. utilis 由来UALase遺伝子は5,490 bpから成り、推定アミノ酸配列は1,830残基とかなり大きい。ホモロジーより、N末端側にアロファン酸ハイドロラーゼが、C末端側にウレアカルボキシラーゼがそれぞれ存在すると分かった4)。しかし、本遺伝子の組換えE. coliでの発現を種々試みたが、酵素は生産できなかった。ウレアカルボキシラーゼはビオチン依存性であり、ビオチンの酵素への結合はホロ酵素合成酵素が触媒するため5) E. coliでは発現しないと考えられた。ホロ酵素合成酵素を新たにクローニングし共発現させるという方法もあるが、我々は、酵母Saccharomyces cerevisiaeでのUALase生産を試みた。
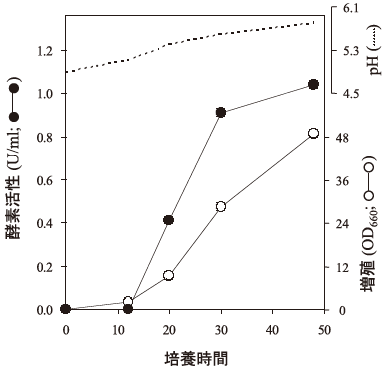
UALase遺伝子と酵母ベクターYep24を基に、UALase発現プラスミドpYECUR2とアロファン酸ハイドロラーゼをコードする部分を欠失させたpYECUR4を構築し、S. cerevisiae IFO10102を形質転換した。組換え酵母を培養し、酵素活性をATPの消失、すなわちウレアカルボキシラーゼ活性で追ったところ、親株であるC. tilisの酵素活性が検出限界 (0.005 U/ml) 以下の極微量に対し1.0 U/ml 以上の活性を示した。図2にIFO10102 (pYECUR2) の典型的な培養経過を示す。また、抗生物質等の薬剤は培地中に添加していないが、プラスミドの脱落は認められず、pYECUR2は宿主中で安定に保持された6)。

4.Serratia liquefaciens 宿主-ベクター系の開発と酵素生産
組換え体での酵素生産の利点のひとつとして、耐熱性酵素をE. coli で生産すれば、熱処理により容易に宿主のタンパク質が除去でき、精製工程が簡素化される。一般に、宿主タンパク質の活性や熱安定性は、その生育温度に依存している。したがって、E. coliより低い温度域で活発に生育し、なおかつE. coli用ベクターを維持できるような宿主菌をスクリーニングすれば、工業生産用に役立つ可能性がある。
このような観点から、我々は酵素の高純度化のひとつの手段として新規な宿主-ベクター系であるS. liquefaciensの系を開発し、N-アセチルノイラミン酸リアーゼ (NALase) の生産に応用した7)。NALaseはN-アセチルノイラミン酸を分解してピルビン酸とN-アセチルマンノースアミンにする酵素で、癌等のマーカーである血清中のシアル酸測定に使用する8)。この酵素の由来はE. coliなのでセルフクローニングにより簡単に生産できる9)が、宿主由来の夾雑タンパク質の除去が難しいという問題を抱えていた。
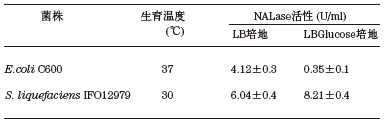
我々は様々なグラム陰性細菌をスクリーニングし、生育温度と好気条件下での増殖、E. coli用ベクターの導入と維持、NALase遺伝子発現などの要因から最終的にS. liquefaciens IFO12979を宿主として選択した。本菌を宿主とした場合のNALase遺伝子の発現は、E. coliを宿主とした時と比較して同等以上であり、培地中のグルコースによるプロモーター抑制はなく構成的に発現した (表1)。
表1 S. liquefaciens宿主-ベクター系による酵素発現
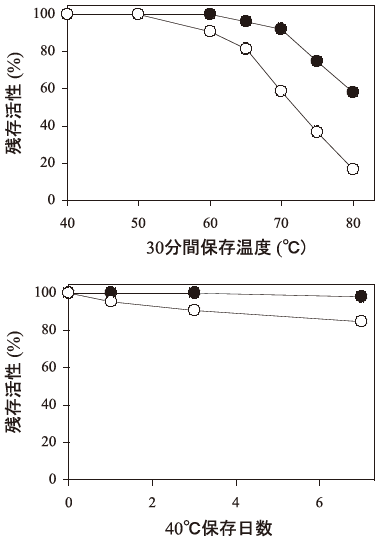
次いで、組換え体からのNALaseの精製を行った。55%硫安塩析、バッファーでの再溶解後60℃・16時間の熱処理を精製工程に加えたところ、精製酵素標品のコンタミ酵素レベルがS. liquefaciens を宿主とした場合では検出限界以下であり、E. coliを宿主とした場合と明らかな純度の差が見られた (表2)10)。これは、S. liquefaciensの生育最適温度が25~30℃と低い (4℃でも生育する) ため、熱処理にて容易にコンタミ酵素を除くことができたからである。また、精製NALaseの酵素特性を比較したところ、分子量、比活性、等電点、速度定数、pH特性などに差は認められなかったが、熱安定性については組換えS. liquefaciens からのNALaseがE. coliのものより約10℃安定であった (図3)。この差については、組換えE. coliのNALaseでは微量の蛋白分解酵素のコンタミが影響を与えているのであろうと推察している。
表2 S. liquefaciens宿主-ベクター系での精製酵素の品質

このように、S. liquefaciensの系は異種タンパク質の高発現と高純度精製に役立つ新たな宿主として応用範囲が広いものと期待している。
5.グルコースセンサーとピロロキノリンキノン依存性グルコース脱水素酵素 (PQQ-GDH)
糖尿病患者は、日本国内で人口の10%を超える状況にある。世界的に見ても、2025年には全世界で三億人にまで達するであろうとWHOでは予測している。糖尿病とは血液中のグルコース濃度が慢性的に高い状態が続く病気で、糖尿病患者はこの血中グルコース濃度を正確に測定し管理しないと、網膜症、腎症、神経障害などの重篤な合併症に見舞われることになる。そこで、糖尿病患者は食事制限やインシュリン注射などの手段によって血中グルコース濃度を調整している。血中グルコース濃度をモニタリングする手段としてグルコースセンサーが使用され、日に数回程度、指先などから採血してグルコース濃度を測定している。
我々は、グルコースセンサーの最適な材料酵素としてAcinetobacter baumanniiが産生するPQQ-GDHを見い出し、開発に着手した。この酵素に着目したのは、PQQを補酵素とする脱水素酵素であるため反応に酸素が関与せず、溶存酸素不足の影響を受けないこと、PQQ-GDHとしては珍しく膜結合型酵素ではなく、ペリプラズムに存在する可溶性酵素であること、さらには酵素触媒としての分子活性が非常に高いことがその理由である11)。
補酵素PQQは1979年に脱水素酵素の第三の補酵素として化学構造が決定されて以来、アルコール、アミンやアルドースを酸化する多くの酵素においてその存在が確認されてきた。PQQを補酵素とする脱水素酵素は、基質の酸化に伴いフェリシアン化カリウムのような人工電子受容体を直接還元でき、反応が不可逆に進むので、化合物の微量・高感度定量に適している12)。
6.PQQ-GDH生産のための宿主-ベクター系の開発
E. coliはPQQの生合成経路を持たないため、活性型 (ホロ型) のPQQ-GDHを取得するには培地中にPQQを添加して培養するか、或いは不活性型 (アポ型) の精製後、PQQを添加してホロ化しなければならない。それ故、工業的に生産するための宿主として使用するとコスト高になることは避けられない。我々は下記のような利点を鑑み、PQQ生産菌を用いる宿主-ベクター系の開発に着手した。
・本来PQQを生産できない大腸菌を宿主としたときと比較し、高価な補酵素であるPQQを外部から添加する必要がないのでホロ酵素の安価な製造が可能になる。
・PQQを外部から添加する場合、PQQはアミン類と結合しやすいので、夾雑物質が多いと酵素以外の化合物等でトラップされやすい。
・酵素が活性を有したまま発現されるので、培養・精製時に酵素生産のモニタリングがしやすい。
・一般に、PQQの結合したホロ酵素はPQQの無いアポ酵素より安定なので、酵素の高純度精製に当たり高い収率が望める。
これまでにAcetobacter13)、Gluconobacter14)、Acinetobacter15)、Pseudomonas16)、Comamonas17) 等においてPQQ依存性酵素の存在が報告されている。我々はこれらの中から、PQQ生産能があり、発現ベクターを入手可能なAcinetobacter属細菌とPseudomonas属細菌を選択した。すなわち、Acinetobacter属細菌用にはpWH126618)を用い、Pseudomonas属細菌用にはpTS113719)を用いて組換え・ホロ型PQQ-GDHの発現ベクターを構築した。また宿主についても、入手可能であった数種類を検討した。
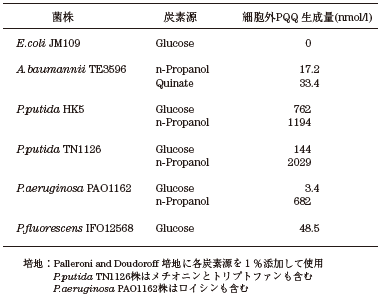
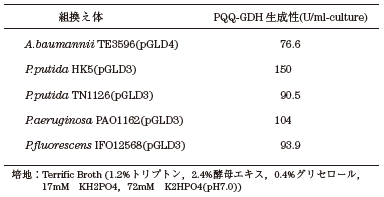
我々はまず宿主自体のPQQ合成能の高さを確認 (表3) すると共に、それらの形質転換体のホロ型PQQ-GDHの生産性を確認した (表4)。その結果、PQQ生産能としてはP. putida TN1126がn-プロパノールを単一炭素源とする培地で最も高かったが、ホロ型PQQ-GDH生産性はP. putida HK5株を宿主とした形質転換体が上回った。このP. putida HK5株のPQQ生産能はP. putida TN1126に次ぐこと、およびその生産能は培地によらず比較的高いことより、以後P. putida HK5株を宿主として選択した。
表3 各宿主のPQQ合成能
表4 ホロ型PQQ-GDHの生産性
7.工業生産に適したPQQ-GDH遺伝子発現系の構築
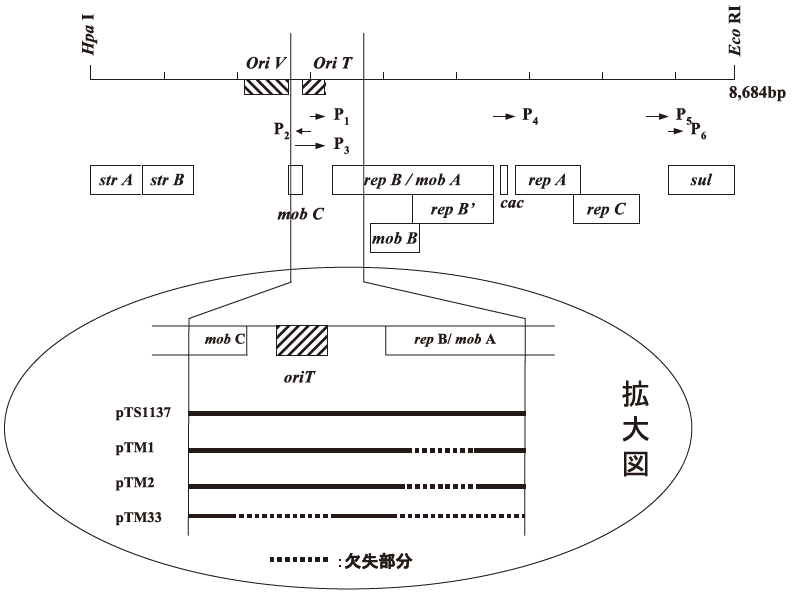
P. putida 用に使用したグラム陰性細菌用ベクターpTS1137は、接合伝達に関与する遺伝子を保持している可能性が考えられた。そこで、その全塩基配列を決定したところ、不和合性P-1群プラスミドと共役して接合能を示す遺伝子群であるmobを保持していることが確認された。そこで実際に接合伝達能を調べてみたところ、供与細胞当たり2.5 × 10-2の頻度で共役接合伝達することが判明した。工業スケールでの生産を想定した場合、より安全性の高いベクターであることが望ましいことから、発現ベクターの改良を実施した。
まず,pTS1137が全長16.5 kbと大きなベクターであることから、接合伝達に関与する遺伝子を含む領域を切り出してpBluescriptにつなぎ換えた。その後、制限酵素サイトを用いた切断、ヌクレアーゼを用いたデリーション、合成オリゴを用いた欠失などの手段を用いてoriT、mobCのN末端部分、mobAのN末端部分を欠失させた (図4)。こうして改変した遺伝子を再度pTS1137に戻した後、接合伝達能の評価を行った。その結果、mobAのN末端部分を欠失させる事によりpTS1137の1/1000にまで接合伝達能が低下することが確認された。更に、oriT とmobCのN末端部分を欠失した変異体 (pTM33) ではpTS1137の1/300,000にまで接合伝達能が低下していることが確認された。

最も接合伝達能の低下していたpTM33にPQQGDH遺伝子を挿入した発現プラスミドpGLD6を構築してP. putida HK5株を形質転換した後、ベクターの改変による組換え・ホロ型PQQ-GDHの生産性ヘの影響を確認した。その結果、改変前に比べてPQQ-GDHの生産性に変化は認められない事から,改変によるプラスミドの安定性やコピー数への影響は少ないと判断した20)。こうして、接合伝達能だけを欠失させた産業上有用な発現ベクターの構築に成功した。今回構築した宿主-ベクター系はPQQ-GDHだけに限らず、PQQ依存性酵素全般に適用可能な、安全な宿主-ベクター系であると考えている。
8.おわりに
微生物の全ゲノム解析は加速度的に進んでおり、現在では、2週間~1ヶ月程度の作業で数種類の微生物ゲノムのドラフトシーケンスが同時に得られるようなオートシーケンサーも販売されている。最近になって、全ゲノム配列情報を基にした宿主微生物自体の遺伝子レベルでの改良も具体化されており、いずれ目的の酵素・タンパク質の生産に合った宿主を自由に選択できる日も来るように思われる。
今回紹介した酵素の高純度化のためのS. liquefaciens 宿主-ベクター系、キノプロテイン生産のためのP. putida宿主-ベクター系は、種々の分析用酵素の生産に使用できるだけでなく、さらなる応用が見込める。例えば、キノプロテイン生産宿主-ベクター系を利用すれば、有用なバイオコンバージョン用PQQ依存性酵素遺伝子をクローニングし、活性のある状態で発現させることが可能である。そして、組換え菌体をそのまま利用して、医薬品中間体等の有機合成や人工高分子の除去に用いることができるであろう。今後、産業面での幅広い応用展開に期待したい。
謝辞
ここで紹介した研究開発は、全て東洋紡績株式会社敦賀バイオ研究所にて遂行したものであり、服部静夫、曽我部敦、戸田篤志をはじめとする多くの人々の貢献の上で成り立っている。また、本研究開発を御指導頂きました山口大学医学部の中澤晶子元教授、農学部の松下一信教授をはじめ多くの先生方に深謝申し上げます。最後に、本稿の執筆の機会を与えて頂きましたダイソー株式会社の鈴木利雄博士に感謝致します。
文献
1) 西矢芳昭: 臨床検査, 46, 853 (2002).
2) 藤尾達郎: キラルテクノロジーの進展 (大橋武久監修), シーエムシー出版, 8 (2006).
3) Roon, R. J., Hanpshire, J., Levenberg, B.: J. Biol. Chem., 247, 7539 (1972).
4) Nishiya, Y., Imanaka, T.: J. Ferment. Bioeng., 75, 245 (1993).
5) Roon, R. J., Levenberg, B.: J. Biol. Chem., 247, 4107 (1972).
6) 西矢芳昭, 戸田篤志, 川村良久: 生物試料分析, 18, 288 (1995).
7) Yamamoto, K., Kawakami, B., Kawamura, Y., Kawai, K.: Anal. Biochem., 246, 171 (1997).
8) Shamberger, R. J.: J. Clin. Chem. Clin. Biochem., 22, 647 (1984).
9) Kawakami, B., Kudo, T., Narahashi, Y., Horikoshi, K.: J. Bacteriol., 167, 404 (1986).
10) 西矢芳昭, 山本和巳, 川村良久, 愛水重典: 日本農芸化学会誌, 75, 857 (2001).
11) Hauge, J. G.: J. Biol. Chem., 239, 3636 (1964).
12) Ameyama, M.: Methods Enzymol., 89, 20 (1982).
13) Cozier, G. E., Giles, I. G., Anthony, C.: Biochem. J., 308, 375 (1995).
14) Matsushita, K., Yakushi, T., Takaki, Y., Toyama, H., Adachi, O.: J. Bacteriol., 177, 6552 (1995).
15) Matsushita, K., Shinagawa, E., Adachi, O., Ameyama, M.: FEMS Microbiol. Lett., 55, 53 (1988).
16) Toyama, H., Fujii, A., Matsushita, K., Shinagawa, E., Ameyama, M., Adachi, O.: J. Bacteriol., 177, 2442 (1995).
17) De Jong, G. A., Geerlof, A., Stoorvogel, J., Jongejan, J. A., de Vries, S., Duine, J. A.: Eur. J. Biochem., 230, 899 (1995).
18) Hunger, M., Schmucker, R., Kishan, V., Hillen, W.: Gene, 87, 45 (1990).
19) 遺伝子組換え実用化技術第4集, サイエンスフォーラム, 73 (1983).
20) 竹嶋誠嗣, 服部静夫, 曽我部敦: 科学と工業, 78, 322 (2004).