【トピックス】
セルラーゼとセルロソームの話 ーバイオエネルギーの展開に向けてー
粟冠和郎
三重大院・生物資源
1.はじめに
木質系バイオマスからのエタノールの生産は我が国においても既に始まっている。木質系にしてもソフトバイオマスにしても、セルロース系バイオマスの分解は、現段階では硫酸処理に頼らざるを得ないのが現状である。濃硫酸処理はセルロースおよびヘミセルロースの両者を単糖にまで分解するので酵素は必要としない。これに対し、希硫酸処理はヘミセルロースのみを分解しセルロースは残すので、セルロースの分解にはその後の酵素処理が必要である。また、次世代技術として、硫酸を使用しないセルロース分解技術が求められている。ここでは、セルラーゼについて、特に嫌気性細菌の生産するセルラーゼ複合体 (セルロソーム) を含めて概説する。
セルロースの生物分解の発見は、1906年のカタツムリ消化管におけるセルロース分解についての報告にまで遡ることが出来るようである。その後多数の微生物起源のセルラーゼについて報告されたが、当時の分析技術が未熟であったため、個々の酵素の基質分解特性等の記載にとどまっていた。また、最も初期の研究で報告されたような動物の消化管などに見つかったセルラーゼが動物由来なのか、あるいは、そこに共生する微生物由来なのかについての議論に対する結論は1990年代まで持ち越された。しかし、1980年代初頭以降、組換えDNA技術やタンパク質発現・精製技術の発展・普及により純粋なタンパク質の取得が容易になり、同時にX線結晶構造解析技術やNMRによる構造解析技術の進歩ともあわせ、立体構造の解析は飛躍的に進んだ。また、部位特異的変異法を用いた実験により、触媒残基の同定が行われ、触媒反応機構の詳細が明らかにされている。近年、化石燃料の大量消費による地球温暖化への危機感から、バイオマスの分解と燃料化の研究に研究費が投入され、多くのセルロース分解性微生物のゲノム解析が行われているほか、強力なセルラーゼを取得するため新規セルロース分解性微生物の単離や部位特異的変異によるセルラーゼ活性の強化も行われている。
2.セルラーゼの分類
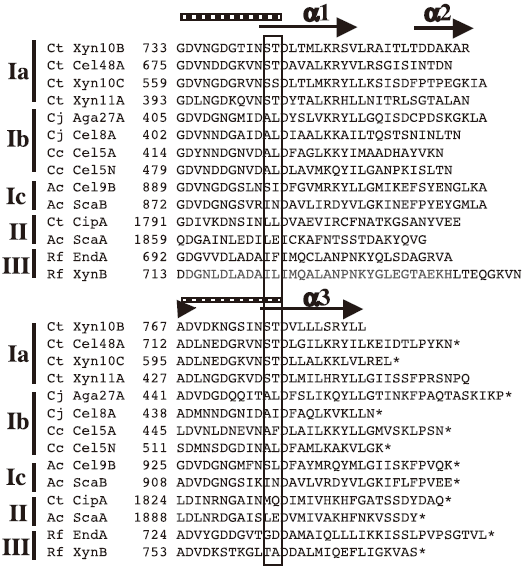
「セルラーゼ」という言葉はセルロースを分解する酵素の総称として用いられているが、Enzyme nomenclature database (http://kr.expasy.org/enzyme/) をみると、セルラーゼは酵素番号EC 3.2.1.4の酵素であり、その別名は「エンドグルカナーゼ」である。エンドグルカナーゼは、セルロース繊維の内部をランダムに切断する。セルロースを分解する別のタイプの酵素に、「セロビオヒドロラーゼ」 (EC 3.2.1.91) がある。この酵素の公式名はセルロース1,4-β-セロビオシダーゼであり、セルロース繊維の末端からセロビオース単位で分解する酵素である。多くのセルラーゼは複数のドメイン (モジュール) から構成されておりモジュラー酵素と呼ばれる。モジュラー酵素の例として、Trichoderma reesei (糸状菌) とClostridium thermocellum (嫌気性細菌) 由来のセルラーゼの幾つかのモジュラー構造を模式的に示す (図1)。触媒作用を司る触媒ドメイン (CD) の他、基質へ結合するための糖質結合モジュール (CBM) はほとんどのセルラーゼに存在する。セルラーゼを含む糖質分解酵素の触媒サブユニットは、アミノ酸配列の相同性に基づいてHenrissatらにより112のファミリー (2008年3月現在) に分類されている (CAZy database: http://www.cazy.org/)。CBMについても同様にアミノ酸配列の相同性に基づいてファミリー分類されている (現在51ファミリー)。強力なセルロース分解性微生物は全て、多数のセルラーゼを生産し、それらの相乗作用により結晶性セルロース分解する。好気性の糸状菌や細菌由来の酵素は複合体を形成することはなく、それぞれ独立した酵素として基質を攻撃する。一方、多くのセルロース分解性嫌気性細菌は、多数の酵素からなる複合体 (セルロソーム) を形成することにより強いセルロース分解能を獲得していることが知られている。

3.セルラーゼにおける相乗作用
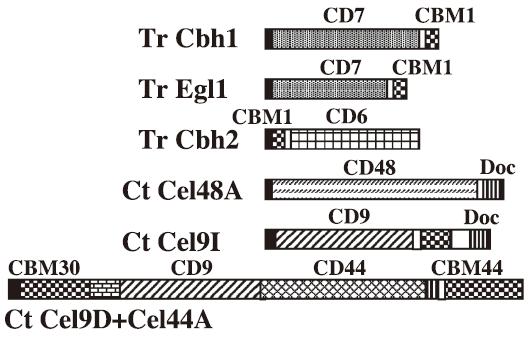
1950年にReeseらは、セルロースの生分解機構としてC1-Cx説を提唱した。その後、エンドグルカナーゼがセルロースの非結晶領域に作用し、その後セロビオヒドロラーゼが結晶性の高い領域を基質の末端側から順次切断するモデルに変化していった (図2)1)。エンドタイプの作用様式を示すエンドグルカナーゼとエキソタイプの作用様式を示すセロビオヒドロラーゼの間の相乗効果については、様々な組み合わせで報告されている。また、エンドグルカナーゼ同士でも相乗作用が見られることがあるが、これは、可溶性の基質や非結晶性の基質に対しては類似の酵素特性を示す酵素であっても、結晶性セルロースに対しての作用様式が両者の間で異なっていることを示しているように思われる。相乗効果の程度はDS (Degree of Synergism) で表される。2種類の酵素についてそれぞれ単独での酵素活性を測定し、2種類の酵素を混合したときに予想される酵素活性を単純に加算して求める。2種類の酵素を混合して実際に酵素活性を測定し、計算値に対する比をDSとする。相乗作用がない場合にはDSは1であり、相乗作用が大きいとDS値は大きくなる。多くの場合、DS値は1~5の範囲に収まるが、大きいものでは5を超える場合もある。相乗効果は2つの異なる酵素間のみでなく、人為的に切り離した触媒ドメインとCBMの間にも見られる。例えば、Cellulomonas fimiのエンドグルカナーゼCenAの触媒ドメインとCBMをそれぞれ単独で発現させ、酵素活性を測定したところ、CBMのみでは活性はないが、触媒ドメインと混合すると、触媒ドメインの活性を約2倍に高めた1)。さらに、触媒ドメインとCBMを混合したときの酵素活性よりも触媒ドメインとCBMが連結した酵素 (CenAそのもの) の活性の方が約2倍高いことから、分子内相乗効果があると考えられた。分子内相乗効果は、2つの異なる酵素を人為的に連結した場合にも見られる。すなわち、Clostridium stercorariumのセルラーゼCelYとCelZを連結した酵素の活性は、両酵素を混合したときの活性よりも高かった2)。一般にセルラーゼは、触媒ドメインとCBMからなるが、触媒ドメインを2つ持つ酵素も存在する。これらの酵素においては分子内相乗効果が働き、特に強い活性が得られると予想される。嫌気性細菌の形成するセルロソームは、多数の酵素からなる複合体であるが、酵素が密集して存在する点に於いて、分子内相乗効果と同様の効果が予想される。また、一つのセルロソームに含まれるセルラーゼの数は多いため、相乗効果の強さもそれに比して大きいものと思われる。米国において、Novozymes 社はNREL (National Renewable Energy Laboratory) との共同研究で希硫酸処理処理コーンストーバーの酵素糖化の研究を行ったが、セルラーゼ開発においてはTrichoderma reeseiのセルラーゼ成分の組み合わせを変え、相乗効果の高い組み合わせを選択することが重要であることが示されている3)。酵素間の相乗作用ばかりでなく、セルロース分解システム間の相乗作用も考えられ、古い研究であるが、既存のセルラーゼ (天野T-AP) との相乗効果を示す株がAspergillus aculeatusとして単離され、そのセルロース分解システムについての研究が行われている4)。ただし、実際に相乗的に働く成分については同定されていない。
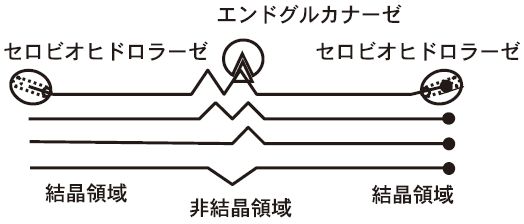
図2 エンドグルカナーゼとセロビオヒドロラーゼによるセルロースの分解のモデル
4.セルラーゼ以外の糖質分解酵素
植物細胞壁がセルロースおよびリグニンの他、ヘミセルロースやペクチン質を含んでいるので、バイオマス利用の観点から、セルラーゼ以外の分解酵素 (加水分解酵素のほか脱離酵素もある) の研究も重要である。セルロース分解性微生物は例外なく、様々なヘミセルラーゼを分泌生産する。例えば、C. thermocellumは糖質の資化性の範囲が狭く、セルロースおよびβ-1,3-1,4-グルカンとその分解物以外の糖を利用できないが、キシラナーゼやマンナナーゼなどがセルロソームの主要成分として存在することが証明されている。さらに、ゲノム・プロテオーム解析の結果、セルロソーム形成に関与するドックリンを持つ多糖リアーゼや糖質エステラーゼ、さらにプロテアーゼなどが存在することが示された5)。ゲノム解析は、新規酵素などを探索するのに極めて有効な手段であるが、アミノ酸配列の相同性からだけでは酵素特性の情報は得られない。C. thermocellumのCelJ (Cel9D+Cel44A) はファミリー9と44の2種の異なる触媒ドメインを持つ酵素である (図1)6)。ファミリー44の触媒ドメインは、セルロースの他、キシランやリケナンを分解することは知られていたが、最近になってキシログルカンに対しても活性を持つことが示された7)。また、C. thermocellumのゲノムには機能不明のドメインにドックリンが結合したタンパク質をコードする遺伝子が多数存在することが見出されている。
5.モジュラー酵素と各種ドメイン (モジュール) の働き
既に述べたように、セルラーゼは触媒ドメインとCBMからなるのが一般的である。現在112の糖質分解酵素ファミリーが存在するが、セルラーゼ活性に関連するドメインは出尽くした感があり、2002年にファミリー74のエンドグルカナーゼが報告されて以来、新規ファミリーは報告されていない。前項でも述べたが、同じファミリーに属していてもその機能は必ずしも同じではない。例えば、糖質分解酵素ファミリーの5にはセルラーゼの他、キトサナーゼ、マンナナーゼ、リケナーゼ、キシラナーゼなど様々な酵素が含まれる。CBMについては、1991年に糸状菌と細菌のセルラーゼに存在する2種類の異なるセルロース結合ドメインとして分類されたのが始まりであるが、こちらも分類の対象が糖質全般に結合するドメインに広げられた。現在、CBMのファミリー数は51に達しており、その数はさらに増加すると思われる。一般にモジュラー酵素中のそれぞれのドメインは独立して働くと考えられ、実際それぞれを単独で発現させても、酵素活性や糖質への結合能は保たれることが多い。しかし、CBMを切除すると触媒ドメインの酵素活性が消失する例が報告されている。このような例では、アミノ酸配列上では2つの異なるドメインとして認識されるが、機能的には一つのドメインとして働いているように思われる。
C. stercorariumのXyn10BはN末端側から2つのファミリー22のCBM (CBM22)、ファミリー10触媒ドメイン、ファミリー9のCBM (CBM9)、2つのSLH (Surface Layer Homology) ドメインからなる酵素である (図3A)。触媒ドメインだけを発現させると他のファミリー10触媒ドメイン酵素と同様にキシラナーゼ活性を示し、β-1,3-1,4-グルカナーゼ活性はほとんど見られない。しかし、この触媒ドメインをファミリー22のCBMと連結した形で発現させるとキシラナーゼ活性よりβ-1,3-1,4- グルカナーゼ活性の方が高く、基質に対する親和性もβ-1,3-1,4-グルカンに対して高い (図3BとC)8)。この結果は、あるドメインを単独で発現させた場合に、本来の機能を示さないという危険性を示唆している。Xyn10Bの場合、CBM22の他にCBM9が存在する。したがって、CBM9の存在が、CBM22の効果を増強または減少させる可能性が考えられたが、実際にはCBM9はβ-1,3-1,4-グルカナーゼ活性には大きな影響を与えないことが分かった9)。C. thermocellum CelJは、ファミリー9と44の2つの触媒ドメイン持つことは既に述べたが、ファミリー9の触媒ドメインの前にはCBM3が、ファミリー44の触媒ドメインの後方にはドックリンを挟んでCBM44が存在する。これまでCBM3とファミリー9の触媒ドメインとの関係、およびCBM44とファミリー44の触媒ドメインとの関係のみが調べられているが、モジュラー酵素中では必ずしも一次配列上で隣接するドメインのみが影響を与えるとは限らないように思われる。しかし、モジュラー酵素における隣接していないドメイン間の相互の影響については全く研究されておらず、今後の課題である。
図3 C. stercorarium Xyn10B とその誘導体のドメイン構成の
模式図とキシランおよびβ-1,3-1,4-グルカンに対する酵素活性
6.セルロソームとミニセルロソーム
セルロソームとは、強力なセルロース分解力を持つ嫌気性細菌や嫌気性糸状菌が細胞外に分泌形成するセルラーゼ複合体である10,11)。代表的なセルロソーム生産性Clostridium属細菌として、C. thermocellum、C. cellulolyticum、C. cellulovorans、C. josuiがあり、その他の細菌としてAcetivibrio cellulolyticus、 Bacteroides cellulosolvens、Ruminococcus flavefaciensなどが知られている。セルロソームの中にはセルラーゼの他キシラナーゼやマンナナーゼなどのヘミセルラーゼ類も含まれる。セルロソーム形成の基本は、触媒活性のない骨格タンパク質中に繰り返し配列として存在するコヘシンドメインと触媒サブユニット中のドックリンの特異的結合である。図4にC. thermocellumのセルロソームのモデルを示した。骨格タンパク質は、複数のタイプⅠコヘシンとCBMのほか、タイプⅡドックリンを含むため、タイプⅡコヘシンを持つ細胞表層タンパク質と結合することによりセルロソーム全体が細胞表層に固定化される。
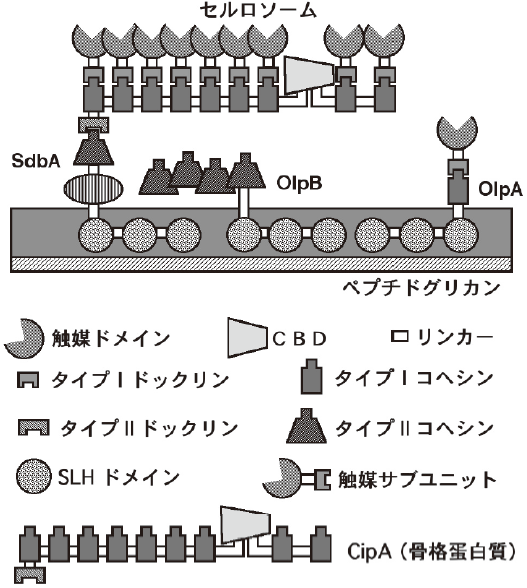
図4 C. thermocellumのセルロソームのモデル
C. thermocellumの骨格タンパク質のコヘシンは約170アミノ酸からなるドメインであり、1つの分子中で9回繰り返している。したがって、1つの骨格タンパク質には9つの触媒サブユニットが結合しうる。各コヘシンのアミノ酸配列の保存性は極めて高く、最も相同性の低い組み合わせでも60%以上あり、最も高い組み合わせでは100%であり完全に一致している。ドックリンは約22アミノ酸の繰り返しからなる小さなドメインである (図5)。コヘシンとドックリンの間の結合は親和性が高く、解離定数KDは10-10のレベルである。また、コヘシンとドックリンの間の結合には特異性があり、C. thermocellumのタイプⅠのコヘシンはタイプⅠのドックリンのみに結合し、タイプⅡのドックリンとは結合しない。細菌種による特異性もあり、C. thermocellumのコヘシンはC. josuiのドックリンとは結合せず、逆にC. josuiのコヘシンはC. thermocellumのドックリンとは結合しない12)。タンパク質間の特異的な結合は、立体構造の違いによるものと考えられるが、C. thermocellumのタイプⅠ同士およびタイプⅡ同士のコヘシン-ドックリン複合体の結晶構造が報告されている13,14)。いずれも、コヘシンとドックリンを同じ宿主内で同時に発現させて複合体を形成させ、複合体として精製した後に結晶化することにより良質の結晶が得られた。

C. thermocellumのゲノム解析が行われ、少なくとも71のドックリンを含むタンパク質の遺伝子が同定された5)。一方、セルロソーム中に存在するタンパク質についてnano-LC-ESI-MSにより解析された15)。アビセルで生育した時のセルロソームには35種類のタンパク質が、セロビオースを炭素源として生育した時のセルロソームには34種類のタンパク質が同定され、そのうちの28は共通であった。これらのタンパク質の存在比には差があるが、セルロソームが極めて多様な成分から出来ていることは明らかである。また、炭素源により、発現するタンパク質の種類や存在比に変化があることがわかったが、セルロソーム成分の遺伝子発現制御機構については全く分かっていない。
結晶性セルロースに対する糸状菌のセルラーゼと嫌気性細菌セルロソームの分解力の比較については、セルロソーム研究の初期の論文に記載がある16)。それによると、C. thermocellum ATCC27405株とT. reesei QM9414株の培養液あたりのコットンやアビセルに対する分解力は同程度であり、この時の培養液中のタンパク質量は、それぞれ0.2 mg/mlと9.5 mg/mlであったことから、比活性としては、セルロソームの方が高いといえる。C. thermocellumから、多くのセルラーゼ遺伝子が単離され、大腸菌で発現された酵素の性質についても多数報告されているが、いずれの酵素も単独では活性は弱いため、複合体形成によりセルラーゼ活性が相乗的に高められると予想されていた。実際に、大腸菌で発現させたC. thermocellumの骨格タンパク質とエンドグルカナーゼCelDを混合することにより、アビセル分解活性は少なくとも10倍増強されると報告された17)。
前述したように、コヘシンとドックリン間の結合には種特異性がある。したがって、特異性の異なるコヘシンをタンデムに連結してキメラ骨格タンパク質を作れば、それに対応するドックリンを持つ酵素を、キメラ骨格タンパク質上に任意の順で並べることが出来る。この原理を利用してキメラミニセルロソームが構築された18)。図6に、2種類の異なるセルラーゼからなるミニセルロソームの例を示した。キメラ骨格タンパク質としてCBMのあるものとないものを用いた。2種類のセルラーゼを単に混合した時に比べ、CBMのないキメラ骨格タンパク質を用いて複合体化したとき、活性は約2倍に上昇した。この効果は、2つの酵素が近接することによる相乗効果 (近接効果) であると考えられる。CBMのついたキメラ骨格タンパク質を用いると、さらに2倍の活性増強効果がみられ、これはセルロソームにおけるCBMの重要性を示している。さらに、わらなどの複合基質の分解のためには、ミニセルロソームにキシラナーゼを加えることが効果的であることも見いだされている。人工セルロソームの手法を用いれば本来セルロソームを形成しないセルラーゼをセルロソーム成分として取り込むことが出来る。まだ研究例は少ないが、このような試みについても報告されている19)。
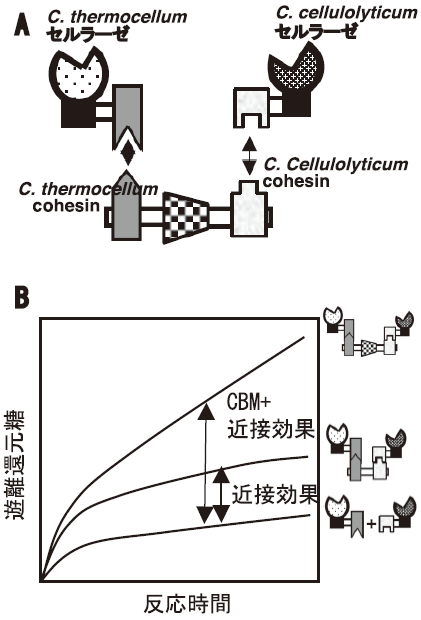
図6 キメラ骨格タンパク質を中核とする人工セルロソームの模式図
(A) と反応速度のイメージ (B) (文献19 より改変)
7.おわりに
以上のように、セルロース分解は多数の特性の異なる酵素の共同作業により行われ、セルラーゼ間の相乗効果がセルロースの効率的分解には重要である。2つの独立した酵素が1つの分子に連結されることにより分子内相乗効果が現れることから、セルロソームは多数の酵素の相乗効果を統合することにより極めて強い分解活性を得ていると予想される。自然界においてセルロースは、微生物にとって栄養源であると同時に棲家でもあるので、速やかに分解することだけが重要なのではないとも考えられる。そう考えると、自然界のセルラーゼやセルロース分解系が、最大の分解力を発揮するように進化していない可能性もあるように思われる。より強力なセルロース分解系の構築は個々のセルラーゼの強化とそれらの組み合わせ、さらにセルロソーム化により達成されると考えている。
文献
1) Din, N., Damude, H. G., Gilkes, N. R., Miller Jr R. C., Warren, R. A. J., Kilburn, D. G.: Proc. Natl. Acad. Sci. USA, 91, 11383 (1994).
2) Riedel, K., Bronnenmeier, K.: Mol. Microbiol., 28, 767 (1998).
3) 科学技術振興機構 研究開発戦略センター 井上グループ: G-Tecレポート 第三世代バイオマス技術の日米欧研究開発 (2006).
4) 村尾澤尾, 荒井基夫: セルラーゼ, 講談社 (1987).
5) Zverlov, V. V., Kellermann, J., Schwarz, W. H.: Proteomics, 5, 3646 (2005).
6) Ahsan, M. M., Kimura, T., Karita, S., Sakka, K., Ohmiya, K.: J. Bacteriol., 178, 5732 (1996).
7) Najmudin, S., Guerreiro, C. I. P. D., Carvalho, A. L., Prates, J. A. M., Correia, M. A. S., Alves, V. D., Ferreira, L. M. A., Romao, M. J., Gilbert, H. J., Bolam, D. N., Fontes, C. M. G. A.: J. Biol. Chem., 281, 8815 (2006).
8) Araki, R., Ali, M. K., Sakka, M., Kimura, T., Sakka, K., Ohmiya, K.: FEBS Lett., 561, 155 (2004).
9) Zhao, G., Ali, E., Araki, R., Sakka, M., Kimura, T., Sakka, K.: Biosci. Biotechnol. Biochem., 69, 1562 (2005).
10) Gilbert, H. J.: Mol. Microbiol., 63, 1568 (2007).
11) Bayer, E. A., Lamed, R., Himmel, M. E.: Curr. Opinion Biotechnol., 18, 237, (2007).
12) Jindou, S., Soda, A., Karita, S., Kajino, T., Beguin, P., Wu, J. H. D., Inagaki, M., Kimura, T., Sakka, K., Ohmiya, K.: J. Biol. Chem., 279, 9867 (2004).
13) Adams, J. J., Pal, G., Jia, Z., Smith, S. P.: Proc. Natl. Acd. Sci. USA, 103, 305 (2006).
14) Carvalho, A. L., Dias, F. M. V., Nagy, T., Prates, J. A. M., Proctor, M. R., Smith, N., Bayer, E. A., Davies, G. J., Ferreira, L. M. A., Romao, M. J., Fontes, C. M. G. A., Gilbert, H. H.: Proc. Natl. Acd. Sci. USA, 104, 3089 (2007).
15) Gold, N. D., Martin, V. J. J.: J. Bacteriol., 189, 6787 (2007).
16) Johnson, E. A., Sakajoh, S., Halliwell, G., Madia, A., Demain, A. L.: Appl. Environ. Microbiol., 43, 1125, (1982).
17) Garcia-campayo, V., Beguin, P.: J. Biotechnol., 57, 39 (1997).
18) Fierobe, H.-P., Mechaly, F. M., Bélaïch, A., Rincon, M. T., Pagés, S., Lamed, R., Tardif, C., Bélaïch, J.-P., Bayer, E. A.: J. Biol. Chem., 280, 16325 (2005).
19) Mingardon, F., Chanal, A., Lopez-Contreras, A. M., Dray, C., Bayer, E. A., Fierobe, H.-P.: Appl. Environ. Microbiol., 73, 3822 (2007).