【トピックス】
フェノール性脂質の生合成に関わる新規な脂肪酸合成酵素
宮永顕正、鮒 信学、堀之内末治
東大院・農
1.はじめに
脂肪酸は炭化水素鎖 (アルキル鎖) にカルボキシル基が一つ結合した物質であり、単純な構造をしているが、その機能は多様である。例えば、脂肪酸は細胞膜の構成成分であり、細胞を保護する。また、脂肪酸は多くの生物においてエネルギー貯蔵物質として蓄えられ、必要に応じ好気的に代謝されエネルギーが取り出される。そして、脂肪酸はジアシルグリセロールなどのセカンドメッセンジャーの構成物質でもあり、生体内における情報伝達にも関わっている。以上のように脂肪酸は生物にとって必須な物質であり、その合成反応を触媒する脂肪酸合成酵素 (FAS) はほぼ全ての生物に存在する。我々は、グラム陰性の窒素固定細菌Azotobacter vinelandiiにおいて、休眠細胞の膜構成成分であるフェノール性脂質の生合成に関わる新規なFASを発見した。
2.脂肪酸合成酵素
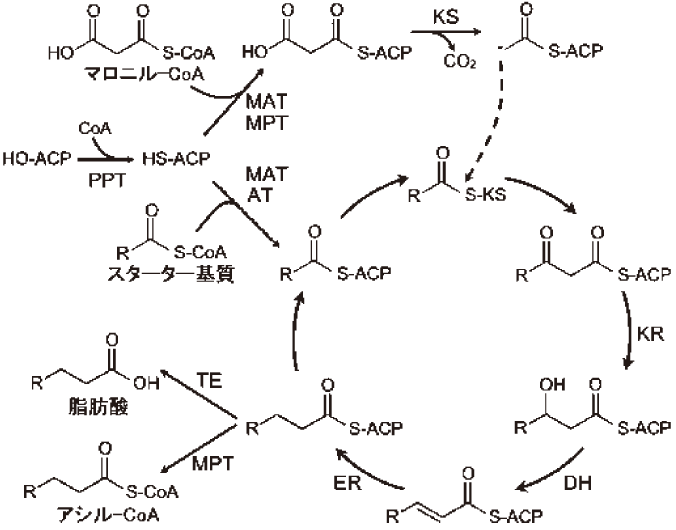
FASはアシル-CoAにマロニル-CoAを縮合し、還元反応を行うことで脂肪酸の合成を触媒する1,2)。脂肪酸の合成経路を図1に示す。まず、アシルトランスフェラーゼ (ATまたはMAT) により、アセチル-CoA等のアシル-CoA (スターター基質) からアシル基がアシルキャリアープロテイン (ACP) のホスホパンテニル基に転移される。このホスホパンテニル基は、ホスホパンテニルトランスフェラーゼ (PPT) がACPを修飾することにより導入される。次に、ケトシンターゼ (KS) の働きにより、アシル基とマロニル-CoA (伸張鎖基質) が縮合され、鎖長が2炭素分伸張する。その後、還元酵素群 (KR、DH、ER) の働きにより、ケト基がメチレン基に還元される。以上の反応サイクルが繰り返されることで脂肪酸が生成する。I型FASは以上の反応ドメインが1または2本のポリペプチド鎖上にコードされ、多機能酵素体を形成する。II型FASは各ドメインが個々のポリペプチド鎖にコードされている。一般に、II型FASは植物、細菌に存在する。I型FASは主に動物、カビ、酵母に存在するが、そのドメイン構成から動物型とカビ・酵母型の2種類に分類できる。これらFASの生成物の放出機構は多様である。II型FASの場合、脂肪酸はACPとのチオエステル体で放出される。一方、I型FASの場合、動物型の場合はチオエステラーゼ (TE) ドメインにより遊離脂肪酸が生成され、カビ・酵母型の場合はマロニル・パルミトイルトランスフェラーゼ (MPT) ドメインによりアシル基がCoAに受け渡され、アシル-CoAが生成される。
図1 脂肪酸合成反応
3.ポリケタイド合成酵素
ポリケタイド合成酵素 (PKS) の触媒機構はFASのそれと非常に似ている3)。しかし、PKSの場合、伸長反応で生じたケト基が還元や脱水を受けない場合があり、結果、脂肪酸ではなくポリケタイドを与える。III型PKSはKSのダイマーで構成され、縮合、環化、芳香化の反応を触媒し、芳香族ポリケタイドを与える。
4.Azotobacter vinelandiiにおけるフェノール性脂質生合成
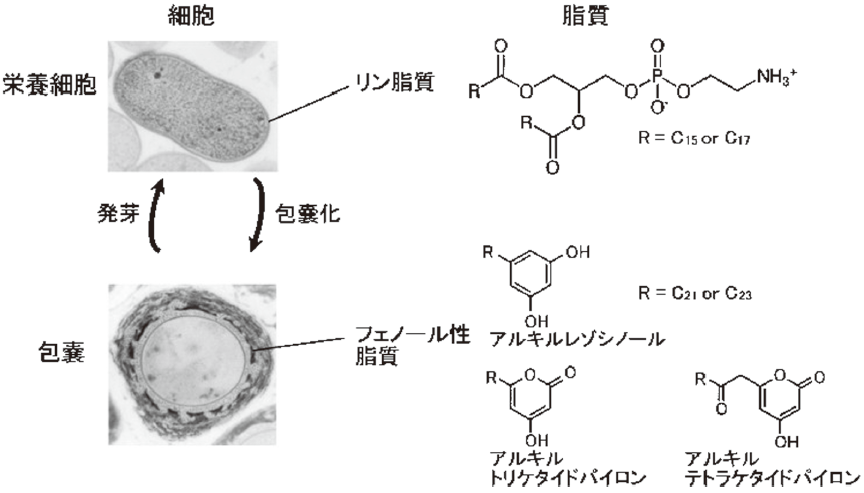
A. vinelandiiはグラム陰性の窒素固定細菌であり、土壌中で好気的に窒素固定を行う。通常、栄養細胞の状態で存在するが、栄養飢餓など生育に不利な状態になると、休眠細胞である包嚢を形成する4) (図2)。包嚢の細胞質は包嚢膜で覆われており、乾燥に高い耐久性を持つ。包嚢膜は主にアルキルレゾシノール及びアルキルパイロンというフェノール性脂質で構成されている5)。フェノール性脂質は水酸基を持つ芳香環部位と疎水的な長鎖アルキル鎖部位を持ち、両親媒性を示す。このフェノール性脂質の性質が膜の安定性に寄与し、乾燥に対する耐久性を与えている6)。栄養細胞の膜を構成するリン脂質の炭素鎖長は16~18であるが、フェノール性脂質の炭素鎖長は22~24と長い。そのため、II型FASにより合成されるリン脂質の脂肪酸の生合成経路と、フェノール性脂質のそれは異なると考えられる。
図2 Azotobacter vinelandiiの2つの細胞形態とその膜構成成分
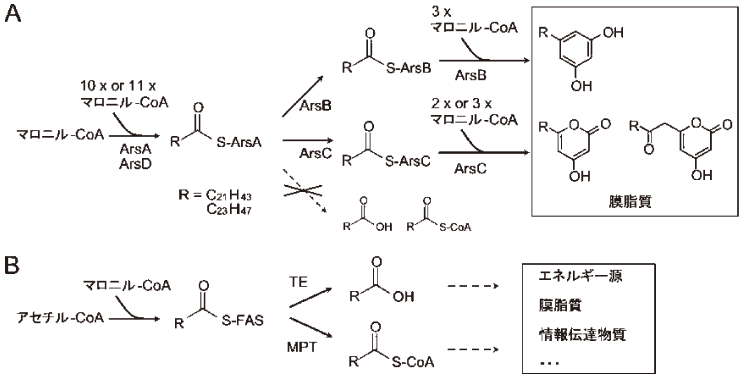
フェノール性脂質の生合成経路は長らく不明であったが、最近、筆者らはIII型PKSであるarsBとarsCを含むarsオペロン (図3) がその生合成を行うことを明らかにした7)。ArsBは長鎖アシル-CoAにマロニル-CoAを3分子縮合しアルキルレゾシノールを、ArsCは長鎖アシル-CoAにマロニル-CoAを2分子または3分子縮合しアルキルパイロンをそれぞれ合成する。また、arsオペロンの破壊株はフェノール性脂質を生成せず、A. vinelandii においてarsオペロンがフェノール性脂質の生合成に必須であることが示された。また、破壊株の包嚢膜の形成能が損なわれたことから、フェノール性脂質が包嚢膜の形成に必須であることが分かった。
以上のように、ArsBおよびArsCがフェノール性脂質の芳香環部位の生合成を司るが、その長鎖アルキル鎖部分の生合成については不明であった。arsオペロン内にはarsBとarsCの他にarsAとarsDが存在しており、これらがI型FASと相同であることから、アルキル鎖部位の合成反応を触媒すると考えられる。そこで、フェノール性脂質の生合成経路の全貌を明らかにするために、ArsAとArsDの機能解析を行った8)。
図3 arsオペロンとその構成遺伝子
5.ArsAとArsDの新規なドメイン構造
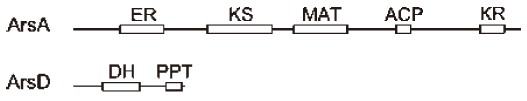
ArsAは2,503、ArsDは636アミノ酸からなるタンパク質である。ArsAとArsDのドメイン構成は既知I型FASのものとは明らかに異なっていた8)。ArsAのドメインはER-KS-MAT-ACP-KRの順番に配置され、ArsDのドメインはDHPPTの順番に配置されていた (図4)。以上から、ArsADはこれまで報告例のない新規なI型FASである可能性が示唆された。また、ArsADの配列中には動物型やカビ・酵母型のような生成物をACPから切り離すドメインであるTE及びMPTドメインがない。arsオペロン内にArsB及びArsCというIII型PKSが存在することから、ArsADは脂肪酸を放出せず、III型PKSに基質として直接受け渡す可能性が考えられた。
図4 ArsA及びArsDのドメイン構造
6.ArsABCDを用いたフェノール性脂質生合成の再構築
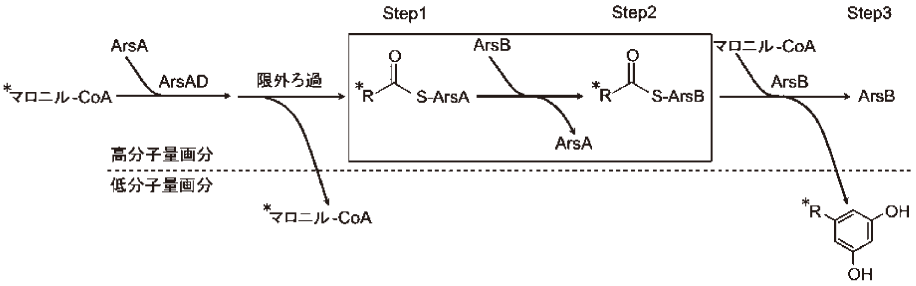
まず、ArsAとArsDの大腸菌組換え酵素を調製し、マロニル-CoAと反応させた8)。しかし、反応生成物は検出できなかった。そこで、アルカリによる加水分解により生成物をArsADから解離させたところ、生成物が確認された。この生成物は、炭素鎖長22、24、26の脂肪酸であった。一般的にFASはアセチル-CoAをスターター基質とするが、ArsADはアセチル-CoAをスターター基質としては取り込まず、マロニル-CoAのみで反応が進行したことから、スターター基質として取り込まれたマロニル基は脱炭酸を受けるのだろう。また、反応溶液を限外ろ過に供し、高分子量画分と低分子量画分に分けたところ、生成物は高分子量画分のアルカリ加水分解物にのみ存在した。以上から、生成物はタンパク質に、おそらくArsAのACPドメインとチオエステル結合していると考えられた。
次に、ArsABCDの各組換え酵素を用い、in vitro反応におけるフェノール性脂質生合成の再構築を試みた8)。ArsAとArsBとArsDをマロニル-CoAと反応させると、アルキルレゾシノールが生成した。ArsAとArsCとArsDをマロニル-CoAと反応させると、トリケタイドパイロンとテトラケタイドパイロンが生成した。以上から、フェノール性脂質の合成にはArsABCDが必要かつ十分であることが判明した。
7.ArsAからIII型PKSへの脂肪酸基質の受け渡し
上記のように、ArsADは合成した脂肪酸を放出しないが、ArsBまたはArsCと共に反応させるとフェノール性脂質が合成される。このことから、ArsBやArsCはArsADに結合した脂肪酸を直接基質としている可能性がある。実際に、カビのアフラトキシン生合成に関わるFASや粘菌の分化因子生合成に関わるFASもPKSへの生成物の受け渡しを行っていると予想されている9,10)。ArsADからIII型PKSへの基質の受け渡しが実際に起こるのかを確認するため、14Cラベルのマロニル-CoAを用い、放射能を指標に反応を追跡した8)。ArsA、ArsDと14Cマロニル-CoAを反応した後、限外ろ過を行い、未反応の14Cマロニル-CoA等の低分子化合物を除去し、そこにArsB、そしてラベル化していないマロニル-CoAを加えて反応を行った。各反応段階においてSDS-PAGEとTLCのオートラジオグラフを行った。ArsA、ArsDと14Cマロニル-CoAの反応直後は放射能がArsAから検出されたことから、ArsAのACPドメインにラベル化された脂肪酸が結合していると考えられる (図5 Step1)。この反応液にArsBを添加すると、ArsAの放射能が弱まり、14CラベルがArsBに移った (図5 Step2)。さらに、この反応液にラベル化されていないマロニル-CoAを添加すると、放射能がArsBから消え、14Cラベルされたアルキルレゾシノールが生成した (図5 Step3)。ArsCについても同様の実験を行ったところ、ArsAにあった14Cラベルが、ArsCを加えるとArsCに移り、さらにマロニル-CoAを加えると、14Cラベルされたアルキルパイロンが生成した。

以上から、ArsABCDによるフェノール脂質生合成の全貌が明らかとなった (図6A)。ArsADはマロニル-CoAを基質として長鎖脂肪酸を合成し、その後長鎖脂肪酸を放出することなく、そのままArsBまたはArsCに受け渡し、その結果フェノール性脂質が生成する。ArsB及びArsCはアシルCoAも基質とすることが出来るが7)、生体内ではArsADから脂肪酸を受け取り、フェノール性脂質の合成を触媒していると考えられる。
図6 Arsオペロンによるフェノール性脂質の生合成経路 (A) と一般的な脂肪酸生合成経路 (B)
8.おわりに
通常、FASにより合成された脂肪酸は、放出され、エネルギー代謝など様々な用途で用いられる (図6B)。しかし、ArsADは生体膜脂質の合成に特化したFASであるため、生成物をもれなくIII型PKSに受け渡す機構を獲得したのかもしれない (図6A)。ArsAD様配列、ドメイン構造は、放線菌やシアノバクテリアのFASからも見出された。これらのFASにもTEやMPTのようなドメインは見られず、またPKSとハイブリッド体で存在していた。この場合も、FASからPKSへの生成物の受け渡しが起こるのではないかと予想される。また、上記のように、いくつかのFASにおいてもPKSへの生成物の受け渡しを行っていると予想されている9,10)。以上から、特異な脂肪酸を用いる二次代謝産物等の生合成においては、FASからPKSへの基質の受け渡しの機構が採用され、またそのような機構が種々の生物に存在していると考えられる。
文献
1) Schweizer, E., Hofmann, J.: Microbiol. Mol. Biol. Rev., 68, 501 (2004).
2) White, S. W., Zheng, J., Zhang, Y. M., Rock., C. O.: Annu. Rev. Biochem., 74, 791 (2005).
3) Shen, B.: Curr. Opin. Chem. Biol., 7, 285 (2003).
4) Lin, L. P., Sadoff, H. L.: J. Bacteriol., 95, 2336 (1968).
5) Reusch, R. N., Sadoff, H. L.: Nature, 302, 268 (1983).
6) Kozubek, A., Tyman, J. H.: Chem. Rev., 99, 1 (1999).
7) Funa, N., Ozawa, H., Hirata, A., Horinouchi, S.: Proc. Natl. Acad. Sci. USA, 103, 6356 (2006).
8) Miyanaga, A., Funa, N., Awakawa, T., Horinouchi, S.: Proc. Natl. Acad. Sci. USA, 105, 871 (2008).
9) Watanabe, C. M., Townsend, C. A.: Chem. Biol., 9, 981 (2002).
10) Austin, M. B., Saito, T., Bowman, M. E., Haydock, S., Kato, A., Moore, B. S., Kay, R. R., Noel, J. P.: Nat. Chem. Biol., 2, 494 (2006).