【トピックス】
アミノ酸のホモポリマー化を触媒する新規ペプチド合成酵素
濱野吉十
福井県大・生物資源
1.はじめに
放線菌Streptomyces albulus NBRC14147の二次代謝産物として生産されるε-ポリ-L-リジン (ε-PL;図1a) は、L-リジンのε-アミノ基とε-カルボキシル基がペプチド結合でつながった25~35残基からなる直鎖状のアミノ酸ホモポリマーである1)。幅広い抗菌スペクトルと高い安全性を示すε-PLは、数少ない“天然”食品保存料として国内外で利用されている1)。ε-PLの鎖長と抗菌活性の関係は良く研究されており、9 mer以上では強い抗菌活性を示すが、8 mer以下では活性はほとんど示さない2)。他方、化学合成された50 merのα-ポリ-L-リジンの抗菌活性はε-PL (25~35 mer) より劣ることから、ε-PLに特徴的なイソペプチド結合がその抗菌活性に重要であることが知られている。ε-PLの化学構造の特徴は、鎖長に多様性を有することを除けば極めて単純な構造と言えるが、その生合成メカニズムは未解明のままであった。この様な背景下、ε-PLが非リボソームペプチド合成酵素 (NRPS) によって合成される可能性が報告された3,4)。

微生物はペプチド系抗生物質を始めとする様々なペプチド化合物を生産し、その基本骨格であるペプチド鎖の合成はNRPSによって触媒される5-8)。NRPSは、多モジュール構造を有する巨大タンパク質であり、ペプチド結合を1つ合成するために1つのモジュールを有している。このモジュールの中に3つの活性ドメイン、Adenylation-(A)-domain、Thiolation-(T)-domain、Condensation-(C)-domainが存在する (図2a)。例えば、NRPSが3つのモジュールから構成されている場合は、トリペプチドを生産する。ペプチド鎖のアミノ酸配列は、各モジュール内のA-domainの基質特異性に依存し、基質となるアミノ酸はアデニル化によって活性化される。活性化されたアミノ酸は同じモジュールのT-domainに補酵素4´-phosphopatethein (4´- PP) 基を介してチオエステル結合し、C-domainよってペプチド結合が形成される。最終的にはThioesterase-(Te)-domainによってペプチドがNRPSからリリースされる。合成されるペプチド化合物は、NRPSのモジュール構造を鋳型として合成されることから、ペプチドの鎖長はNRPSの構造によって厳密に制御されている。したがって、鎖長の多様性を有するε-PLの生合成をNRPSのメカニズムで説明することは容易ではなかった。またその一方で我々は、ε-PL生産菌がε-PLの分解酵素を併せ持つことを報告しており9)、ε-PLの鎖長の多様性が分解酵素によるものなのか、あるいは生合成酵素によるものなのかについては興味深い。
![]()
最近我々は、ε-PLの生合成酵素 (Pls) とその遺伝子を見出し、Plsの触媒メカニズムの解明と鎖長の多様性が生まれるメカニズムを明らかにした10)。さらに、本酵素の触媒メカニズムをもとに新規ポリアミド合成にも成功した。本稿では、これら研究成果について紹介する。
2.Plsの精製と酵素学的諸性質
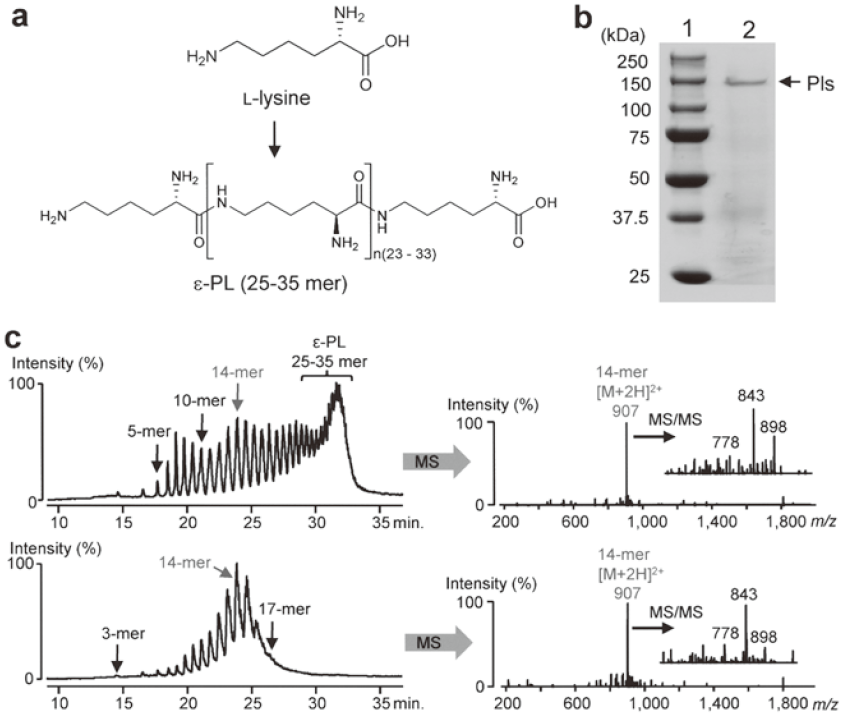
S. albulus NBRC14147を培養し、ε-PLの生産が認められる対数増殖期に菌体を回収し、超音波処理により細胞抽出液を調整した。超遠心分離後、ε-PL合成活性が膜画分に認められたことから、界面活性剤nonidet P-40 (NP-40) を用い活性画分を可溶化した。種々クロマトグラフィーによってPlsを精製したところ、168の精製倍率にて単一に精製することができた (図1b)。また、本酵素はゲル濾過クロマトグラフィーの結果から270 kDaの分子量であると算出され、またSDS-PAGEで観察された分子量は130 kDaであったことから、ホモダイマーであると示唆された。
精製酵素がPlsであるか否かを確認するために、ATP存在下でL-リジンを基質として反応を行い、反応産物をHPLC/ESI-MSで分析した。その結果、酵素依存的に生成するポリマー化合物が検出され、それらポリマーのHPLCにおける保持時間は、標準化合物ε-PLの部分分解物である3~17 merのピークと一致した (図1c)。また、酵素反応で得られた14 merの化合物についてESI-MS/MS分析したところ、標準物質14 merのそれと完全に一致した。さらに、反応産物を2,4-dinitrophenol (DNP) にて修飾し、加水分解によりリリースされた化合物を分析したところ、L-リジンのα位がDNPで修飾された化合物であることが判明した。以上の結果から、鎖長の多様性 (3~17 mer) を有するポリマー化合物はε-PLであることが判明し、得られた精製酵素はPlsであることが確認できた。
その他、Plsの酵素学的諸性質を調べたところ、本酵素はその活性にATP、Mg2+を必要とし、さらに20~30%グリセロール、20~30% NP-40存在下で最も高い活性を示した。また、至適pHは8.5であり、至適温度は25~30℃であった。興味深いことに、本酵素反応においてATPはAMPへと変換された。
3.Pls遺伝子のクローニングとPlsのドメイン構造
Plsの内部アミノ酸配列を決定し、PCRプライマーをデザインした。PCR産物をプローブに用い、S. albulus NBRC14147のコスミドライブラリーからpls遺伝子全長を含む約33 kbpの遺伝子断片を取得し全塩基配列を決定した。pls遺伝子は1,319のアミノ酸からなるタンパク質をコードしており、その推定分子量はSDS-PAGEで得た130 kDa (図1b) の分子量とよく一致した。また、pls遺伝子は決定したPls内部アミノ酸配列をコードしており、さらに本遺伝子の破壊株はε-PLの生産性を完全に失っていた。以上のことから、本遺伝子がpls遺伝子であると判断した。
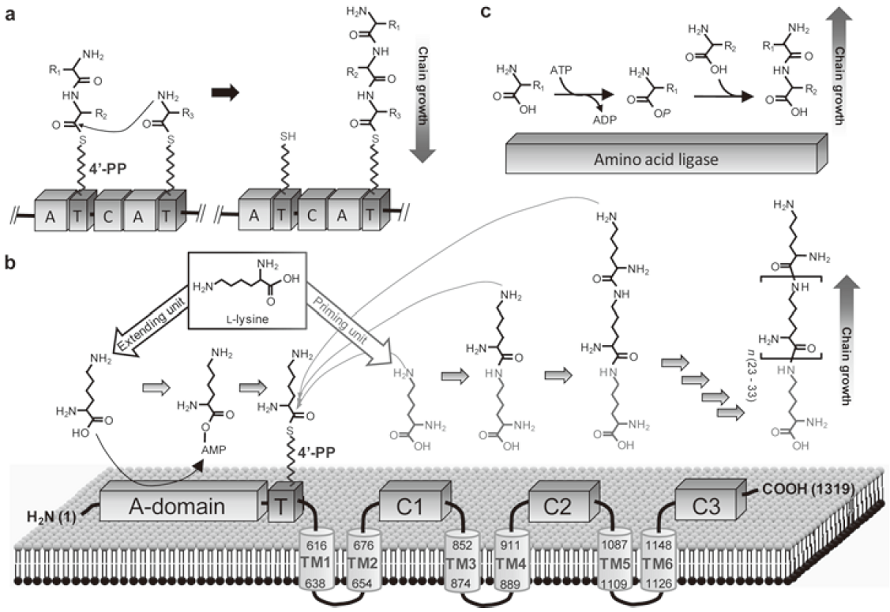
本遺伝子産物についてBLASTデータベースで検索したところ、興味深いことに多くの微生物にそのホモログが存在した。さらに、ドメイン検索を行ったところ、本遺伝子産物のN末端領域はNRPSのA-domain、および、T-domainと有意な相同性を示す領域を確認することができた (図2b)。NRPSにおけるA-domainとT-domainの連続した反応において、ATPはAMPへと変換される。したがって、上述のPlsの反応においてAMPがリリースされた結果については、NRPSの反応機構に良く一致した。しかし興味深いことに、A-domainとT-domain以外の領域においては、いずれのNRPSと有意な相同性は示さず、一方で、NRPSでは初めての例となる6カ所の膜貫通ドメイン (TM-domain) の存在と、これらTMdomainに挟まれたタンデムに存在する3つのドメインの存在が明らかになった (図2b)。これらタンデムドメインのアミノ酸配列は互いに弱い相同性 (22~27%) を示し、また、アセチルトランスフェラーゼにも弱い相同性を示した。しかし、NRPSで通常認められているペプチド合成ドメイン (C-domain) には有意な相同性は示さなかった。これまでに、数種のNRPSのC-domainについてX線構造解析が行われており、アセチルトランスフェラーゼの構造に類似していることが報告されている。Plsのタンデムドメインそれぞれの予想立体構造もアセチルトランスフェラーゼのものに相同性を示した。したがって、これらタンデムドメインはNRPSのC-domainと一次構造上は有意な相同性を示さないが、立体構造的には関連していると考えられ、これらドメインがPlsにおけるペプチド合成ドメインであると強く示唆された。そこで、これらドメインをC1-、C2-、C3-domain (図2b) と命名した。
4.Pls反応メカニズムの解明
PlsのA-domainは、抗生物質バシトラシンのNRPSに見出されたL-リジンを基質とするA-domainに高い相同性を示した。そこで、PlsのA-domainの基質特異性を調べるためにATPPPi交換アッセイを行った。その結果、予想通り、L-リジンに対しては特異的な活性を示し、その他のタンパク性アミノ酸については全く活性が認められなかった。次に、PlsのA-domainとT-domainのみからなる部分的組換え酵素 (rPls-AT) を構築し、T-domainについて機能解析を行った。rPls-ATにL-[U-14C]リジンとATPを加え酵素反応を行ったところ、rPls-ATがL-[U-14C]リジンによって放射ラベルされ、基質であるL-リジンがT-domainにチオエステル結合にて共有結合していることを明らかにした。その一方で、この部分酵素を用いた反応ではε-PLの生成が認められず、C1-、C2-、C3-domainがL-リジンのポリマー化に必須であることが判明し。さらに、C3-domainが欠如した組換え酵素、C2とC3-domainが欠如した組換え酵素を新たに構築し、これらドメインの重要性を評価したところ、少なくともC3-domainが、あるいは、これらドメインが協調的に働きポリマー合成を触媒していることが示唆された。
従来型NRPSに通常認められるTe-domainは、合成されたペプチド鎖をNRPSから切り離す重要な触媒能を有している。しかし、PlsにはTedomainに相同性を示すドメインが存在していない。したがって、合成途中のL-リジンポリマー、すなわち短鎖長のε-PLは、酵素に結合していないと予想された。また、L-[U-14C]リジンを基質として反応を行うと、rPls-ATと同様にPlsもL-[U-14C]リジンで放射ラベルされる。そこで、結合しているL-[U-14C]リジンがモノマーの状態でのみ結合しているのか、あるいはポリマーの状態で結合しているかについて検証した。放射ラベルされたPlsを回収し、過ギ酸処理後、リリースされる化合物を分析した。その結果、L-リジンのモノマーだけが検出され、短鎖のε-PLは検出されなかった。また、短鎖長のε-PL (3-9 mer) はA-domainによってアデニル化 (活性化) されないことも判明した。以上のことから、我々が予想した通り、合成途中のε-PLは酵素に結合していない状態で存在し、T-domain上にある4´-PP基を介してチオエステル結合しているL-リジンモノマーだけが、酵素に共有結合していると考えられた。
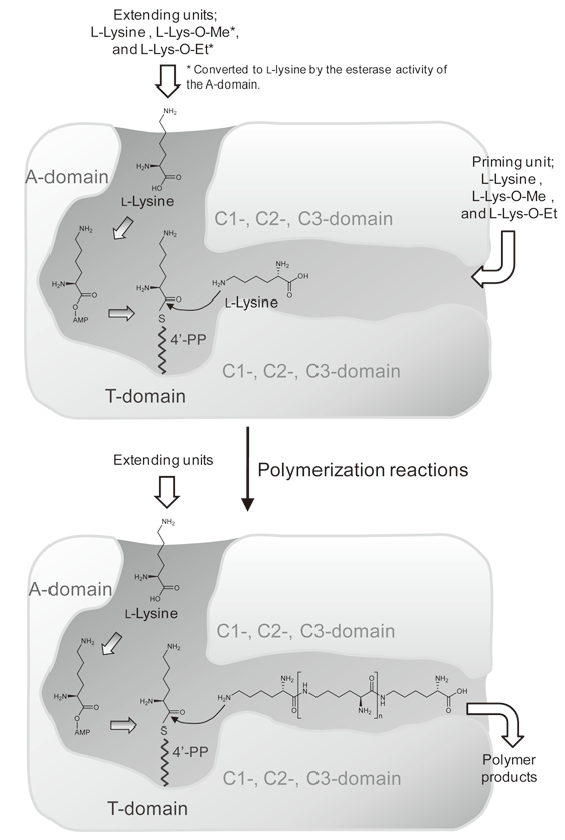
従来型NRPSにおけるペプチド鎖の伸長においては、ドナーとなるアミノ酸基質 (伸長ユニット) およびアクセプターとなるアミノ酸基質 (プライミングユニット) ともにそのカルボキシル基はアデニル化により活性化され、T-domain上にチオエステル結合する (図2a)。しかし、アミノ酸リガーゼにおいては、両基質とも酵素に共有結合することはなく、伸長ユニットのカルボキシル基はリン酸化され、プライミングユニットのカルボキシル基は反応に関与しない (図2c)。一方で、Plsにおいては (図2b)、伸長ユニットであるL-リジンはA-domainによってアデニル化された後、T-domainに結合し、活性化を受けない遊離のL-リジンがプライミングユニットとしてペプチド結合形成に利用されると予想された。この予想されるメカニズムを検証するために、L-リジンのカルボキシル基がブロックされたL-リジンメチルエステル、L-リジンエチルエステルを基質として反応を行った。その結果、ε-PLのメチルエステル体とエチルエステル体が生成した。したがって、プライミングユニットであるL-リジンあるいは合成途中の短鎖ε-PLのカルボキシル基は酵素との共有結合に使われることなく、遊離の状態で存在していることが判明した。さらに、ここで興味深いことは、L-リジンのエステル体のみを基質として反応を行った場合にもリジンのポリマー化が確認されたことである。エステル体はA-domainによるアデニル化を受けることはなく、したがってT-domainにチオエステル結合できないはずである。この疑問は、PlsのA-domainの興味深い機能によって説明できた。すなわち、このA-domainはエステラーゼ活性を併せ持っており、L-リジンのエステル体を加水分解後、アデニル化していることが判明した。
これらの結果から、Plsはアデニル化により活性化されたL-リジンを伸長ユニット、遊離L-リジンをプライミングユニットとしてL-リジンダイマーを合成し、更に伸長するε-PL鎖のN末端アミノ基 (ε-アミノ基) が次サイクルでの求核的アクセプターなることで、繰り返しペプチド結合が形成され、ペプチド鎖が伸長することが明らかとなった。以上のように、我々は、PlsがNRPS様式で基質アミノ酸を活性化し、アミノ酸リガーゼ様の縮合反応機構で繰り返しペプチド鎖の伸長を行なう新奇ペプチド合成酵素であることを明らかにした。
また、興味深いことに短鎖長のε-PL (3~9 mer) はプライミングユニットとして利用されなかった。これは、本酵素の触媒ポケットが常に合成途中のε-PLで占領されており、外から加えた短鎖長のε-PLは触媒ポケットにアクセスできないためと考えられた。また、この触媒ポケットが合成途中のε-PLを包み込むように長細いトンネルを形成し (図3)、また、ε-PLのα位のアミノ基を保護していると考えると、Plsのε位アミノ基特異的なポリマー合成反応を説明できる。
図3 想定されるPls 触媒ポケット
5.Plsの基質特異性
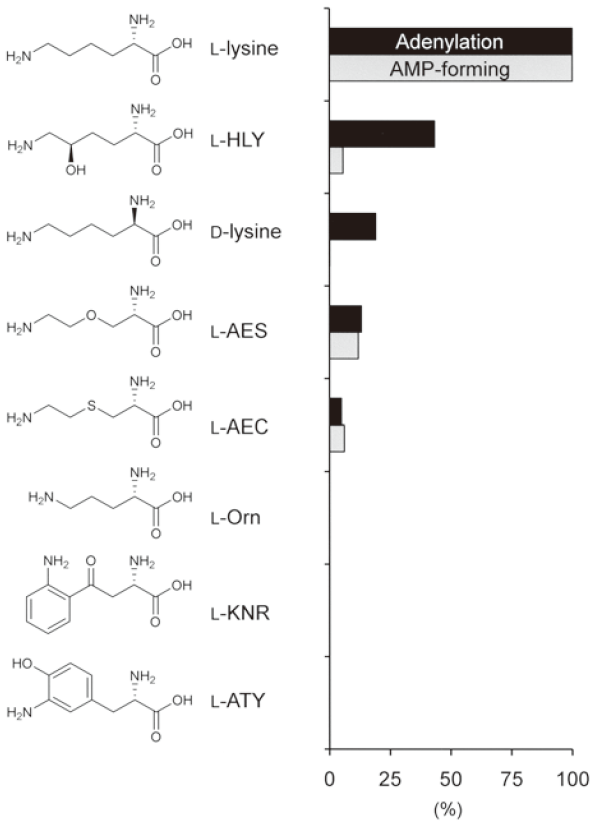
Pls は、L-リジンのエステル体をプライミングユニットとして利用できる。そこで、伸長ユニットに対する基質特異性について検証した。上述のように、L-リジン以外のタンパク性アミノ酸は何れもアデニル化されなかったが、数種のL-リジンアナログに対してはアデニル化活性とT-domainへの結合活性 (AMP-forming活性) の両活性が認められ (図4)、伸長ユニットになり得ることを見出した。そこで、これらL-リジンアナログ (L-HLY、L-AES、L-AEC) からのホモポリアミノ酸合成を試みたが、何れのアナログもプライミングユニットとしては利用されず、生成物は得られなかった。しかし、微量のL-リジンをプライミングユニットとして反応系に供給することで、アナログとL-リジンから構成される新規な“非天然型ヘテロポリアミノ酸”が生成した。さらに我々は、ε-PL生産菌S. albulusを用いた菌体反応においても、非天然型ヘテロポリアミノ酸を生産できることを見出した。菌体反応では、持続的に非天然型ヘテロポリアミノ酸を生産することが可能であり、その生成効率とアナログの取り込み率は酵素合成と比較して極めて高いことも確認できた。
6.おわりに
S. albulus NBRC14147からPlsを精製し、本酵素が膜貫通ドメインを有する膜酵素であることを明らかにした。本酵素が鎖長の多様性を有するε-PLを生成するメカニズムは、ε-PL 分解酵素の関与ではなく、合成酵素自身によるものであると判明した。すなわち、PlsがNRPSのメカニズムとアミノ酸リガーゼのメカニズムを併せ持つことで説明できた。
自然界に存在するアミノ酸のホモポリマーは、ε-PLと納豆菌が生産するポリ-γ-グルタミン酸の2種類しか知られていない。しかし、本研究によって、多くの微生物にPlsのホモログが存在していることを明らかにし、その予想される基質特異性がL-リジンではないことから、第三、第四の天然アミノ酸ポリマーが存在する可能性を示すことができた。近年、ε-PLの様々な生理学的・化学的機能が明らかになり、医療、産業の両面で応用が期待されている。特に最近、手術用縫合糸の代用となる生分解性の組織接着材としてε-PLが応用利用された報告は興味深い11)。さらに、天然化合物であるε-PLの化学構造は化成ナイロンと同じくポリアミド構造を有している。今後、Plsを機能改変、あるいは、Plsホモログ酵素を利用することで、強靱かつ柔軟で耐油性や耐薬品性に優れるポリアミド系バイオプラスチックを微生物によって創製することが可能になるかもしれない。
謝辞
本研究を実施するに当たり筑波大学・小林達彦先生から放線菌用発現プラスミドpHSA81を分譲していただいた。ここに記して厚く御礼申し上げる。
文献
1) Oppermann Sanio, F. B., Steinbuchel, A.: Naturwissenschaften, 89, 11 (2002).
2) Shima, S., Matsuoka, H., Iwamoto, T., Sakai, H.: J. Antibiot. (Tokyo), 37, 1449 (1984).
3) Kawai, T., Kubota, T., Hiraki, J., Izumi, Y.: Biochem. Biophys. Res. Commun., 311, 635 (2003).
4) Saimura, M., Takehara, M., Mizukami, S., Kataoka, K., Hirohara, H.: Biotechnol. Lett., 30, 377 (2008).
5) Walsh, C.: Antibiotics: Action, Origins, Resistance (American Society for Microbiology, Washington DC, 2003).
6) Schwarzer, D., Finking, R., Marahiel, M. A.: Nat. Prod. Rep., 20, 275 (2003).
7) Mootz, H. D., Schwarzer, D., Marahiel, M. A.: Chembiochem., 3, 490 (2002).
8) Marahiel, M. A., Stachelhaus, T., Mootz, H. D.: Chem. Rev., 97, 2651 (1997).
9) Hamano, Y., Yoshida, T., Kito, M., Nakamori, S., Nagasawa, T., Takagi, H.: Appl. Microbiol. Biotechnol., 72, 173 (2006).
10) Yamanaka, K., Maruyama, C., Takagi, H., Hamano, Y.: Nat. Chem. Biol., 4, 766 (2008).
11) Araki, M., Tao, H., Nakajima, N., Sugai, H., Sato, T., Hyon, S. H., Nagayasu, T., Nakamura, T.: J. Thorac. Cardiovasc. Surg., 134, 1241 (2007).