【トピックス】
酵素燃料電池の新潮流
都甲 真、西澤松彦
東北大院・工学研究科
1.はじめに
小型電子機器等の電源として、身の回りに分散するエネルギー源を利用した小型発電デバイスが活発に研究されており、そのひとつに、酵素を電極触媒として発電を行うバイオ燃料電池がある (燃料溶液を連続供給しない場合は、バイオ電池と呼ぶのが相応しい)。酵素は、大量生産が可能であるため、安価で再生可能な触媒である。温和な環境で活性を示し、様々なバイオマスを酸化するものが多様に存在する。さらに重要なのは、高度な基質特異性である。原理的には、身の回りに存在する燃料溶液 (例えば、ジュース、お酒、血液など) を、精製せずに直接利用でき、発電セル全体を極めてシンプル・小型に構成可能となる (図1)。このようにバイオ燃料電池は、白金などの貴金属触媒や有機電解液を必要とせず、身の回りの燃料溶液から発電できるため、携帯電子機器や体内埋め込み型電子機器用の使い捨て小型電源としての利用が期待されている。本稿では、バイオ燃料電池の基本構成を、最近の開発動向を交えて紹介する。
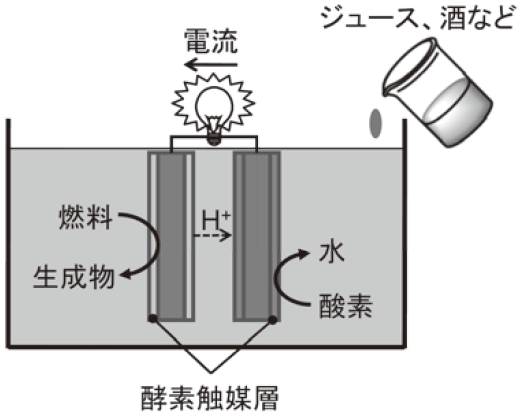
図1 バイオ燃料電池
2.バイオ燃料電池の電極構成
2-1 電極触媒
バイオ燃料電池の出力性能は、主に電極触媒として用いる材料 (酵素など) の種類・性質とその電極への固定化手法に左右される。電極触媒の構成としては、燃料の酸化 (および酸素の還元) を担う酵素に加えて、通常、酵素-電極間の電子伝達を仲介する電子メディエータを必要とする。このような電極をメディエータ型電極、酵素が直接電極反応を行うものは直接電子移動型電極と分類される (図2)。バイオ燃料電池の作動原理などについては、加納、辻村らによって詳説されているため、そちらを参照していただきたい1)。簡単に述べると、バイオ燃料電池の開回路電圧は、燃料極 (アノード) と酸素極 (カソード) のそれぞれで電極反応を行う分子の電極反応電位の差であり、電流に関してはそれぞれの分子の反応性に対応する。実際には、電極への固定化法が電子メディエータおよび酵素の活性や安定性を支配する重要な因子であるため、選択した触媒材料が性能を十分に発揮できる適切な固定化が必要となる。
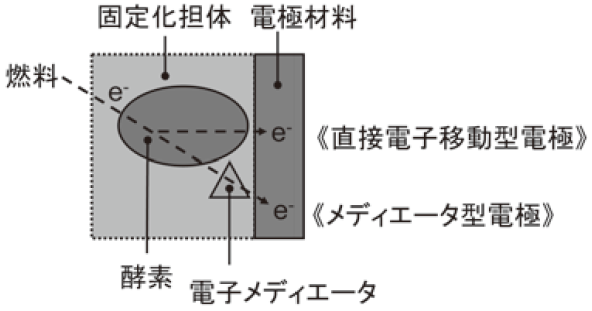
図2 バイオ燃料電池の電極反応
2-2 固定化担体、電極材料
電極上へ酵素を安定かつ高密度に固定化する手法が永年研究されてきた。最近では、酵素の高密度固定化のために、カーボン微粒子などによる多孔質電極の有効性に注目が集まっている。電極の比表面積を増大させることによって単位電極面積当たりの酵素固定化量を増やし、燃料や酸素の反応面積を増やすことで電流密度を増大させることができる。
加納、辻村らは、多孔質カーボン電極中に酵素を固定化した場合、大きな電流値が得られるのみならず、固定化酵素が高い安定性を示すことを報告している。さらにその際、温度やpH変化に対する安定性も向上していた。またMinteerらは、中和したNafi on分散液から作製した膜中に固定化した酵素が、安定に活性を保つと報告している2)。これらの報告では、酵素が適切な細孔中に固定化されることで、構造変形による失活が抑制されているのではないかと考えられている。このように、電極材料など固定化担体の構造をナノスケールで制御することにより、バイオ燃料電池の一層の高出力化、安定化が期待できる。
2-3 メディエータ型酵素電極
メディエータ型電極は、大きな電流値が得られ、多様な酵素に適用できるため、広く研究されている。
燃料極 (アノード) については、特にグルコースを酸化する電極について、血糖値センサー開発の延長線上で研究が進んできた。様々な電子メディエータが検討されてきたが、バイオ燃料電池が有効な電圧を出力するためには、0V (vs. Ag¦AgCl sat. KCl) よりネガティブな電位で反応することが望まれる。HellerらはOs錯体修飾ポリマーとグルコース酸化酵素 (GOD) を共に固定化して作製したハイドロゲル状の酵素固定化膜の研究を進めることで、バイオセンサーやバイオ燃料電池の開発をリードしてきた。ここでOs錯体をポリマーに修飾する際、ある程度長いリンカーを介して修飾することで、固定化状態のOs錯体が適度な自由度を有して活性に働くことを見出している3,4)。池田、加納、辻村らはPQQ依存性グルコース脱水素酵素 (PQQ-GDH) を用い、Os錯体修飾ポリマーを用いた共固定化などにより、グルコース電極を作製している5)。
Os錯体を利用しない燃料極として、Willnerらは電極表面のPQQ単分子層にグルコース酸化酵素などを直接共有結合させた系で反応電流を得ている6,7)。東京大学の研究グループは、カーボンブラック電極上へフェロセンやベンゾキノンをグラフトさせたものをGODのメディエータに用いている8)。
我々は、NAD依存性グルコース脱水素酵素 (GDH) と、NADHを酸化する酵素であるジアフォラーゼ、および電子メディエータであるビタミンK3のポリマーを用いるグルコース極を研究している9-11)。Sonyでも同様の電極系での検討がなされており、交互積層膜を利用した電極への固定化により数mA cm-2程度の出力電流を得てい12)。
酸素極 (カソード) の酵素としてはマルチ銅酵素、特にラッカーゼやビリルビン酸化酵素 (BOD) がよく研究されている。池田、加納、辻村らはBODが中性溶液下で優れた酸素還元能力を示すことを見出している。彼らは中心金属の異なるシアノ金属錯体を電子メディエータに用いた酸素極を研究しており、多孔質電極との併用により数~数十mA cm-2クラスの酸素還元電流を達成している。またHellerらやBartonらは配位子や修飾ポリマーを変えたOs錯体修飾ポリマーのスクリーニングを行い、中性溶液中でも酸素還元過電圧が小さく、mA cm-2クラスの出力電流の得られる酸素電極を実現している。
これらメディエータ型電極の中には、大きな電流が得られる一方で、Os錯体やシアノ金属錯体といったコストや安全性が危惧される物質を使用しなければならないという問題を抱えているものもある。
2-4 直接電子移動型酵素電極
直接電子移動反応が可能な酵素に関する報告が増えてきている13)。その特徴として、酵素内に複数の活性部位を有すことが知られている。つまり燃料や酸素と反応する活性部位と電極と反応する活性部位が異なることで、燃料や酸素の酵素内への取り込み、および電極反応の同時進行が可能になっているものと考えられている。この種の酵素電極に関しては、酵素自体の探索に加えて、有効な電流値を得るための固定化法の検討、特に電極の表面状態と酵素の配向性の制御が必要となる。
酸素極 (カソード) については、マルチ銅酵素を用いたものがここでもよく研究されている。ラッカーゼ、BOD、銅排出系酵素 (CueO) を用いたカソードが、京都大学の研究グループを中心に活発に研究されており、詳細な解析が進められている。これらの酵素電極は一般に電流値に劣るといわれる直接電子移動型であるにも関わらず、炭素微粒子などによる電極の多孔質化により、酸素飽和溶液下において数~数十mA cm-2程度の還元電流が得られるまでになってきている14)。
燃料極 (アノード) については、ヒドロゲナーゼやフルクトース脱水素酵素、グルコン酸脱水素酵素などを用いた電極が検討されている。グルコースを燃料とできるET型アノードについては報告例が少ないが、セルビオース脱水素酵素の基質特異性の低さを利用したグルコース電極などの報告例がある15)。また、早出らは、電子伝達サブユニットを組み込んだ酵素で直接電子移動反応が可能であることを最近報告している16)。酵素のスクリーニングや電極素材の検討によって、今後より多くの燃料種に対応した直接電子移動系が開発されると期待される。
2-5 燃料の多段階酸化
酵素を電極触媒とするバイオ燃料電池では、通常グルコースからグルコノラクトンへの2電子酸化のみで出力を得ている。本来、グルコースであれば1分子から24電子、エタノールであれば12電子をCO2への完全酸化により得ることができる。生体内では多種の酵素反応の連携よってそれを実現しており、その模倣によって、電極上での多電子酸化が可能かもしれない。このような多段階酸化のバイオ燃料電池への適用は、古くはWhitesidesらにより試みられている17)。彼らはアルコール、アルデヒド、ギ酸と三つのNAD依存性脱水素酵素の利用で、メタノールの多段階酸化を実現している (図3)。また最近では、ミトコンドリア内のエネルギー生成回路であるクエン酸回路を電極上で再構成することにより、乳酸やエタノールの完全酸化を行う取り組みがなされている18,19)。その際使用される酵素の大多数はNAD依存性の脱水素酵素であり、こういった面からもNADH酸化電極の汎用性の高さと重要性が伺える。また、Minteerらはこのクエン酸回路の再構成に加え、エタノールの4電子酸化系2) やPQQADH、PQQ-ALDHの基質特異性の低さを利用したグリセロールの完全酸化系にも着手している20)。このような多段階酸化系はエネルギー密度の向上、燃料利用率の向上といった面で重要であり、今後の重点研究課題の一つといえる。
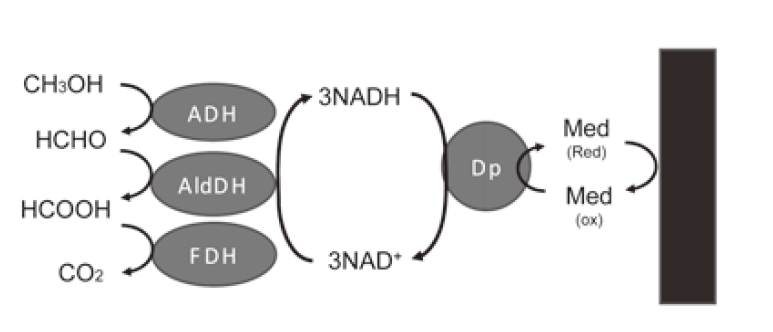
図3 燃料の多段階酸化反応の例
2-6 バイオ燃料電池の出力性能
以上に示したように、酵素の固定化技術や電極材料の検討により、バイオ燃料電池の出力性能は飛躍的な向上を遂げようとしている。特に出力電流に関しては数~数十mA cm-2程度のものが得られてきている。出力電力に関しても、電子メディエータを利用したもので、数mW cm-2程度が得られており、市販の電子機器を駆動できるまでになっている12)。また、全く電子メディエータを利用しない直接電子移動型電極のみからなるバイオ燃料電池も次々に報告されている14,15)。このタイプのバイオ燃料電池は、シンプルさやコストといった点で優れているため、理想的なバイオ燃料電池といえる。
3.電池構造
現在のバイオ燃料電池の研究は、主に酵素とメディエータの探索、および固定化法の改良による電極性能の向上に終始しており、電池構造についての報告例は多くない。しかし、バイオ燃料電池の出力性能は格段に進歩してきているため、今後は、より実用に近いバイオ燃料電池の構造も重要な研究課題になると予測される。我々は、そういった視点から半導体作製技術を利用したバイオマイクロ燃料電池を開発してきた (図4)。図4(a)に示したマイクロ流路セルは電池性能の定量評価を行うために有効である9,10)。また、図4(b)のセルを用いることで、バイオ燃料電池を半自動的に直列化することができ、1 V以上の出力電圧を得ることができた21)。さらに耐久性の向上を目指した発電システムや、経皮刺入のための針型バイオ燃料電池についても研究している (図4(c),(d))21)。

図4 MEMS技術によるバイオ燃料電池
また、電極性能の向上と共に溶液中の酸素濃度の低さが問題となってきているため、気相の酸素を利用する空気極など酸素供給システムの開発も今後の重点課題と考えている。さらに、バイオ燃料電池の送液機構や電池の高密度集積化など、微細加工技術の積極的な活用による、バイオ燃料電池システムの開発が望まれる。
4.バイオ燃料電池の応用
バイオ燃料電池は安全、小型、再生可能、混合燃料からの発電が可能といった利点を持つ一方で、出力電力や安定性に問題を抱えている。この10年ほどで急速に性能を伸ばしているため、今後も電極性能が改善されていくことが予測されるが、現状では大きな電力を長い期間供給させるような応用は困難である。よって、安全性や安価、小型といった特徴を活かした小型使い捨ての電源、特に短期的な生体埋め込みによる血糖モニタリング用の自己発電型センサーなどへの応用が現実的なものと考えられている 3,4,6,7,16)。その際には、2、3日程度の埋め込み期間、安定な電力を供給できることが望ましい。またこの場合、電極表面の生体適合性が電池の安定性を左右するため、触媒性能と併せた検討が必要である。
5.おわりに
以上紹介したように、バイオ燃料電池の研究は、世界的に研究が活発化しており、出力が数mA、数mWのものが次々と報告されてきている。実用化のためには、安定性の一層の向上と使用法に応じた電池構造が必要とされる。酵素や電極材料、微細加工、電池開発など日本の得意とする研究分野を伸ばし、それらを組み合わせていくことで、バイオ燃料電池の実用化が期待される。
謝辞
本稿で紹介した我々の研究成果は、厚生労働省科研費・医療機器開発推進研究事業のご支援の下、研究テーマ「分散型ナノ植え込み機器を活用した慢性心不全患者の統合的デバイス治療の開発」のなかで得られたものです。感謝いたします。
文献
1) 辻村清也、加納健司: Electrochemistry, 76, 900 (2008).
2) Topcagic, S., Minteer, S. D.: Electrochim. Acta, 51, 2168 (2006).
3) Heller, A.: Phys. Chem. Chem. Phys., 6, 209 (2004).
4) Mano, N., Mao, F., Heller, A.: J. Am. Chem. Soc., 125, 6588 (2003).
5) Tsujimura, S., Kano, K., Ikeda, T.: Electrochemistry, 70, 940 (2002).
6) Katz, E., Buckmann, A. F., Willner, I.: J. Am. Chem. Soc., 123, 10752 (2001).
7) Katz, E., Filanovsky, B., Willner, I.: New J. Chem., 23, 481 (1999).
8) Tamaki, T., Yamaguchi, T.: Ind. Eng. Chem. Res., 45, 3050 (2006).
9) Togo, M., Takamura, A., Asai, T., Kaji, H., Nishizawa, M.: J. Power Sources, 178, 53 (2008).
10) Togo, M., Takamura, A., Asai, T., Kaji, H., Nishizawa, M.: Electrochim. Acta, 52, 4669 (2007).
11) Sato, F., Togo, M., Islam, M. K., Matsue, T., Kosuge, J., Fukasaku, N., Kurosawa, S., Nishizawa, M.: Electrochem. Commun., 7, 643 (2005).
12) Sakai, H., Nakagawa, T., Tokita, Y., Hatazawa, T., Ikeda, T., Tsujimura, S., Kano, K.: Energy & Environmental Science, 2, 133 (2009).
13) Gorton, L., Lindgren, A., Larsson, T., Munteanu, F. D., Ruzgas, T., Gazaryan, I.: Anal. Chim. Acta, 400, 91 (1999).
14) Kamitaka, Y., Tsujimura, S., Setoyama, N., Kajino, T., Kano, K.: Phys. Chem. Chem. Phys., 9, 1793 (2007).
15) Coman, V., Vaz-Dominguez, C., Ludwig, R., Herreither, W., Haltrich, D., De Lacey, A. L., Ruzgas, T., Gorton, L., Shleev, S.: Phys. Chem. Chem. Phys., 10, 6093 (2008).
16) Okuda-Shimazaki, J., Kakehi, N., Yamazaki, T., Tomiyama, M., Sode, K.: Biotechnol. Lett., 30, 1753 (2008).
17) Palmore, G. T. R., Bertschy, H., Bergens, S. H., Whitesides, G. M.: J. Electroanal. Chem., 443, 155 (1998).
18) Fukuda, J., Tsujimura, S., Kano, K.: Electrochim. Acta, 54, 328 (2008).
19) Sokic-Lazic, D., Minteer, S. D.: Biosens. Bioelectron., 24, 939 (2008).
20) Arechederra, R. L., Minteer, S. D.: Fuel Cells, 9, 25 (2009).
21) 西澤松彦: Electrochemistry, 76, 916 (2008).