【トピックス】
組換え大腸菌によるバイオマスからの芳香族化合物前駆体2-deoxy-scyllo-inosose (DOI) の高効率発酵生産
高久洋暁、脇坂直樹、髙木正道
1.はじめに
人類が20世紀に入って高度に展開させてきた化石資源を利用した技術革新は、大量生産・大量消費型の社会を作り出し、私たちの生活に大きな恩恵をもたらしてきた。生活、産業の様々な場面で使用する製品は、化石資源を原料とする物が数多くあり、特に化学工業における石油化学製品は、原油 (ナフサ) を分解・加工したエチレンやフェノール類などを原料とし、生産されている。しかし、その一方で、石油化学工業は、化石資源の使用量の増大に伴う資源枯渇、二酸化炭素の増大による地球温暖化やダイオキシン・環境ホルモンによる環境汚染など地球的規模の問題を引き起こしている。2009年12月7日から19日にかけてデンマークのコペンハーゲンで開催された国連気候変動枠組み条約第15回締約国会議 (COP15) に象徴されるように、これまでの産業・社会構造を変革し、持続可能な社会の構築の必要性が我々に確実に迫ってきている。そこで現在、従来の高温、高圧を必要とする環境負荷の高い化学プロセスに替わるプロセスとして、カーボンニュートラルである再生可能な農産物資源 (バイオマス) からの化学品の製造における微生物や動植物等の生体触媒を活用した物質変換プロセスが注目されている。酵素反応は一般的に反応特異性が高く、常温、常圧下で進行する環境負荷の少ない省エネルギー反応であることからも、微生物による酵素反応を利用した物質変換プロセスは、環境調和型循環システムの基盤となり、バイオリファイリナリー社会の構築に必須となっている。
筆者らの研究室では、炭素六員環骨格を持つキラルな化合物であり、医薬品、農薬、健康食品などの原材料として利用できる物質である2-deoxy-scyllo-inosose (DOI) ついて研究を行っている。このDOIは、簡単に芳香族化合物のカテコール、ヒドロキシヒドロキノン (1, 2, 4-トリヒドロキシベンゼン)、ヒイドロキノンなどへ化学変換することができ、さらにカルバ糖へ導くことも可能な有用化学物質である1,2)。残念ながら、現在までこのDOIを大量生産する技術が確立されていないため、化学工業原料としての利用には未だ至っていない。東京工業大学の柿沼らは、多数の臨床医学的に重要な化学療法剤である2-デオキシストレプタミン含有アミノグリコシド系抗生物質の生合成過程に関与する酵素の1つに、初発の糖質を炭素環化する酵素を発見した。ブチロシン生産菌Bacillus circulans SANK72073より精製されたこの酵素は、グルコース-6-リン酸を原料として多段階の反応を触媒し、最終的にDOIを生成した。その後、B. circulansよりそのDOI合成酵素遺伝子 (グルコース-6-リン酸をDOIに変換する反応を触媒する酵素をコードするbtrC) がクローニングされ、大腸菌内でその遺伝子を発現、精製することで組換えDOI合成酵素を大量に得ることが可能になった3)。試験管内で、グルコースをATPの存在下でヘキソキナーゼと組換えDOI合成酵素により炭素環化すべくこれらをワンポットで反応したところ、効率よく直接DOIを合成できたが、非常に高いコストが採算された。そこで次に大腸菌を利用してグルコースからDOIの生産を試みたが、その生産効率は50 g /Lのグルコースからわずか0.5 g/LのDOIの生産にとどまり、実用化へのハードルは非常に高かった。本稿では、DOI生産宿主とした大腸菌の代謝工学的改変により、DOI生産を飛躍的に上昇させ、実用化のめどに至った技術開発について概説する。
2.安価な継続的高発現発現プロモーター
宿主に目的物質生産に関与する酵素タンパク質を過剰に発現させることで、目的物質の大量生産につながることが多い。組換えタンパク質の大量発現は、大腸菌を初め、酵母、昆虫細胞など多くの細胞を宿主として試みられている。特に大腸菌は、遺伝子数も約4000と比較的少なく,遺伝子工学の知見や様々な変異や環境変化に対するオミックスデータが豊富であり、微生物を用いた産業利用プロセスの基盤技術の開発に適していると考えられる。大腸菌における組換えタンパク質高発現用システムで、現在最もよく利用されているのはIPTGの添加でT7RNAポリメラーゼが産生されて、T7プロモーター下の組換えタンパク質遺伝子が発現されるシステムである。しかしながら、その発現誘導物質IPTGは非常に高価な物質であるため、安価で生産しなければならない化学工業原料生産には利用し難い。工業生産用に利用可能な発現プロモーターの条件として、少なくとも培養前期から後期まで構成的に発現すること、バイオマス培地の影響を受けず発現できることが必要である。現在まで知られている様々な大腸菌遺伝子プロモーターの中から培養初期である栄養増殖期に発現するgapA (glyceraldehyde-3-phosphate dehydrogenase A) プロモーターと培養後期の定常期に発現するプロモーターであるgadA (glutamic acid decarboxylase A) プロモーターを組み合わせて利用したところ、DOI合成酵素を培養初期から後期まで継続的に大量発現することに成功した。さらにそのgadAの転写を抑制する領域4) を欠失させた改変型gadAプロモーターを利用したところ、培養初期から後期まで構成的にDOI合成酵素を大腸菌GI724株内で高発現したので、この改変型gadAプロモーターとgapAプロモーターを組み合わせ、さらに強化した継続的遺伝子高発現システムを構築した。また、米糠、モラセス、コーンスティープリカーなどのバイオマスを含む培地において培養したとき、IPTG誘導型の発現システムは機能せず、DOI合成酵素の発現は見られなかったが、gapAと改変型gadAプロモーターを組み合わせた発現システムは、培地成分の影響を受けずに大腸菌GI724株内で高発現することができた。すなわち、バイオマス培地に適応可能であり、培養初期から後期まで挿入遺伝子を高発現させることのできる安価な遺伝子発現システムを構築することに成功した5)。
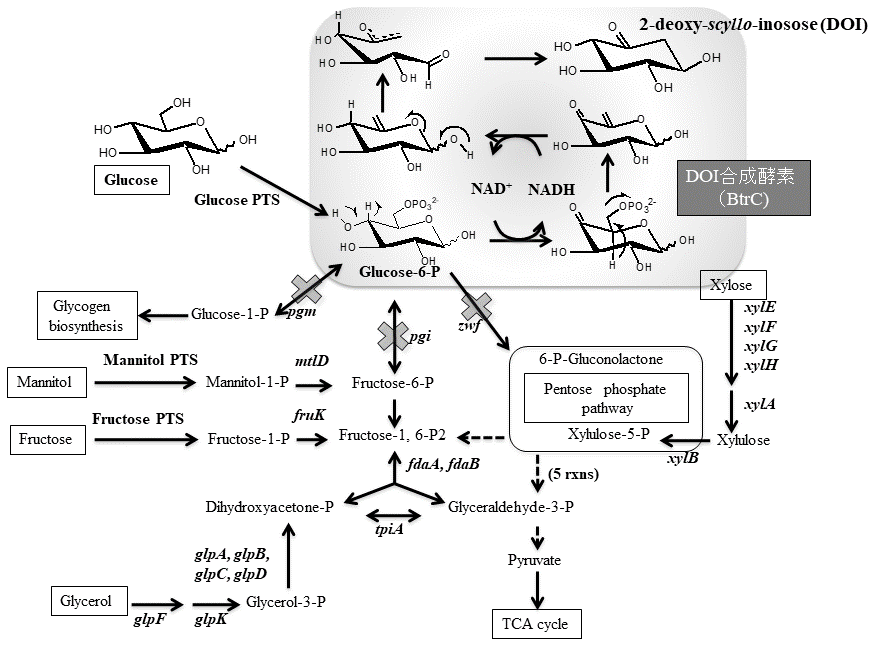
図1 DOI合成酵素遺伝子導入大腸菌の炭素源代謝マップ
3.グルコース-6-リン酸蓄積大腸菌によるDOIの高生産
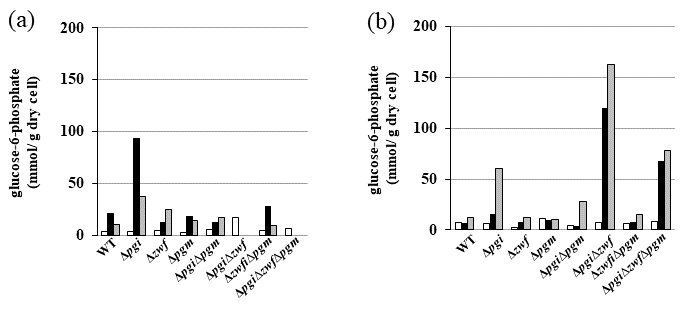
gapAと改変型gadAプロモーターを組み合わせた発現システムを利用して、大腸菌GI724株にDOI合成酵素を導入した株を用い、グルコースからDOIの生産を試みたが、その生産効率は50 g/Lのグルコースからわずか1 g/LのDOIが生産されただけであった。大腸菌において、グルコースはglucose PTS (phosphoenolpyruvate :glucose phosphotransferase system) に依存して細胞内に取り込まれる。Glucose PTSは、グルコースがリン酸化とカップルして取り込まれるので、グルコース-6-リン酸として細胞内に取り込まれる。この細胞内に取り込まれたグルコース-6-リン酸は、解糖系のpgi遺伝子によりコードされているホスホグルコースイソメラーゼ、ペントースリン酸経路のzwf遺伝子にコードされているグルコース-6-リン酸デヒドロゲナーゼ、グリコーゲン生合成経路に向かうpgm遺伝子にコードされているホスホグルコムターゼが基質として利用する。また、DOI合成酵素遺伝子導入大腸菌においては、DOI合成酵素もグルコース-6-リン酸を基質として利用する (図1)。しかしながら、50 g/Lのグルコースから1 g/LのDOIしか生産できなかったということは、DOI合成酵素が利用したグルコース-6-リン酸は全体の数%に過ぎないということである。そこで我々は、DOI合成酵素がグルコース-6-リン酸を利用できるように、グルコース-6-リン酸蓄積大腸菌株の取得を試みた。グルコース-6-リン酸を基質として利用する3遺伝子 (pgi, zwf, pgm) それぞれの単独遺伝子破壊株 (Δpgi, Δzwf, Δpgm)、二重遺伝子破壊株 (ΔpgiΔzwf, ΔpgiΔpgm, ΔzwfΔpgm)、及び三重遺伝子破壊株 (ΔpgiΔzwfΔpgm) を作製し、グルコースを含む培地における野生株及びそれぞれの遺伝子破壊株のグルコース-6-リン酸の蓄積について調べた。その結果、Δpgiにおいて高濃度のグルコース-6-リン酸の蓄積が見られた (図2)。Δpgiよりもさらにグルコース-6-リン酸の蓄積が期待されたΔpgiΔzwfとΔpgiΔzwfΔpgmの2株は、グルコースがグルコース-6-リン酸を介してTCAへ向かう主要な経路を遮断しているため、炭素源がグルコースのみだとほとんど生育することができなかった。そこで生育できるように、培地中に生育補助炭素源としてマンニトールをグルコースと共に加えることにより生育させ、グルコース-6-リン酸の蓄積について調べた。その結果、ΔpgiΔzwfとΔpgiΔzwfΔpgmの2株は、良好に生育でき、高いグルコース-6-リン酸の蓄積が見られた (図2)。次にこれらの大腸菌遺伝子破壊株にDOI合成酵素遺伝子を導入して、DOI生産について検討した結果、野生型株よりも飛躍的にDOIの生産性が向上した。特にΔpgiΔzwfΔpgmにおいては、培養開始72時間後で培地中のグルコースはほとんどDOIに変換され、さらにそのグルコースからDOIへの変換効率は90%以上を示していた (図1,3)5,6)。

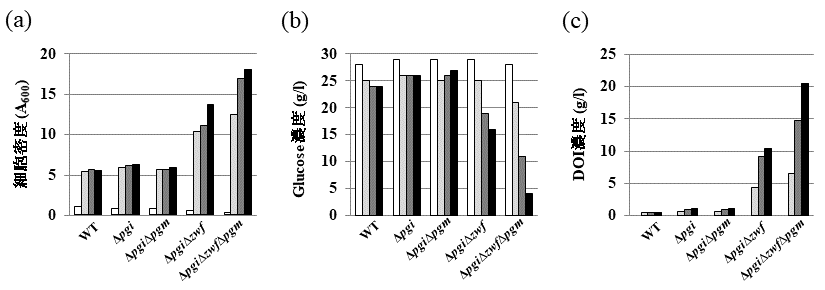

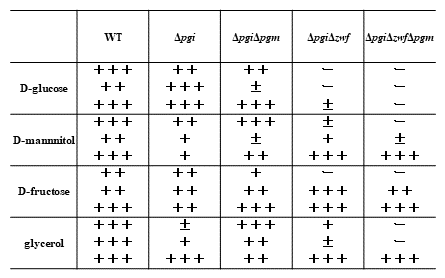
グルコースからDOIへの高変換効率をもつ大腸菌遺伝子破壊株は、生育炭素源としてグルコースを利用することはできなく、他の炭素源を生育用として利用しなければならない。上記したDOI生産には、マンニトールを生育炭素源として利用していたが、実用化のためには、高効率DOI発酵生産ために補助炭素源を有効に利用できる大腸菌株及び低コスト補助炭素源の選択が必要となる。そこで遺伝子クローニング用としてよく用いられるDH5α株由来、組換えタンパク質発現用として用いられるBL21株由来の大腸菌遺伝子破壊株を作製し、これまで研究に利用してきたGI724株由来の大腸菌遺伝子破壊株と共にグルコース及び生育補助炭素源の資化能について調べた (表1)。その結果、それぞれの株は、特有の炭素資化能を持つことがわかった。グルコースからDOIへの高変換効率をもつ大腸菌遺伝子破壊株ΔpgiΔzwfΔpgmのDH5α株由来ΔpgiΔzwfΔpgmは、補助炭素源としてマンニトール、フルクトース、グリセロールを利用することができず、この株を利用したDOI高生産はできなかった。また、BL21株由来ΔpgiΔzwfΔpgmは、補助炭素源としてグリセロールを利用することができなかった。上記2つの株由来の遺伝子破壊株と比較して、GI724株由来ΔpgiΔzwfΔpgmは、補助炭素源としてマンニトール、フルクトース、グリセロールのすべてを利用することができた。大腸菌遺伝子破壊株ΔpgiΔzwfΔpgmを利用したグルコースからのDOI生産は、GI724株由来の大腸菌遺伝子破壊株を利用することが最適であると判断された。また、生育補助炭素源の種類についてであるが、GI724株由来大腸菌遺伝子破壊株ΔpgiΔzwfΔpgmの生育補助炭素源をマンニトールでなく、グリセロール及びフルクトースを用いてDOI生産性についての検討も行ったところ、グリセロールとグルコースの共存下においてはマンニトールの場合とほぼ同程度のDOI生産速度及び効率を示したが、フルクトースとグルコースの共存下においてはマンニトール、グリセロールの場合と異なりDOI生産速度及び効率が減少した (図4)。すなわち、DOI生産組換え大腸菌に適した補助炭素源としては、マンニトール、グリセロールがあげられ、さらにバイオディーゼル産業の副産物であるグリセロールが低コスト炭素源であることから、組換え大腸菌の高効率DOI生産に最適な生育補助炭素源は、グリセロールであると考えられる。

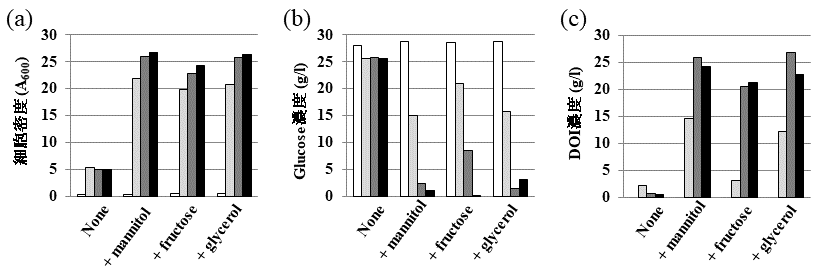

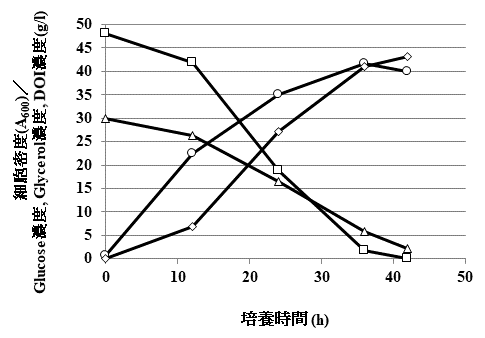
DOIは、その化学構造から塩基性条件下では異性化反応などが起こり分解することが予想されるように不安定な化合物であり、pHが中性付近でも大腸菌生育至適温度37℃で分解反応が進行した。そこでDOIの安定性について調べると、酸性・低温の条件下では安定であることがわかった。大腸菌の生育条件とDOIの安定性を考慮し、DOI生産の至適条件 (30℃、pH 6.0) を決定して、補助炭素源としてグリセロールを用い、ジャーファメンターによるDOI生産を行ったところ、約42時間で47.4 g/Lのグルコースを43.1 g/ LのDOIに変換することに成功した (図5)。その変換効率は、モル比換算でほぼ100%であった。ここに組換え大腸菌によるDOI高生産システムの開発に成功した。
![]()
4.バイオマスからのDOI生産の試み
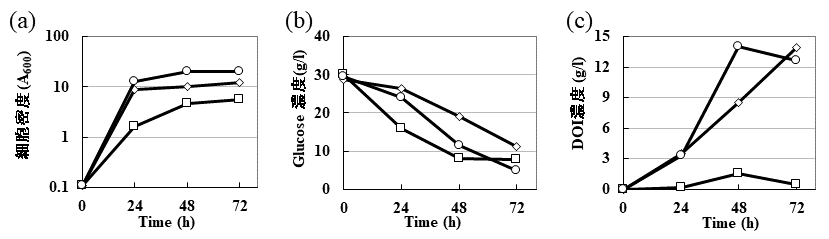
筆者らの研究室が所在する新潟県は、言わずと知れた米の産地である。米由来のバイオマスとしては、米糠、稲わら、汚染米などが挙げられる。この中から比較的手に入れやすい、米糠からのDOIの発酵生産を試みた。米糠の糖化は、アミラーゼ、セルラーゼ、プロテアーゼを用いた酵素処理により糖化を試み、糖化溶液中のグルコース濃度が3%になるように濃縮し、DOI生産用バイオマス培地として利用した。アミラーゼのみを用いて糖化したバイオマス培地におけるDOI生産組換え大腸菌の生育は悪く、さらにDOIの生産性も悪かった。しかしながら、アミラーゼ、セルラーゼを用いて糖化し、プロテアーゼでタンパク質を分解させたバイオマス培地におけるDOI生産組換え大腸菌の生育は非常に良く、DOI生産性もこれまで組換え大腸菌のDOI生産培地として利用してきた培地 (2YT+3% glucose+2% mannitol) と同様に高い生産性を示した (図6)。すなわち、米糠の糖化効率などに問題は残るが、DOI生産組換え大腸菌を利用して米糠から高効率でDOIを生産させることに成功した。

5.おわりに
バイオリファイナリーは、再生可能資源である植物・農産物やその副産物、廃棄物等のバイオマスから、糖、中間体を経て各種の有用化学製品、エネルギー源を製造しようとするものであり、21 世紀の産業革命である。また、我々は国家戦略として、バイオマスからエネルギー源だけでなく、汎用ポリマー原料など低価格でも石油製品に変わることができる化学品の製造も含めて、総合的、統合的に化学品の製造体系を作り上げることを目指していかなければならない。
本稿で紹介したバイオリファイナリー技術開発は、バイオマスから化学品を製造するものである。組換え大腸菌を利用して、グルコースから生成されたDOIは簡単に2価フェノールのヒドロキノンやカテコールに変換することができる。2価フェノール類は、現在、年間数千トンから数万トンが石油を原料に製造されている重要な工業薬品や医薬、農薬、香料等の原料である。すなわち、我々が今まで石油からのみ得ていた工業原料の2価フェノールが、バイオマスから大量に得ることが可能になったのである。しかしながら工業化のためには、いくつかの問題がある。
① 原料…食糧問題を引き起こさずに、安定した、信頼できる、手ごろな価格のバイオマスをバイオ産業に持続的に供給できるかどうか
② DOI変換技術の研究開発…DOI発酵生産時間の短縮化や利用バイオマスに対応した炭素源代謝システムの改良
③ 統合バイオリファイナリー…産官学の連携強化を通じて、商業的に受け入れられる性能とコスト目標を達成する統合技術の実証及び確認
このような問題を克服しながら本技術によりDOIを大量に得ることができるようになれば、様々な新規有用化学物質の開発にも大きく貢献することができ、バイオ関連産業は低迷する我が国経済活性化の起爆剤となる可能性がある。
謝辞
本稿で紹介した研究の一部は独立行政法人新エネルギー・産業技術総合開発機構の「平成20、21年度産業技術研究助成事業」の援助を受けて行われたものである。
文献
1) Kakinuma, K., Nango, E., Kudo, F., Matsushita, Y., Eguchi, T.: Tetrahedron Lett., 41, 1935 (2000).
2) Hansen, A. C., Frost, W. J.: J. Am. Chem. Soc., 124 (21), 5926 (2002).
3) Kudo, F., Tamegai, H., Fujiwara, T., Tagami, U., Hirayama, K., Kakinuma, K.: J. Antibiot., 52 (6), 559 (1999).
4) Castanie-Cornet, M. P., Foster, J. W.: Microbiology, 147 (Pt3), 709 (2001).
5) Kogure, T., Wakisaka, N., Takaku, H., Takagi, M.: J. Biotechnol., 129 (3), 502 (2007).
6) 小暮高久、脇坂直樹、高久洋暁、高木正道、鰺坂勝美、宮崎達雄、平山匡男: 「遺伝子発現カセット及び形質転換体、並びにこの形質転換体を用いた2-デオキシ-シロ-イノソースの製造方法及び2-デオキシ-シロ-イノソースの精製方法」国際公開番号WO2006/109479.