【トピックス】
微生物産生ポリエステル (PHBH) の発酵生産
松本圭司、佐藤俊輔、藤木哲也
カネカ・GP事業開発プロジェクト
1.はじめに
世界の平均気温は、1990年以降0.8℃程度上昇しているが、今世紀末までに更に1.1~5.6℃上昇することが米国専門家によって予測されている1)。
1997年に第3回気候変動枠組条約締約国会議 (CPO3) が開催され、地球温暖化を防止するため温室効果ガスの削減に向けた取組み (京都議定書:2005年2月発効) が開始された。地球温暖化に関する関心が高まる中で、昨年の国連総会において鳩山前首相が表明した「1990年比で2020年までに25%の温室効果ガス削減を目指す」との日本の中期目標は、各国の注目を浴びた。しかしながら、昨年末に開催された気候変動枠組条約第15回締約国会議 (COP15) は紛糾し、各国の地球温暖化防止に対する関心は高いものの具体的な実施に向けた足並みは揃っていないのが現状である。とはいえ地球温暖化防止は喫緊の課題である。
国内で生産されているプラスチックは年間約1400万トンであり、世界ではその約十倍にも及ぶ。これまで廃棄物処理や環境汚染といった課題解決に向けて生分解性プラスチックが注目されてきたが、温室効果ガスの削減の視点から環境調和型生分解性プラスチック (バイオマスプラスチック) が強く求められている。このためプラスチックの原料として化石資源から再生可能資源であるバイオマスへの転換が進められている。
一方で、現在68億人の世界人口は、2050年には90億を超えると推定されており、食糧問題が深刻化することが予想されている。数年前の原油高騰やバイオ燃料 (バイオエタノール、バイオディーゼル) の生産に伴う穀物や油脂価格の高騰は記憶に新しい。このため非可食資源への原料転換が強く求められるようになっている。
2007年の世界の生分解性プラスチックの需要は87,000トン (日本:8,000トン) と推定されており、毎年20%以上の伸びが予測されている。当社は、バイオマス由来の生分解性プラスチックが環境問題に加えて温室効果ガス削減といった課題も解決できると考え、循環型社会の構築を目指して微生物産生ポリエステルの実用化に向けた取り組みを行っている。本稿では、植物油脂を原料とした生分解性プラスチックPHBHの生産技術について菌株育種を中心に紹介する。また、非可食資源利用に関する取組みについても一部触れたい。
2.生分解性プラスチックPHBH
ポリヒドロキシアルカン酸 (PHA) は、微生物が菌体内に蓄積する熱可塑性高分子であり、生分解性を示すことから環境調和型プラスチックとして種々の応用が期待されてきた。PHAは主にC4、C5のR-3-ヒドロキシアルカン酸から成るshort-chain-length PHAs (scl-PHAs) とC6~C16のR-3-ヒドロキシアルカン酸から成るmedium-chain-length PHAs (mcl-PHAs) に分類されるが、その混合型も報告されている2)。これらのうちscl-PHAsについては優れた研究開発が行われ、複数の製品が開発されてきた。
我々はAeromonas caviaeが脂肪酸や油脂を炭素源としてR-3-ヒドロキシ酪酸 (3HB) とR-3-ヒドロキシヘキサン酸 (3HH) の共重合ポリエステル (3HB-co-3HH)(以下PHBHと略す) を生産することを見出した (図1)3)。PHBHは3HH組成比により硬質から軟質まで幅広い物性を示すことから、scl-PHAsに属するポリヒドロキシ酪酸 (PHB) やポリヒドロキシ酪酸とポリヒドロキシ吉草酸の共重合ポリエステル (PHBV) よりも広範な用途に適用できると考えられた (図2)。
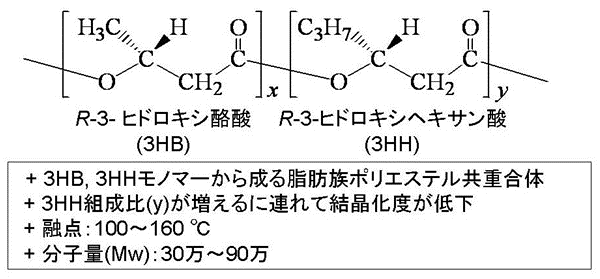
図1 PHBHの構造及び特徴
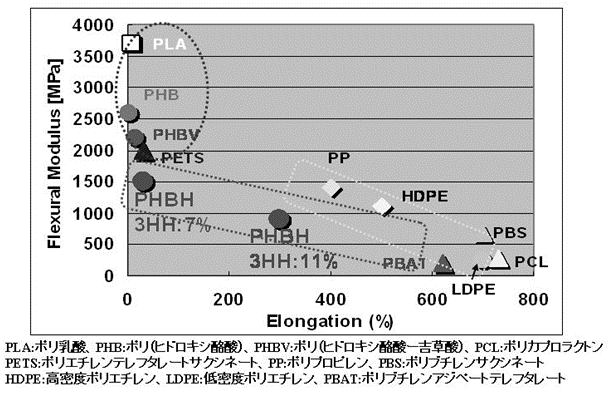
図2 代表的樹脂の伸び物性と弾性率
3.PHBH高生産株の育種
A.caviaeのPHBH生産性は著しく低く (10 g/L)、工業生産に適した株ではなかった。しかしながら、Fukui等によってA.caviaeよりPHBH合成酵素遺伝子 (phaCAC) 等がクローニングされたことからPHBH高生産株育種の可能性が得られた4)。PHBH合成酵素は、R-3HB-CoAとR-3HH-CoAを基質としてPHBHを合成する。
Cupriavidus necator (旧名:Alcaligenes eutrophus、Ralstonia eutropha) はPHBやPHBVの生産株として利用されてきた。Fukui等は、PHB生産能力を欠いたC. necator PHB-4株に広域宿主ベクターを用いてphaCACを導入し、PHBHを生産できるC.necator PHB-4 (pJRDEE32d13) を作成した。同菌株について植物油脂を炭素源として生産能力を検討した結果、培養時間72時間で乾燥菌体重量3.6 g/L、PHBH含量77% (3HH組成5%) の生産性を得た5)。我々は、同菌株の培養条件検討を行ない、培養時間72時間で乾燥菌体重量50 g/L、PHBH含量66% (3HH組成7.3%)、時間PHBH生産性0.46 g/L/hrを得た6)。しかしながら、PHBH生産性は工業的生産に適用できるレベルには至っておらず、また導入プラスミドの脱落による生産性低下の課題が顕在化した。更に、生産されるPHBHの3HH組成は硬質領域の7.3%であり、軟質PHBH (3HH組成10%以上) の製造技術開発も必要であった (図2)。
組換え微生物のプラスミドの安定化には多くの方法が報告されているが、主としてプラスミドを失った微生物が生存できない条件を設定することで培養の安定化を行っている。上記PHBH生産株では、培地に抗生物質を添加することで安定化を達成できるが、数千トン~数万トン (或いはそれ以上) 規模での発酵生産における抗生物質添加は排水処理や価格面等より事実上困難であり、代替技術の開発が必要であった。また、併せて革新的なポリマー生産性の向上が必要であった。そこで、我々は、宿主を野生株C.necator H16株に変更することで生産性の向上を目指し、かつPHBH生産に必須のphaCACを同宿主の染色体上に組込むことで安定化を試みた。更に、軟質PHBHの生産を視野に、PHBH合成酵素の基質であるR-3HH-CoAに対する基質特異性の向上した変異PHBH合成酵素遺伝子 (phaCACN149S/D171G) を利用した7,8)。
C.necator H16株のPHB合成酵素遺伝子群の構成を図3に示す。PHB合成酵素遺伝子 (phbCCN) を、当該遺伝子の上流および下流領域の相同組換えを利用してphaCACN149S/D171Gに置換した (図3)。作製されたKNK-005のPHBH生産能力をC.necator PHB-4 (pJRDEE32d13) と比較した (表1)。KNK-005には変異PHBH合成酵素遺伝子を用いていることから単純な比較は困難であるが、非常に高いPHBH生産性 (48時間培養:乾燥菌体110.4 g/L PHBH含量73,8% (3HH組成8%)、時間PHBH生産性1.70 g/L/hr) を示した9)。また、形質は安定に保持されておりPHBH生産を安定化することができた。
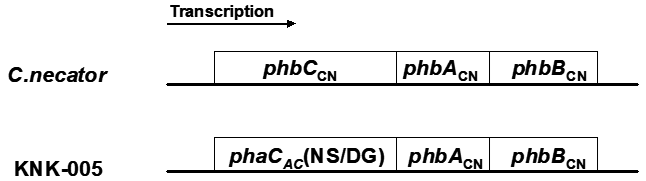
図3 C.necator、KNK-005のPHA合成酵素遺伝子構成
表1 KNK-005のPHBH生産能力

上記技術開発については、我々とは別にMifune等も同様の結果を報告している10)。現在PHBH生産性の向上を目指し、更に菌株の改良を進めている。生産株の一つのポリマー蓄積状況を図4に示した。一方、変異PHBH合成酵素遺伝子 (phaCACN149S/D171G) を用いたにもかかわらず3HH組成は10%以上を確保することができず、軟質PHBHの生産技術に課題を残した。
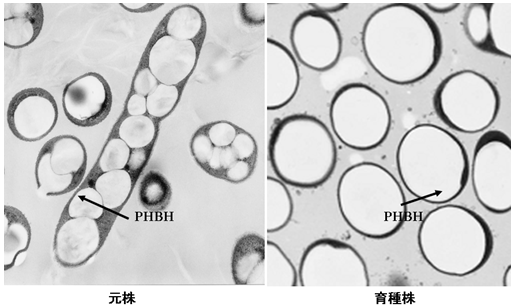
図4 PHBH生産株の電子顕微鏡写真
4.3HH組成のコントロール
図2に示すとおり3HH組成比により硬質から軟質まで幅広い物性を示すことから、PHBH発酵において3HH組成をコントロールする技術開発が重要である。
3HH組成は炭素源として使用する植物油脂の脂肪酸組成によって影響を受け、コーン油などの長鎖脂肪酸含量の高い油脂では3HH組成は低く (約3%:硬くて脆いPHBH)、中鎖脂肪酸含量の高いヤシ油では高3HH組成 (13.8%:柔軟なPHBH) を示すことが分かった6)。
C.necatorはphbA (β-ケトチオラーゼ)、phbB (アセトアセチル-CoA 還元酵素) を保有しており、両酵素の働きにより2分子のacetyl-CoAからR-3HB-CoAを合成することができる。このためR-3HB-CoAはβ-酸化経路の中間体 (S体は菌体内でR体に変換される) に加えて前記二量化経路からも供給される (図5)。長鎖脂肪酸と中鎖脂肪酸ではR-3HH-CoAに対して生産されるacetyl-CoAのモル当量が異なることから、長鎖脂肪酸を高含有する植物油脂を炭素源とすると菌体内のR-3HB-CoA濃度が上昇し、結果として低3HH組成のPHBHが生産されると解釈される。
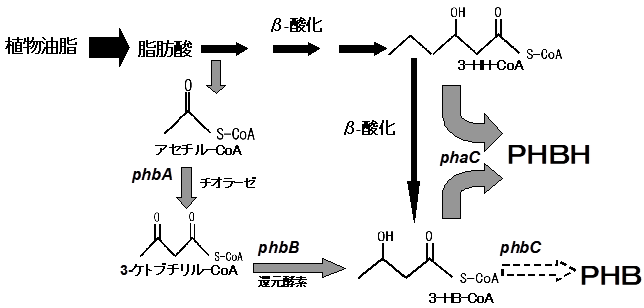
図5 組換えC.necatorにおける脂肪酸代謝経路およびPHBH合成経路
一方、R-3HB-CoAの供給経路を遺伝子レベルで調節することによっても3HH組成を調節することが可能と考えられる。そこで我々は、KNK-005のphbA、phbBの遺伝子発現を調節した株を種々作製した11)(表2)。これらの株について当該酵素活性 (表3) ならびに生産されるPHBHの生産性、3HH組成 (表4) を調べた。
表2 KNK-005および誘導株の遺伝子型

表3 KNK-005および誘導株のphbA、phbB酵素活性
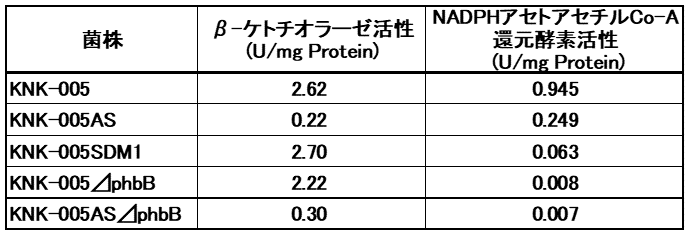
表4 KNK-005および誘導株のPHBH生産性と3HH組成
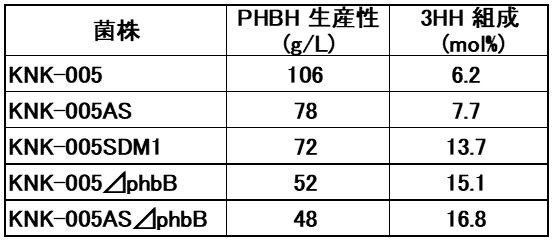
phbAの破壊株は、予想どおりβ-ケトチオラーゼ活性の著しい低下が観察されたが、3HH組成はあまり上昇しなかった。C.necatorはphbA以外にも複数のβ-ケトチオラーゼ遺伝子を有していることから、本遺伝子の破壊がR-3HB-CoA合成にほとんど影響を及ぼさなかったと考えられる。これに対して、phbBの破壊株やリボソーム結合部位変異株はアセトアセチル-CoA還元酵素活性が低下し、それに伴い3HH組成が向上した。またphbAの破壊に加えてphbBの発現を抑制した株では更に3HH組成が向上することがわかった。このようにR-3HBCoA供給経路の調節により軟質PHBHの生産が可能となった。しかしながら、これらの株ではKNK-005に比べてPHBH生産性が低下することから、PHBH生産性と3HH制御技術のバランスが重要と考えている。
以上PHBH生産株の育種について紹介してきたが、PHBH生産性や3HH組成には培地成分、温度、通気・攪拌、植物油脂の流加速度などが複雑に関連するため、培養工学的な視点からの取り組みを進めているところである。
5.PHBHの特徴
5-1 生分解性
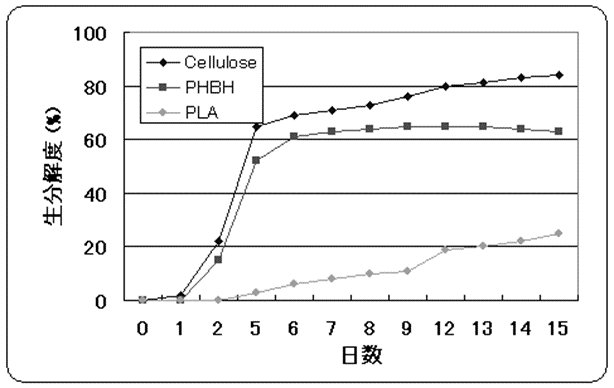
PHBHは好気的条件、嫌気的条件のいずれの条件下においてもすぐれた生分解性を示す。図6に嫌気的条件下での分解性を示した。PHBHは日本バイオプラスチック協会が認定するグリーンプラとしてポジティブリストに登録 (PL A42001) されている。
![]()
5-2 加工成形、用途
PHBHは射出成形、インフレーション或いはTダイ押し出しによるフィルム・シート成形、ブロー成形、ビーズ発泡、繊維、不織布成形が基本的に可能であることを確認している。成形加工例の一部を図7に示す。

図7 成形加工例
6.非可食炭素源の利用
マレーシアにおけるパーム油生産量は、2007年調べで1,836万トンであった。パーム油製造工程からは、脂肪酸リッチな画分 (PFAD (Palm Fatty Acid Distillate) など) が副産物として60万トン以上製造されており、工業原料として使用されている。また、大量の油脂成分が廃水 (POME (Palm Oil Mill Effluent)) として処理されており、LCA (Life Cycle Assessment) の観点から回収・再利用の必要性が論じられている。
予備的な検討によれば、KNK-005をはじめPHBH生産菌株は脂肪酸を資化できることがわかっている。今後、パーム油製造に伴う非可食資源を用いたPHBH発酵技術の開発を進めてゆく予定である。
7.おわりに
生分解性プラスチックPHBHの実用化に向けた取り組みにおいて、本稿で述べた生産株の育種に加え高密度培養技術開発、水系精製技術開発、樹脂加工技術開発を進め、工業化への目処を得ることができた。
現在、製造技術のスケールアップ検証や更なる樹脂加工技術開発と市場開発用樹脂の確保を目的に、実証生産設備 (2010年秋稼動、生産能力:約1,000トン/年) を兵庫県高砂市に建設している。
我々は、長期的視点より更に技術革新を進め、真に環境調和型生分解性プラスチックPHBHの普及を目指してゆく所存である。
文献
1) Global Climate Change Impacts in the United States, http://www.globalchange.gov/images/cir/executive-summary.pdf
2) Biopolymers, Edited by A.Steinbüchel, WILEYVCH
3) Shimamura, E., Kasuya, K., Kobayashi, G., Shiotani, T., Shima, Y., Doi, Y.: Macromolecules, 27, 878 (1994).
4) Fukui, T., Shiomi, N., Doi, Y.: J. Bacteriol., 179, 4821 (1997).
5) Fukui, T., Watanabe, Y., Hiroe, A., Tsuge, T.: App. Microbiol. Biotechnol., 49, 333 (1998).
6) 公開特許公報 特開2001-340078
7) 大窪雄二、長岡哲也、横溝 聡、太田明徳、高木正道、松本圭司: 2005年度農芸化学会大会講演要旨集、2005、258 (2005).
8) Tsuge, T., Watanabe, S., Shimada, D., Abe, H., Doi, Y., Taguchi, S.: FEMS Mirobiol. Lett., 277, 217 (2007).
9) 米国特許第7384766号
10) Mifune, J., Nakamura, S., Fukui, T.: Can. J. Chem., 86, 621 (2008).
11) 公開特許公報 特開2008-2921 8