【トピックス】
不斉水素添加触媒としての「旧黄色酵素」の機能開発
片岡道彦、浦野信行、堀田彰一朗、宮川拓也、田之倉優、清水 昌
阪府大院・生命環境、阪府大院・生命環境、東大院・農生科、東大院・農生科、東大院・農生科、京都学園大・バイオ環境
1.はじめに
キラル化合物 (光学活性化合物) は、医薬品の中間原料等としてその需要が増しており、高効率で選択的な調製法の開発は古くからの大きな研究テーマとして扱われている1-3)。 化学合成したラセミ体のジアステレオマー化による古典的光学分割法は現在でも多用されているが、微生物酵素の立体選択性を活かしたラセミ体の光学分割に関してもアミノ酸等の工業的生産プロセスに利用される例が増えている1-3)。
さらに、不斉中心を持たない化合物からキラル化合物を直接合成 (不斉合成) するための触媒開発も進められており、有機合成化学の分野では野依良治博士が開発したBINAP触媒等が世界的な注目を集めている4)。 一方、微生物酵素を用いた不斉合成に関しても古くから研究が行われており、中でもプロキラルなカルボニル化合物を酵素的不斉還元によりキラルアルコールに導く方法は、すでにいくつかの工業的生産プロセスに利用されている。この酵素的不斉還元反応を用いる手法は立体選択性が高く、キラルアルコール生産プロセスとして長年期待されてきたが、生産効率の面 (例えば、生成物濃度や光学純度等) で多くの問題を抱えていた。これを解決する手段のひとつとして、筆者らのグループでは、補酵素NAD(P)H再生系酵素遺伝子をカルボニル還元酵素 (アルコール脱水素酵素) 遺伝子とともに共発現させた微生物を触媒として用いる「バイオ還元システム」を開発し、酵素的不斉還元によるキラルアルコール類の効率的生産を実現している5)。
本バイオ還元システムは、カルボニル還元酵素が触媒する反応だけでなく、NAD(P)Hを要求する酵素反応であれば様々な用途に広く利用できると考えられた。そこで、このバイオ還元システムに適用可能なC=C結合不斉水素化酵素のスクリーニングを行った結果、「旧黄色酵素 (Old yellow enzyme) 」が不斉水素添加能という新たな機能を有していることを見出した。本稿では、不斉水素添加触媒としての旧黄色酵素の機能開発から構造生物学的解析による触媒機構の解明にいたる最近の知見を紹介する。
2.不斉水素添加触媒としての「旧黄色酵素」の再発見
著者らがC=C結合への不斉水素添加能を探索するきっかけとなったのは、図1に示した (4R,6R)–アクチノール (4-ヒドロキシ-2,2,6-トリメチルシクロヘキサノン) の立体選択的生産を目指してのことである。(4R,6R)–アクチノールは、天然型キサントフィル類の合成中間体として有用なキラル化合物であることから、不斉中心を持たないケトイソフォロン (KIP; 2,6,6-トリメチル-2-シクロヘキセン-1, 4-ジオン) を出発原料とした立体選択的合成ルートが報告されていた (図1)6)。 この報告では、まずパン酵母によりKIPのC=C結合を不斉水素化し、(6R)–レボジオン (2,2,6-トリメチルシクロヘキサン-1,4-ジオン) に変換した後、化学的還元反応により (4R,6R)–アクチノールへと導くものである。KIPのC=C結合の不斉水素添加反応は、パン酵母の他にもいくつかの微生物に見出されたが7-9)、 触媒する酵素・遺伝子の単離や諸性質の解明は行われていなかった。そこで、著者らはKIPを (6R)–レボジオンに変換する微生物の探索を新たに行ったところ、これまでに報告のなかったCandida macedoniensis等のいくつかの微生物に、KIPのC=C結合不斉水素添加能を見出すことができ、さらにC. macedoniensisより本反応を触媒する酵素の単離にも成功した10)。
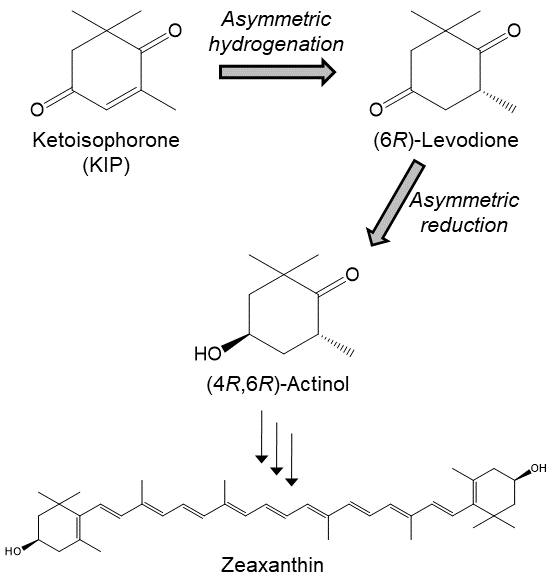
図1 KIPからの (4R,6R)–アクチノール合成経路とその応用
本酵素は、NADPHを還元反応のエネルギー源としてKIPや2-シクロヘキセノン等のα,β-不飽和カルボニル化合物 (エノン類) に広く作用することや、その吸収スペクトルからフラビンを補酵素とすることが明らかとなった。さらに、内部ペプチドのアミノ酸配列分析を行った結果、パン酵母等から単離されていた旧黄色酵素 (NADPH dehydrogenase; EC 1.6.99.1) と高い相同性を示すことが判明し、その基質特異性やフラビン酵素であることと合わせて、本酵素も旧黄色酵素ファミリーに属することが示唆された。旧黄色酵素は、1932年にWarburgらによりフラビン酵素の最初の例として単離された酵素であり11)、 その名前の由来については他の文献12,13)を参照されたい。旧黄色酵素は、フラビン酵素の最初の単離例ということもあり、これまでに様々な研究が行われてきた。特に、フラビン酵素としての反応機構の解明については、Masseyらの研究グループにより精力的に行われ、その反応機構が明らかにされている13-17)。 旧黄色酵素の典型的な基質である2-シクロヘキセノンの場合、NADPHから電子を受け取って還元型となったフラビン補酵素のイソアロキサジン環に、基質の6員環が平行に重なるように結合し、フラビンのN5位から基質のα位の炭素原子に水素転移が起こると同時に、基質を挟んでフラビン補酵素と逆側に位置するチロシン残基の水酸基からβ位の炭素原子へのプロトンの引き抜きが起こることで、基質のC=C結合に対して水素のtrans付加が成立する (図2)。 2-シクロヘキセノンが基質の場合は、trans付加による水素添加が起こってもキラル中心は生まれないが、α位またはβ位 (あるいは両方) に置換基が入っていると、不斉炭素原子が生じキラル化合物が生産されることになる。このように詳細に解析が行われていた旧黄色酵素の反応機構を基に考えれば、本酵素をC=C結合の不斉水素添加触媒としてキラル化合物の合成に利用することは容易に予想できたのかもしれない。しかし、実際には著者らのグループでC=C結合の不斉水素添加能を持つ微生物酵素の探索を行った結果として、旧黄色酵素にその触媒能を見出すこととなった。酵素反応機構の基礎的な解析と物質生産を結びつけることの難しさを改めて感じる結果となった。
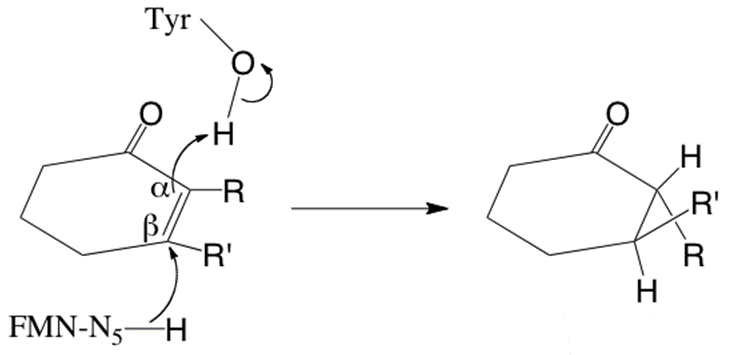
![]()
3.旧黄色酵素を利用したキラル化合物の生産
C. macedoniensisから得られた旧黄色酵素 (CYE) を用いて、KIPからの (6R)–レボジオンへの変換反応を試みた。CYE遺伝子をNAD(P)H再生系酵素 (グルコース脱水素酵素; GDH) 遺伝子とともに共発現させた大腸菌菌体を直接触媒として、KIP変換反応を行った結果、100 g/LのKIPをほぼ定量的かつ立体選択的に (6R)–レボジオンへと変換することに成功した18)。 さらに、(6R)–レボジオンを (4R,6R)–アクチノールに変換する酵素として、すでにCorynebacterium aquaticumより取得されていたレボジオン還元酵素 (LVR)19)と組み合わせることで、KIPから (4R,6R)–アクチノールへの2段階変換反応を試みた。この場合も、GDH遺伝子とともにLVR遺伝子を共発現させた大腸菌を構築し、CYE-GDH遺伝子共発現大腸菌とLVR-GDH遺伝子共発現大腸菌の菌体を触媒として同時に用い、KIP→ (6R)–レボジオン→ (4R,6R)–アクチノールの変換を試みた。その結果、基質KIPは速やかに消費されたものの、予想とは異なり (4R,6R)–アクチノールの蓄積は少量で、その代わりに (4S)–フォレノール (4-ヒドロキシ-2,6,6-トリメチル-2-シクロヘキセノン) の大量蓄積が見られた (図3a)。(4S)–フォレノールは、KIPの4位のカルボニル基がLVRにより先に還元された結果生じたもので、CYEが (4S)–フォレノールのC=C結合を不斉水素化できないために蓄積してしまったことが明らかとなった (図4)。
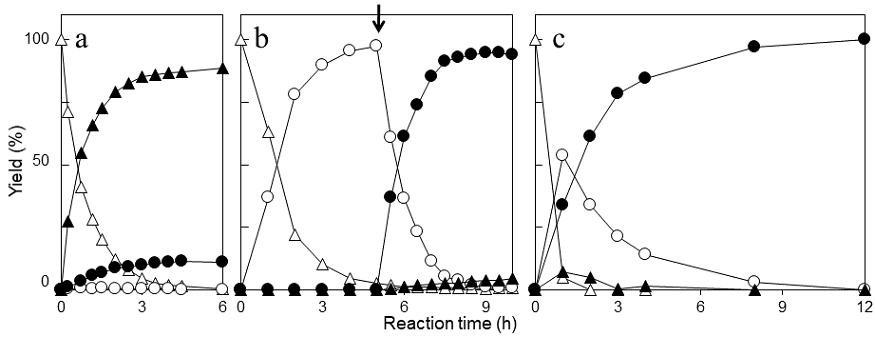

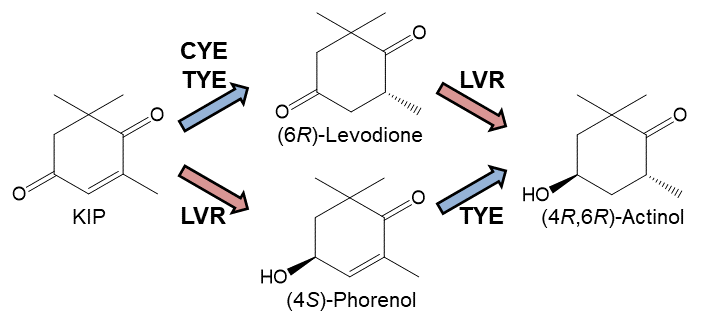
図4 KIPから (4R,6R)–アクチノールへの変換経路と各反応を触媒する酵素
KIPの不斉水素化活性はパン酵母由来の旧黄色酵素 (OYE2, OYE3) にも認められたが、CYEと同様に (4S)–フォレノールに対する活性が低く、これらの酵素とLVRの組み合わせによるKIP変換反応の結果も、CYEとの組み合わせと同様の結果となった20)。 そこで、(4S)–フォレノールの蓄積を抑え、KIPから (6R)–レボジオンを経て (4R,6R)–アクチノールへ変換するために、CYEによる1段階目の反応とLVRによる2段階目の反応を分けて行った。CYE-GDH遺伝子共発現大腸菌を触媒とするKIPから (6R)–レボジオンへの変換反応の終了後、LVR-GDH遺伝子共発現大腸菌を反応液に加えて (6R)–レボジオンから (4R,6R)–アクチノールへの変換反応を行った結果、100 g/LのKIPがほぼ定量的かつ立体選択的に (4R,6R)–アクチノールへと変換することに成功した (図3b)。
4.基質特異性の異なる旧黄色酵素の探索と発見
2段階変換反応により、KIPからの (4R,6R)–アクチノール生産という所期の目的は達成したが、やはり2段階反応を同時に行わせることができればより効率的な生産プロセスが可能になる。そのためには、(4S)–フォレノールに対してもKIP同様に作用するC=C結合不斉水素添加酵素の入手が必要となる。そのアプローチとしてはいくつかの手法が考えられ、例えばCYEへのランダム変異導入による進化工学的改変やCYEの結晶構造解析に基づいたタンパク質工学的改変といったものがあげられる。筆者らはここでもう一度原点に立ち戻り、(4S)–フォレノールを基質としたC=C結合不斉水素添加酵素の新たな探索を試みた。
その結果、いくつかの微生物に (4S)–フォレノールのC=C結合を不斉水素化して (4R,6R)–アクチノールに変換する活性が見出された。その中から酵母Torulopsis sp.を選び、関与する酵素の単離と諸性質の解明を行った結果、本酵素もまた旧黄色酵素ファミリーに属することが明らかとなった。唯一CYEと大きく異なる点としては、KIPと同様に (4S)–フォレノールに対しても高い活性を示したことである (表1)。 近年、進化工学的手法やタンパク質工学的手法で酵素機能を作りかえていくことが有効な手段として多用されるようになったが、長い年月を経て多様性を増した自然界からの探索も決して引けを取らない手法であることが理解できる。このようにして、KIPと(4S)–フォレノールの両者に作用するTorulopsis sp.由来の旧黄色酵素 (TYE) が得られたことから、LVRとの組み合わせでKIPから2段階同時反応による (4R,6R)–アクチノール生産を試みた。最終的に、ひとつの大腸菌の中でCYE, TYE, LVR, GDHの4種の酵素遺伝子をすべて発現させ、この大腸菌菌体を触媒としてKIP変換反応を行った結果、(4S)–フォレノールの一時的な蓄積も認められたが、最終的に50 g/LのKIPを定量的に (4R,6R)–アクチノールに導くことができた (図3c)。

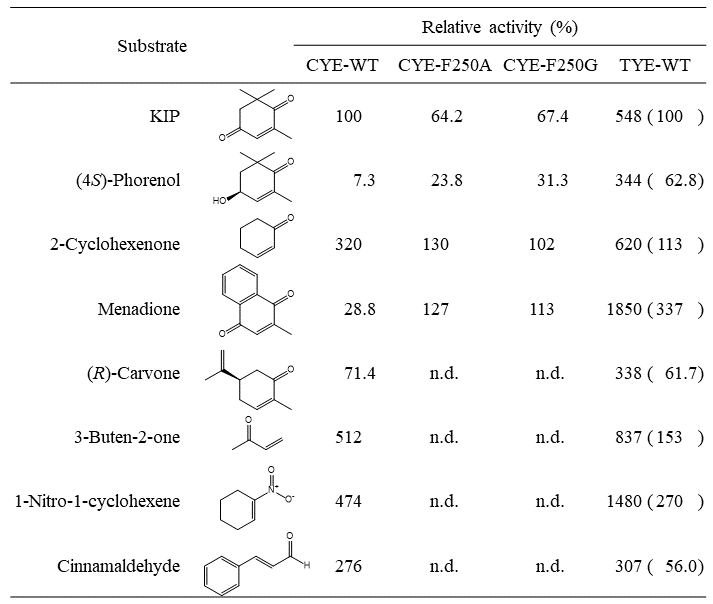
5.CYEおよびTYEの結晶構造解析
前述の通り、2種の旧黄色酵素CYEおよびTYEを見出したが、両酵素の大きな違いは (4S)–フォレノールに対する活性の違いである。旧黄色酵素の基質となる化合物に共通する構造は、エノン骨格 (α,β-不飽和カルボニル基) を有している点であり、2-シクロヘキセノンや3-ブテン-2-オンといった化合物が典型的な基質として報告されており、CYEやTYEにおいてもこれらがよい基質となることが確認されている (表1)。 KIPや (4S)–フォレノールもエノン骨格を持つ化合物でありCYEおよびTYEの基質となるが、これらの酵素がKIPのエノン骨格をどの方向に認識しているかが不明である。すなわち、図5に示したように、(4S)–フォレノールの場合は一方向の配向しか取れないが、KIPの場合は2種類の可能性 (1位のカルボニル基を含むエノンと認識するか、4位のカルボニル基を含むエノンと認識するか) が考えられる。どちらの配向を取ったとしても、KIPからの生成物は、(6R)–レボジオンとなってしまうため、反応産物からは区別できない。そこで、KIPと構造の類似した化合物である3-メチル-2-シクロヘキセノンやイソフォロンがCYEやTYEの基質となるかどうかを試したところ、いずれも全く反応しなかった。すなわち、エノン骨格のβ位にメチル基が入ると基質とならないことを示している。このことから、KIPにおいても同様β位にメチル基が存在する配向ではなく、α位にメチル基が存在する配向で (1位のカルボニル基を含むエノンとして) 酵素に結合しているものと推定された。(4S)–フォレノールもまたβ位に置換基を持たないエノン化合物である。
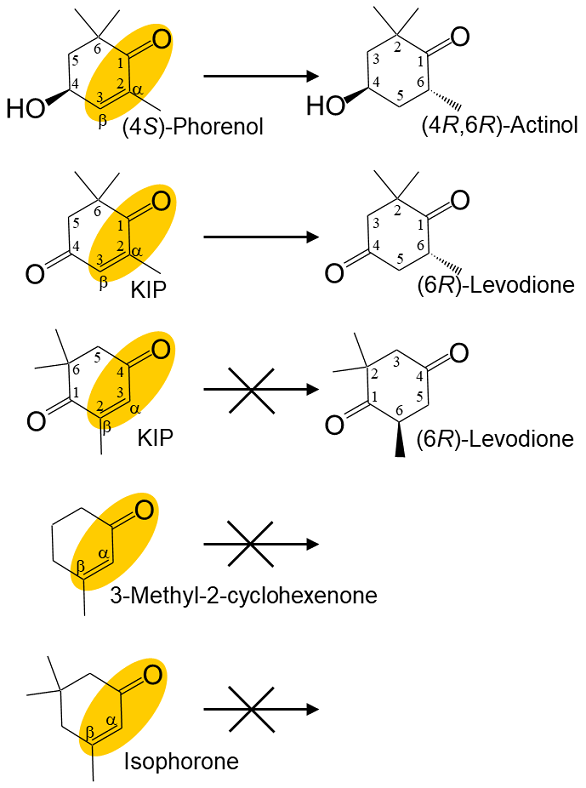
図5 旧黄色酵素によるエノン骨格の認識様式
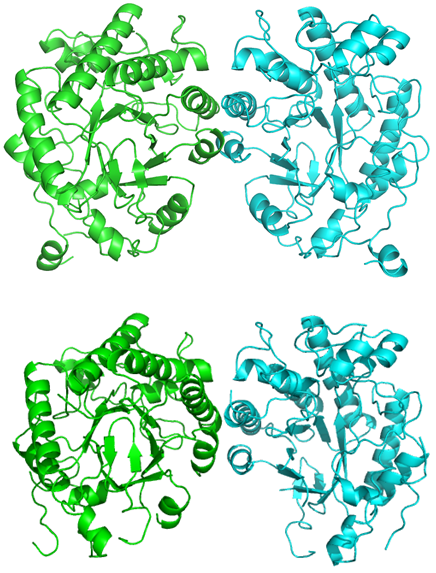
図6 CYE (上) およびTYE (下) の結晶構造
次に、CYEとTYEの (4S)–フォレノールに対する基質特異性の違いがどのような分子メカニズムによって引き起こされているのかを構造生物学的手法で明らかにすることを試みた。CYEおよびTYEをX線結晶構造解析により、それぞれ1.9Åおよび2.0Åの分解能で構造決定に成功した (図6)。 それぞれサブユニットあたり1個のFMNが結合した構造データが得られた。パン酵母由来の旧黄色酵素はすでに構造決定がなされており、基質結合様式や反応機構に関する詳細な解析が行われている13-17)。 そこで、この知見を基に、CYEおよびTYE両酵素の反応中心付近の重要なアミノ酸残基を推定し、これらの配置を比較したところ、多くの残基が両酵素間でほぼ同じ位置に配置されているのに対して、唯一CYEのPhe250残基とTYEのPhe246残基の位置が大きくずれていることが明らかとなった (図7)。 さらに、(4S)–フォレノールとCYEあるいはTYEとの基質結合モデルを構築し、このPhe残基の位置の違いによる基質結合への影響を推察した。その結果、(4S)–フォレノールの6位に結合した2つのメチル基のひとつが、CYEのPhe250残基の側鎖部分と重なり合うことが明らかとなった (図8)。 一方、TYEでは対応するPhe246残基の位置が活性部位を広げる形でずれていることで、(4S)–フォレノールの6位のメチル基を許容するだけの空間的余裕があることが推察された。これらの推察を実験的に確かめるために、CYEのPhe250残基をGlyやAlaといった小さな側鎖をもつアミノ酸に置換した変異体を作成し、(4S)–フォレノールに対する活性を確認した。その結果、(4S)–フォレノールに対する活性が、これらの変異体CYEでは野生型CYEに対して約4倍程度に上昇していることが判明し (表1)、 構造解析から推察された基質選択性の構造基盤の一部を解明することに成功した。しかし、ここで推定した (4S)–フォレノールの6位のメチル基による基質選択機構については、KIPに関しても同様のことが当てはまる。すなわち、KIPも (4S)–フォレノールと同様に6位に2つのメチル基が結合しているため、CYEへのKIP結合が妨げられるはずである。TYEと比較すると、CYEのKIPに対する活性はかなり低いことから、やはりPhe250残基によるKIP結合への影響もあるものと推定される。さらに、CYEの (4S)–フォレノールに対する活性は、KIPに対する活性と比べると約1/10以下と圧倒的に低い。KIPと (4S)–フォレノールでは、4位がカルボニル基であるか水酸基であるかの違いがあり、この違いがKIPと (4S)–フォレノールのCYEへの結合における違いを産み出しているのかもしれない。現在、さらに詳細な基質認識機構の解明を進めている。
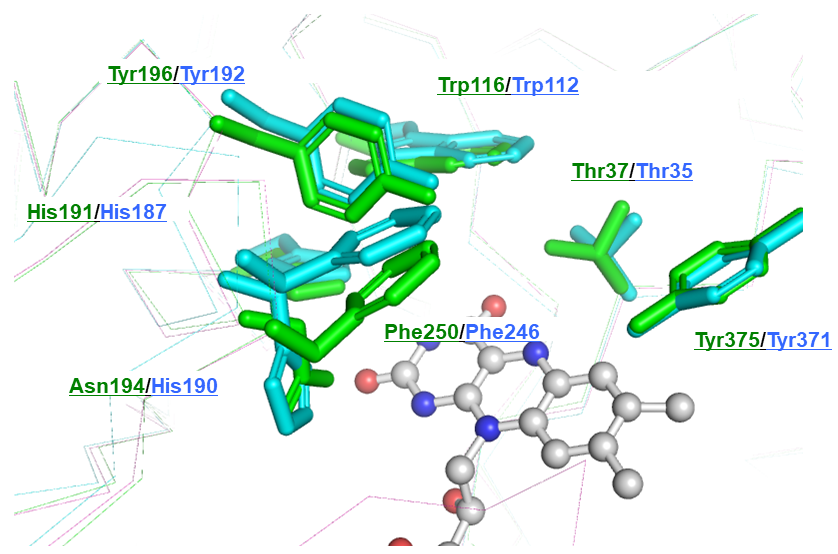
図7 CYE (緑) およびTYE (シアン) の活性中心付近のアミノ酸残基の配置比較
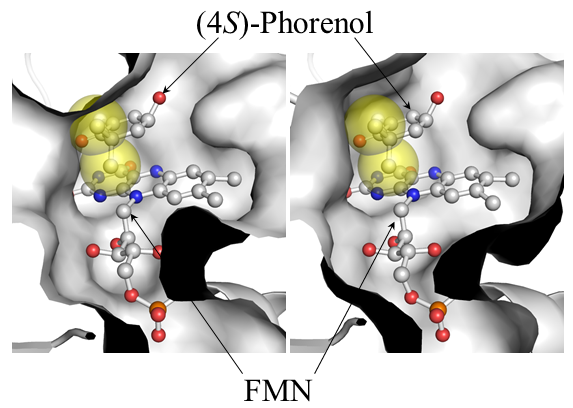
図8 CYE (左) およびTYE (右) の (4S)–フォレノール結合モデル
6.まとめ
旧黄色酵素は、古くから多くの基礎的な研究がなされてきた酵素であるが、近年C=C結合の不斉水素添加触媒として注目され、有機合成化学分野でのさらなる研究が進んでいる12,21)。 筆者らの研究グループでも、今回得られた旧黄色酵素の構造データに基づく高機能化を図り、様々な化合物のC=C結合を不斉水素化できる旧黄色酵素の創成を進めていきたい。
本研究の一部は「文部科学省ターゲットタンパク研究プログラム」の援助のもと行われたものであり、深く感謝の意を表する。また、本研究の大部分は京都大学大学院農学研究科応用生命科学専攻で行われたものである。
文献
1) 中井武、大橋武久監修:キラルテクノロジー、シーエムシー出版 (2004).
2) 大橋武久監修:キラルテクノロジーの進展、シーエムシー出版 (2006).
3) 大橋武久監修:キラル医薬品・医薬中間体の研究・開発、シーエムシー出版 (2010).
4) Noyori, R., Ohkuma, T.: Angew. Chem. Int. Ed. Engl., 40, 40 (2001).
5) Kataoka, M., Kita, K., Wada, M., Yasohara, Y., Hasagawa, J., Shimizu, S.: Appl. Microbiol. Biotechnol., 62, 437 (2003).
6) Leuenberger, H. G., Boguth, W., Widmer, E., Zell, R.: Helv. Chim. Acta, 59, 1832 (1970).
7) Hori, N., Hieda, T., Mikami, Y.: Agric. Biol. Chem., 48, 123 (1984).
8) Yamazaki, Y., Hayashi, Y., Hori, N., Mikami, Y.: Agric. Biol. Chem., 52, 2919 (1988).
9) Nishii, K., Sode, K., Karube, I.: Appl. Microbiol. Biotechnol., 33, 245 (1990).
10) Kataoka, M., Kotaka, A., Hasegawa, A., Wada, M., Yoshizumi, A., Nakamori, S., Shimizu, S.: Biosci. Biotechnol. Biochem., 66, 2651 (2002).
11) Warburg, O., Christian, W.: Naturwissenschafte, 20, 688 (1932).
12) 片岡道彦:ビタミン, 81, 631 (2007).
13) Karplus, O. A., Fox, K. M., Massey, V.: FASEB J., 9, 1518 (1995).
14) Kohli, R. M., Massey, V.: J. Biol. Chem., 273, 32763 (1998).
15) Xu, D., Kohli, R. M., Massey, V.: Proc. Natl. Acad. Sci. USA, 96, 3556 (1999).
16) Brown, B. J., Hyun, J. w., Duvvuri, S., Karplus, P. A., Massey, V.: J. Biol. Chem., 277, 2138 (2002).
17) Fox, K. M., Karplus, P. A.: Structure, 2, 1089 (1994).
18) Kataoka, M., Kotaka, A., Thiwthong, R., Wada, M., Nakamori, S., Shimizu, S.: J. Biotechnol., 114, 1 (2004).
19) Wada, M., Yoshizumi, A., Nakamori, S., Shimizu, S.: Appl. Environ. Microbiol., 65, 4399 (1999).
20) Wada, M., Yoshizumi, A., Noda, Y., Kataoka, M., Shimizu, S., Takagi, H., Nakamori, S.: Appl. Environ. Microbiol., 69, 933 (2003).
21) Toogood, H. S., Gardiner, J. M., Scrutton, N. S.: ChemCatChem, 2, 892 (2010).