【トピックス】
大腸菌によるイソプロパノール生産
花井泰三
九大院・農
1.はじめに
近年の不安定な石油価格とCO2ガス削減の観点からバイオ燃料およびバイオプラスチックなど、生物変換による石油代替物に関心が集まっている。生物変換により得られるバイオアルコールのうちイソプロパノールは、エタノールより炭素を一つ多く有した二級アルコールであり、新しいバイオ燃料の候補として期待されている。また、オイルをイソプロパノールとエステル化したバイオディーゼルは、メタノールを用いた一般的なバイオディーゼルより低温で凝固しにくいという利点がある1)。さらに、イソプロパノールは、プラスチックとして広く利用されているプロピレンの材料になることから、グリーンケミストリーの観点からも重要な目的生産物となる2)。これらのことから、イソプロパノールの微生物による生産は重要性を増すと期待できる。
イソプロパノールは、一部のClostridium属細菌によって生産される。しかし、これらの微生物は遺伝子組換えが比較的難しく、代謝制御も完全には解明さない。一方、大腸菌はもっとも詳しく調べられている微生物の一つで、遺伝子工学的手法によってもっとも改変しやすい微生物の一つである。もし、大腸菌にイソプロパノール合成経路を導入することが出来れば、代謝工学の手法を用いることで、より容易にイソプロパノール生産の最適化が可能になるであろう。
このような背景から、我々はイソプロパノール代謝経路を大腸菌内に合成し、グルコースからイソプロパノールの生産を実現した3)。また、培養条件の最適化とガスストリッピング法により生産物阻害を回避することで、大量生産を実現することができた4)。
2.実験方法
イソプロパノール生産菌として知られるClostridium beijerinckiiは、4つの酵素によって、Acetyl-CoAからアセトンを経由し、イソプロパノールを生産する (図1のボックス)。まず、Acetyl-CoA acetyltransferase (ACoAAT) は2分子のacetyl-CoAから1分子のacetoacetyl-CoAを生産する5)。次に、Acetoacetyl-CoAと酢酸からアセト酢酸とacetyl-CoAがacetoacetyl-CoA-transferase (ACoAT) によって変換される6)。さらに、acetoacetate decarboxylase (ADC) によって、アセト酢酸がアセトンに変換される7)。最後にsecondary alcohol dehydrogenase (SADH) が、NADPHを利用してアセトンをイソプロパノールに変換する8)。我々は、このC. beijerinckiiのイソプロパノール生産関連酵素群を大腸菌に遺伝子導入し、分子育種を行った。
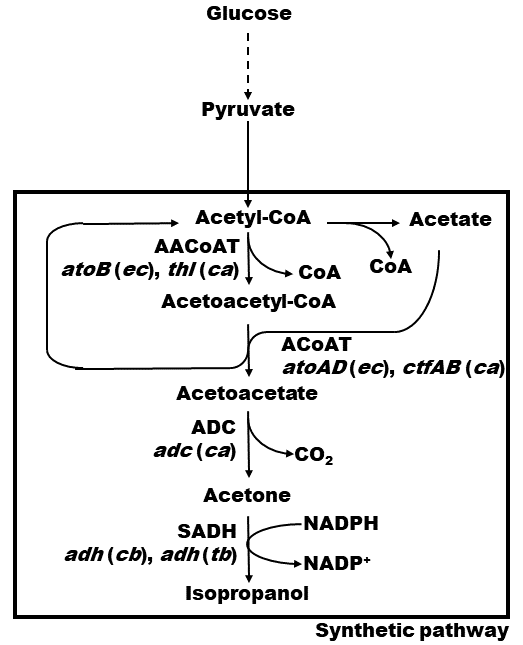

すでに、Papoutsakiらは、thlプロモータ制御下のC. acetobutylicum ATCC824のthl (ACoAAT)、ctfAB (ACoAT)、adc (ADC) 遺伝子をE. coli ATCC10303に導入し、三角フラスコの回分培養でアセトンを40 mM生産することに成功している9)。一方、大腸菌もACoAATおよびACoATの酵素遺伝子atoB、atoADを有している10)ことが知られている。そのため、我々はこれらC.acetobutylicum ATCC824、E. coli K-12 MG1655由来の遺伝子がイソプロパノール生産におよぼす影響を調べることとした。また、SADHの遺伝子としては、イソプロパノール生産菌であるC. beijerinckii NRRL B593のadh (cbadh) およびThermoanaerobacter brockii HTD4のadh (tbadh) の遺伝子配列が既知で、大腸菌内で機能発現することが知られている11)。そのため、これらの遺伝子が、イソプロパノール生産量におよぼす影響を調べることとした。
E. coli ATCC10303のゲノム上に、lacIq遺伝子を導入したTA11株を作成し、この株にイソプロパノール生産遺伝子を導入した。SADHはmedium copyプラスミド、その他の遺伝子はhigh copyプラスミドに導入した。すべてのプラスミドは、IPTGで誘導されるプロモータ (PLlacOI) を使用した。また、前培養は2 wt%グルコースを含むSD-7培地、本培養は2 wt%グルコースを含むSD-8培地を用いた。なお、本培養は250 ml三角フラスコを用い、25 mlの培養液で行った。
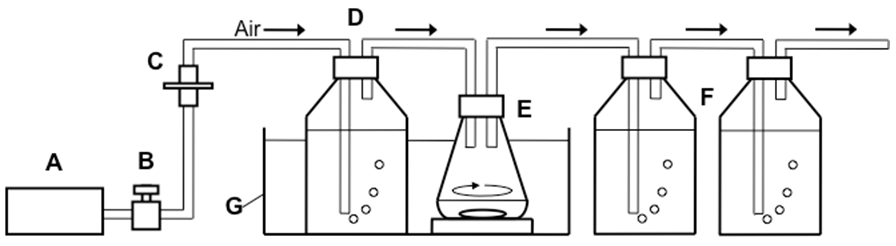
ガスストリッピング法を利用したイソプロパノール生産には、図2に示すような装置を作成した。培養液からの水分の蒸発を減らすため、フィルター滅菌された空気を水に流入させ、水で飽和させた。その空気を、25 ml培養液を含むバッフル付き300 mlフラスコに上面通気し、生産されたイソプロパノールなどを空気から分離し、回収するために、1 Lの水を有する二つの回収瓶の中に流入させた。培養液からのイソプロパノール揮発速度が発酵生産速度より大きくなるように、通気量は25 ml/min (1 vvm) と決定した。ウオーターバスの温度を30℃に設定し、培養液はスターラーバーで回転させた。12時間おきにサンプリングし、pH調整とグルコースの添加を行った。また、細胞増殖速度が低下した際には、濃縮培地を添加した。

3.イソプロパノール生産大腸菌の育種
Acetyl-coAからイソプロパノールまでの遺伝子 (thl、ctfAB、atoB、atoAD、adc、cbadh) 組み込みイソプロパノール生産実験を行った。グルコースが枯渇するまでの間で、もっともイソプロパノール生産量が高かった濃度を比較したところ、atoADを有する株がctfABを有する株よりも高いイソプロパノール濃度を得ることがわかった。また、エタノール濃度は、どの遺伝子の組み合わせでも10 mM以下となった。アセトン濃度はエタノール濃度と同じく低く、効率よくアセトンからイソプロパノールに変換されていた。最も高いイソプロパノール濃度が得られたthl、atoAD、adc、cbadhを有する株 (TA11 /pTA36+pTA39) のADHをcbadh (pTA36) から、tbadh (pTA18) に変更したところ、生産されたイソプロパノール濃度は大きく減少し、その分アセトン濃度が高くなった。最もイソプロパノールを生産した株 (TA11 /pTA36+pTA39) のタイムコースデータを図3に示す。IPTGによる発現誘導後からグルコースの枯渇まで、イソプロパノールは生産され、グルコースの枯渇後は減少した。24 hに2 wt%となるようにグルコース溶液を添加したところ、速やかに資化され、30.5 hには枯渇した。グルコースの再添加後、この株は再度イソプロパノールを生産し、最終濃度は81.6 mMとなった。アセトン濃度は、グルコースの枯渇後、さらに増加し、グルコース再添加後、減少し、グルコースが再度枯渇に近づくとまた生産されるという現象が観察された。
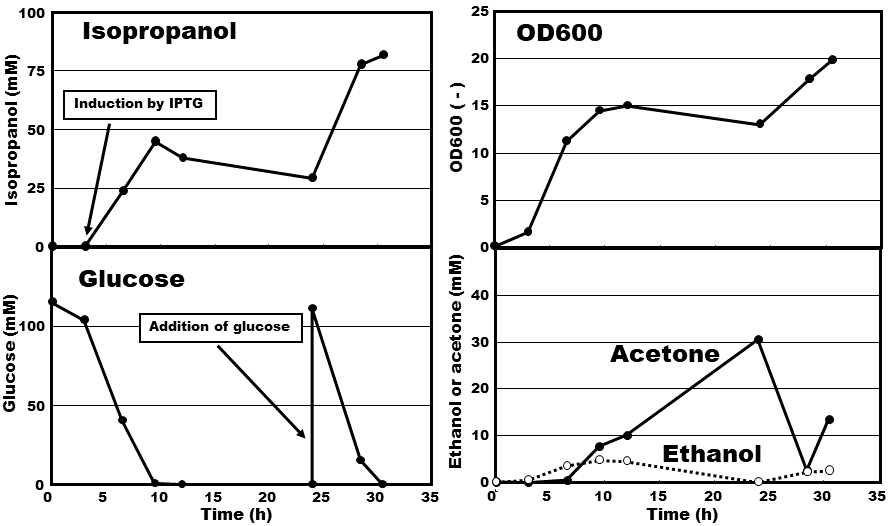
図3 初期のイソプロパノール生産の経時変化
ACoATとして、ctfABよりatoADを用いた方が、イソプロパノール生産に有利になる実験結果が得られた。これは、atoADとctfABの酵素反応速度定数を比較した場合、atoADのVmaxはより大きく、ctfABの酢酸に対するkm値がatoADに比較してとても大きいためである12,13)。一方、atoBとthlのイソプロパノール生産量に大きな違いが見られなかった。これは、thlおよびatoBの速度定数はそれほど大きな差がないためである4,5)。実験結果からtbadhのアセトンからイソプロパノールへの反応速度は、cbadhよりも低いと考えられた。これは、単位タンパク質量あたりのcbadhの活性はtbadhの二倍以上高いためである10)。グルコースの枯渇後、イソプロパノール濃度が44.8 (9 h) から29.1 mM (24 h) に減少した。この現象の主な原因としては、グルコース枯渇後、イソプロパノールからアセトンに変換することでNADPH等を細胞が得ていると予想された。
イソプロパノール生産実験では、グルコースを添加した際の最高濃度は81.6 mM (30.5 h)、最高生産速度は6.9 mM/h (3-9.5 h) となった。現在入手可能なイソプロパノール生産菌で、知られている最も生産量が高いC. beijerinckii NRRL B593は、最高濃度が約30 mM、最高生産速度が3 mM/hである13)。今回利用したイソプロパノール生産代謝経路では、理論的には最大1 molのグルコースから1 molのイソプロパノールが生産される。本研究の発現誘導時から12 hまでの転換率は、理論最大転換率の43.5%であった。
4. ガスストリッピング法によるイソプロパノールの大量生産
当初の発酵試験で培養開始直後からpHが低下し、グルコースが短期間で枯渇するため、培養期間を通じpH調整とグルコースの添加を行った。この結果、培養開始後60 hまで、イソプロパノールは順調に生産され続け、その濃度は673 mMとなった。この時の対糖収率は81.0%となった。生産が停止した理由を調べてみると、イソプロパノール濃度が600 mM以上となると、急激に増殖と生産に阻害がかかることがわかった。
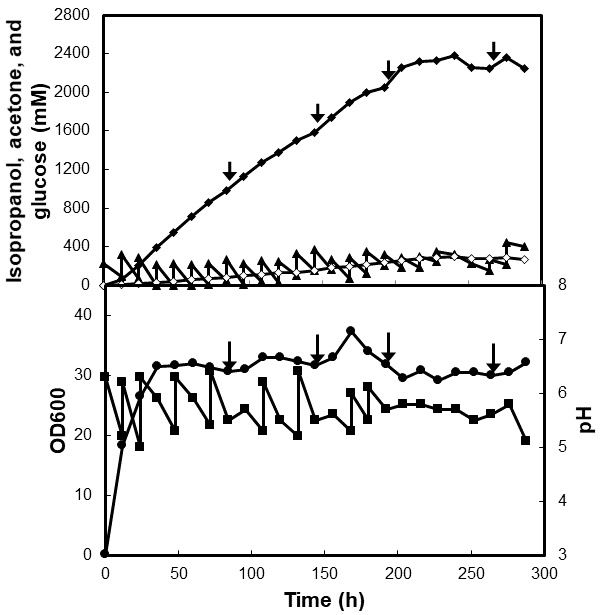
イソプロパノールによる生産物阻害を回避するため、揮発性物質の除去法として有用と考えられるガスストリッピング法14) を用いた発酵試験を行った。pH調整とグルコース添加を行ったところ、168 hまで、イソプロパノールは生産され続けた。この時、培養期間を通じて、培養液中のプロパノール濃度は400 mM以下となり、生産物阻害は回避された。培養液と二つの回収瓶で回収されたイソプロパノールを合計し、培養液にすべて溶解しているとして計算した実効生産濃度は、1358 mMとなった。この培養で、イソプロパノール生産停止後に濃縮培地を添加したところ、生産が回復した。このことから、培地成分の枯渇が考えられた。そのため、細胞増殖速度が低下した際に、濃縮培地を添加する新たな長時間培養を行った。その結果を図4に示す。イソプロパノールは240 hまで生産され続け、実効生産濃度は2378 mM (148 g/L) となり、満足のいく結果が得られた。ただし、対糖収率は67.4%とやや低くなった。これは、上面に通気を行うことで、未反応のアセトンが培養液から蒸発し易くなったためである。アセトンを含めた対糖収率は、ガスストリッピング法を用いていない場合により近い、75.8%となった。また、平均生産速度は、10.2 mM/h (0.64 g/Lh) となり、さらなる向上が望まれた。

5.おわりに
大腸菌では生産されないイソプロパノールの生産を目指して、大腸菌が本来有していない代謝経路酵素遺伝子群の導入を行い、合成代謝経路を実現し、初めてイソプロパノール生産大腸菌を生み出すことができた。この生産菌は、従来からの生産菌であるClostridium属細菌以上のイソプロパノール生産速度、生産量を達成した。また、ガスストリッピング法により、イソプロパノールの生産物阻害を回避し、148 g/Lのイソプロパノール生産を達成することができた。
今後は、メタボロームデータを利用した代謝流速解析や代謝シミュレーションなどの理論解析を利用することで、競合する代謝経路遺伝子の効率的な破壊を行い、代謝経路の最適化を行う予定である。
謝辞
なお、本研究の一部は、神戸大学の近藤昭彦先生と共同で、独立行政法人新エネルギー・産業技術総合開発機構 (NEDO) のプロジェクトとして採択され、委託業務の結果得られたものである。また、イソプロパノール生産大腸菌の育種については、UCLA留学中にJames C. Liaoラボで得られた結果である。
文献
1) Lee, I., Johnson, L. A., Hammond, G. E.: J. Am. Oil Chem. Soc., 72, 1155 (1995).
2) Palsson, P. O., Fath-Afshar, S., Lightfoot, E. N.: Science, 213, 513 (1981).
3) Hanai, T., Atsumi, S., Liao, J. C.: Appl. Environ. Microbiol., 73, 7814 (2007).
4) Inokuma, K., Liao, J. C., Okamoto, M., Hanai, T.: J Biosci. Bioeng., in press (2010).
5) Wiesenborn, D. P., Rudolph, F. B., Papoutsakis E. T.: Appl. Environ. Microbiol., 54, 2717 (1988).
6) Wiesenborn, D. P., Rudolph, F. B., Papoutsakis E. T.: Appl. Environ. Microbiol., 55, 323 (1989).
7) Petersen, D. J., Bennett, G. E.: Appl. Environ. Microbiol., 56, 3491 (1990).
8) Chen, J.-S.: FEMS Microbiol. Rev., 17, 263 (1995).
9) Bermejo, L. L., Welker, N. E., Papoutsakis, E. T.: Appl. Environ. Microbiol., 64, 1079 (1998).
10) Jenkins, L. S., Nunn, W. D.: J. Bacteriol., 169, 42 (1987).
11) Peretz, M., Bogin, O., Tel-Or, S., Cohen, A., Li, G., Chen, J.-S., Burstein, Y.: Anaerobe, 3, 259 (1997).
12) Sramek, S. J., Frerman, F. E.: Arc. Bioche. Biophys., 181, 178 (1977).
13) Chen, J.-S., Hiu. S. F.: Biotechnol. Lett., 8, 371 (1986).
13) Lin, S. H., Wang, C. S.: J. Hazard. Mater., 106, 161 (2004).
14) Inokuma, K., Liao, J. C., Okamoto, M., Hanai, T.: J. Biosci. Bioeng., in press (available on line).