【トピックス】
新規エナンチオ選択的イミン還元酵素の発見とその特徴解析
満倉浩一、長澤 透
岐阜大・工
1.はじめに
キラルアミンは、医薬品などの合成中間体として広い用途をもつことから1)、出発物質に応じた様々な合成法が検討されてきた。キラルアミンの酵素合成では、加水分解酵素、アミノ基転移酵素、アミン酸化酵素、アミン脱水素酵素あるいはそれらの酵素活性を示す菌体などが用いられている2)。最近では、酵素反応と化学反応あるいは補酵素再生系や副生成物除去プロセスを組み合せた合成法も提案されている2)。化学合成では、キラルアミンの効率的な合成法としてプロキラルなイミンあるいはエナミンの不斉還元があり、基質設計や触媒開発を含め数多くの研究が報告されている3,4)。
一方、酵素を用いたイミン不斉還元は、新しいキラルアミン酵素合成法として期待されているが、これまでに非天然化合物に作用するエナンチオ選択的イミン還元酵素に関する知見は全くなかった。それゆえ、イミン還元酵素の発見が強く切望されてきた。しかしながら、イミン還元酵素のスクリーニングを行う場合、多くのイミンは水系で不安定であり、容易にカルボニル化合物とアミンあるいはアンモニアに解離することから、イミン還元活性菌の取得は困難であろうと予想された。最近、水-テトラデカン二相系でのイミン還元酵素のスクリーニングが試みられた。そのモデル系では、カフェ酸のC=C結合の還元を触媒する嫌気性菌Acetobacterium woodiiの菌体を用いて、脂肪族と芳香族イミン混合物に対する変換活性が調べられた5)。しかしながら、この二相系でも、イミンに作用して生成したアミンに比べて、未反応あるいは水系で解離したアルデヒドから酵素的あるいは非酵素的に変換されたアルコールやカルボン酸の生成量が極めて多く、肝心のイミン還元活性の検出は難しいと結論づけた。
このような状況下、我々は水系で安定なイミンに着目し、モデル化合物として環状イミン2-メチル-1-ピロリン (2-MPN) を用いたイミン還元酵素のスクリーニングを計画した。本稿では、イミン還元活性を示す菌株の探索、エナンチオ選択的な2種類のイミン還元酵素の精製とその特徴解析、また活性菌株を用いた2-MPN変換反応について紹介する。
2.エナンチオ選択的イミン還元酵素の探索
我々は、2-MPNを用いて新規なイミン還元活性を示す微生物を探索した (図1)。0.1% (v/v) 2-MPNを含む栄養培地で微生物を培養した後、休止菌体を調製し、菌体による2-MPN変換反応を行った。イミン還元活性は、反応液上清をTLC展開し、2-メチルピロリジン (2-MP) 生成をニンヒドリン発色により評価した。
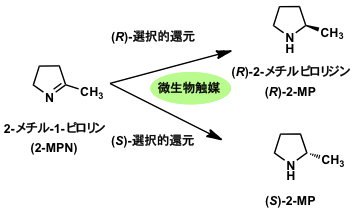
図1 微生物触媒を利用した2-MPNの不斉還元
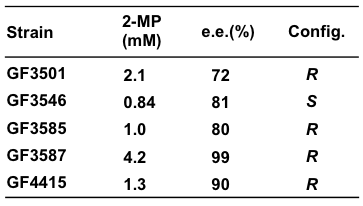
酵母は、一般的に還元活性が強く、カルボニル還元酵素6) やα, β-不飽和ケトンのC=C結合に作用する還元酵素7,8) の存在が報告されている。そこで我々は、酵母にはC=N結合の還元を触媒する酵素活性も潜んでいるのではないかと期待した。最初に研究室保存の酵母226株についてイミン還元活性を調べたが、残念ながら本活性は見出せなかった。次に、細菌261株やカビ84株についても同様にして調べたが、2-MPの生成は見られなかった。最後に、念のため117株の放線菌を調べたところ、土壌放線菌から2-MPを生成する菌株を5株見出した。生成した2-MPは、GITC (2,3,4,6-O-アセチル-β-D-グルコピラノシルイソチオシアナート) を用いて対応するチオウレア誘導体に変換した後、HPLC分析により2-MPの生成量と光学純度を算出した。その結果、4菌株が、2-MPNから (R)-選択的に2-MPを生成し、1菌株のみが、 (S)-選択的に2-MPを生成することが判明した (表1)。それらの中で、高活性な (R)-選択的イミン還元活性菌GF3587と (S)-選択的イミン還元活性菌GF3546について、16S rDNA解析を行ったところ、両菌株ともStreptomyces属菌と同定された。
表1 イミン還元活性を示す土壌放線菌
一方、Vaijayanthiと ChadhaによってCandidaparapsilosis ATCC 7330菌体が、アニリンとアセトフェノンから合成したアリールイミンを高い光学純度で (R)-アリールアミンに変換することが報告された9)。この反応を調べるために、我々は、C. parapsilosis NBRC0708 (ATCC 7330) の休止菌体を調製し、著量の菌体を用いてグルコース存在下でアリールイミンの変換反応を試みた。しかしながら、水系では、合成したアリールイミンは速やかにアニリンとアセトフェノンに解離し、Vaijayanthiと Chadhaが示した結果の再現性は得られなかった。また、C. parapsilosis NBRC 0708は、2-MPNにも作用しなかった。一方、Streptomyces sp. GF3587とGF3546は、前述したアリールイミンに対して変換活性を示さなかったことから、GF3587とGF3546の2-MPN還元を触媒する酵素は、新規な還元酵素の可能性が高いと考えられた。
3.イミン還元活性菌株によるキラル環状アミン合成
Streptomyces sp. GF3587とGF3546の培養および反応条件を検討した後、休止菌体を調製し、菌体による2-MPNの不斉還元反応を試みた。本反応には、エネルギー源が必要であり、補酵素再生のためにグルコースを反応系に添加した。その結果、GF3587菌体は、100 mM 2-MPNから91 mM (7.7 g/L) (R)-2-MPを99.2%e.e.の光学純度で生成し (図2a)、GF3546菌体は、30 mM 2-MPNから27 mM (2.3 g/L) (S)-2-MPを92.3%e.e.の光学純度で生成した10)(図2b)。この変換反応を経時的に追跡したところ、光学純度に変動はなく、高い光学純度が維持されていた。
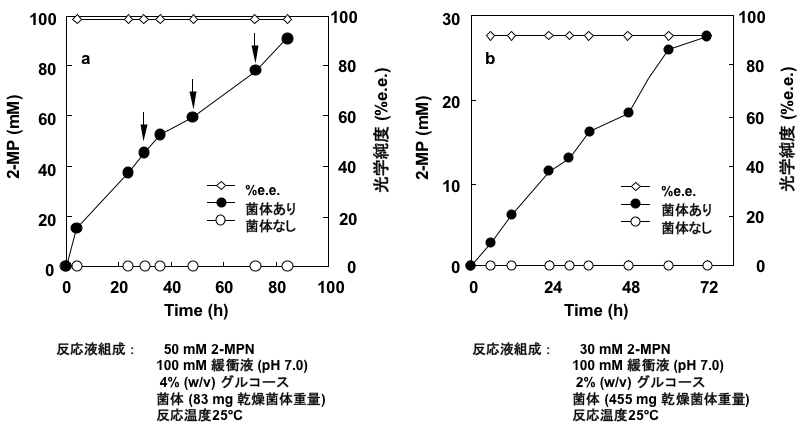

4.エナンチオ選択的イミン還元酵素の精製と特徴解析
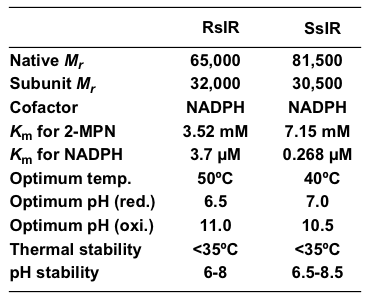
Streptomyces sp. GF3587の (R)-選択的イミン還元酵素 (RIR) とStreptomyces sp. GF3546の (S)-選択的イミン還元酵素 (SIR) は、どちらも菌体内に存在する構成酵素であった。菌体を破砕後、無細胞抽出液を調製し、硫安分画、各種クロマトグラフィーを経て精製を行い、RIRとSIRの双方の均一な精製酵素標品が得られた。RIRとSIRのサブユニット分子量は、SDS-PAGEからそれぞれ32,000、30,500と算出された (図3)。またHPLCゲルろ過の結果から、両酵素ともホモ2量体を形成していることが示唆された。RIRとSIRは、どちらも補酵素としてNADPHを要求する還元酵素であった。補酵素存在下、種々のpHにおける両酵素の活性を調べたところ、pH 7付近では2-MPNの還元を触媒する一方、pH 10付近では2-MPの酸化を触媒した。ただし、最適反応条件下では、RIRとSIRの還元活性は、酸化活性に比べて、それぞれ約30倍、約4倍高いことが分かった。最適pHや最適温度などRIRとSIRの諸性質については、表2に示した11)。
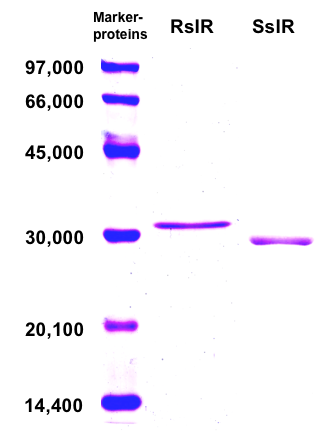
図3 精製したRIRとSIRのSDS-PAGE
表2 RIRとSIRの諸性質
RIRにおける金属イオンおよび酵素阻害剤の影響を検討した結果、Hg2+、Cu2+、Ag+とp-クロロ水銀安息香酸が、顕著に酵素活性を阻害したことから、SH酵素の可能性が示唆された。基質特異性を調べたところ、RIRは、イミン還元を触媒するジヒドロ葉酸還元酵素 (EC1.5.1.3) やΔ1-ピペリデイン-2-カルボン酸還元酵素 (EC 1.5.1.21) の基質には作用せず、これまでの検討では2-MPN以外の基質は見出されていない。すなわち、RIRの基質特異性は、極めて高いことが明らかとなった。また、基質特異性の比較的広いRIR菌も存在しており、目下検討中である。一方、SIRは、基質特異性が広くRIRと異なることが明らかになってきた。現在、詳細な基質特異性の検討を進めている。
ここでは触れていないが、RIRとSIRのアミノ酸配列情報をもとに、それぞれの遺伝子クローニング、一次構造解析と高発現系の検討も行っている。これらについては、またの機会にまとめて紹介できればと思っている。
5.おわりに
環状イミンに作用するイミン還元酵素の探索を試み、初めて、Streptomyces属菌からエナンチオ選択的イミン還元活性菌を見出した。また、 (R)-および (S)-選択的イミン還元酵素の精製に成功し、特性を明らかにした。これらの酵素の高機能化を図り、キラルアミン合成に応用したいと考えている。プロキラル化合物のC=N結合をエナンチオ選択的に還元する酵素の利用は、キラルアミンの酵素不斉合成法として大変魅力的である。今後、新たなスクリーニングの方法を工夫し、イミン還元酵素ライブラリーの作成を計画しており、様々なキラルアミン合成に対応したいと考えている。
謝辞
本稿で述べた研究は、ダイセル化学工業株式会社との共同研究によって進められたものであり、御協力を頂いた同コーポレート研究所 山本浩明主席研究員と木本訓弘研究員に心から感謝致します。ここで述べた成果は、学部と大学院学生諸氏の努力の賜物であり、ここに深く感謝致します。
文献
1) 大橋武久監修:キラル医薬品・医薬中間体の研究・開発, シーエムシー出版 (2010).
2) 満倉浩一, 吉田豊和:エコバイオリファイナリー, シーエムシー出版,160 (2010).
3) Nugent, T. C. (ed.) : Chiral amine synthesis, Wiley-VCH (2010).
4) Ojima, I. (ed.) : Catalytic Asymmetric synthesis, John Wiley and Sons (2010).
5) Li, H., Williams, P., Micklefield, J., Gardiner, J. M., Stephens, G: Tetrahedron, 60, 753 (2004).
6) Kataoka, M., Kita, K., Wada, M., Yasohara, Y., Hasegawa, J., Shimizu, S.: Appl. Microbiol. Biotechnol., 62, 437 (2003).
7) Kataoka, M., Kotaka, A., Hasegawa, A., Wada, M., Yoshizumi, A., Nakamori, S., Shimizu, S.: Biosci. Biotechnol. Biochem., 66, 2651 (2002).
8) 片岡道彦, 浦野信行, 堀田彰一朗, 宮川拓也, 田之倉優, 清水 昌:酵素工学ニュース, 64, 11 (2010).
9) Vaijayanthi, T., Chadha, A.: Tetrahedron: Asymmetry, 19, 93 (2008).
10) Mitsukura, K., Suzuki, M., Tada, K., Yoshida, T., Nagasawa, T.: Org. Biomol. Chem., 8, 4533 (2010).
11) 満倉浩一, 鈴木麻衣, 臼井利光, 吉田豊和, 長澤 透, 木本訓弘, 山本浩明: 平成22 年度日本農芸化学会大会講演要旨集, 92 (2010).