【トピックス】
鉄酸化細菌Acidithiobacillus ferrooxidansの硫黄酸化機構
杉尾 剛、竹内文章
杉尾化学合成独立栄養細菌研究所、岡山大学環境管理センター
1.はじめに
細菌を利用して鉱石から有用金属を溶出する技術をバクテリアリーチング (バイオリーチング) と呼んでいる1,2)。鉄酸化細菌Acidithiobacillus ferrooxidans (2000年以前にはThiobacillus ferrooxidansと呼ばれていた) は、バイオリーチングの現場に常在する好酸性の化学合成独立栄養細菌で、この菌の働きで銅鉱石からの銅の溶出が顕著に活性化される。A. ferrooxidansは、2価鉄 (Fe2+) ばかりでなく元素硫黄 (S0) など還元型無機硫黄化合物の両方を唯一のエネルギー源として利用できることからバイオリーチングの最も有用な菌の一つと考えられている。バイオリーチングにより有用な菌株を育種するためには、A. ferrooxidansの鉄酸化酵素と硫黄酸化酵素の両方を解明することが重要となる。現在、A. ferrooxidansの鉄酸化末端電子伝達系、および関連遺伝子に関してはほぼ確立している状況にある (図1)3-15)。一方、元素硫黄の酸化機構に関しては、まだ統一的な理解に達していない部分が残されている。
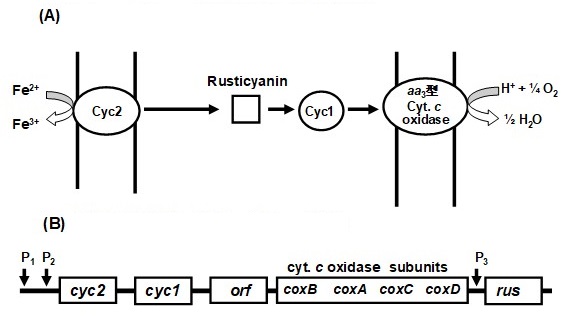
図1 (A) 鉄酸化細菌A. ferrooxidansの鉄酸化末端電子伝達系3-6,12)、および (B) 鉄酸化関連遺伝子群 (Rusオペロン11,12))
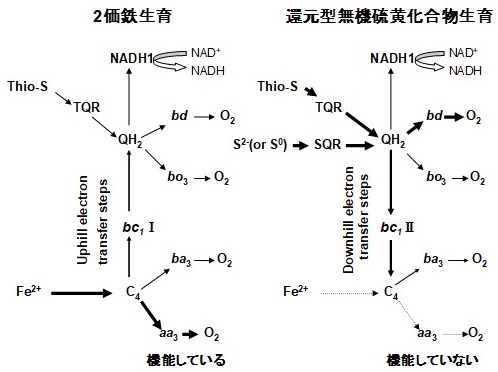
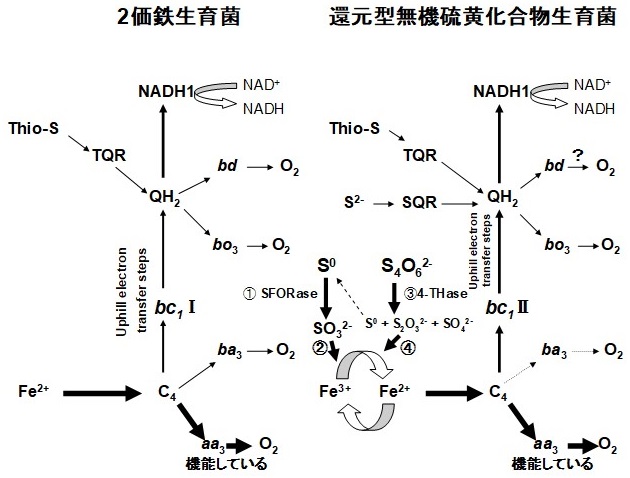
鉄酸化の末端電子伝達系は、2価鉄がまず外膜に存在するc型チトクローム (Cyc2) を還元し、次いでペリプラズマ空間に存在する銅タンパク質usticyaninを還元、さらに2番目のc型チトクロームであるCyc1を還元した後、内膜に存在すると考えられているaa3型cytochrome c oxidase (cyt. c oxidase) を還元、最後に、2価鉄由来の電子を分子状酸素に渡し水を生成する (図1)3-15)。一方、硫黄の酸化に関しては、その末端酸化酵素がaa3型cyt. c oxidaseなのか、それともbd型のubiquinol oxidaseなのか、あるいは両方とも機能しているのか、この点が最大の論争点となっていた。BrasseurやBoneffoyらは、チオ硫酸やサルファイド、あるいは元素硫黄 (S0) は、thiosulfate quinone reductase (TQR) またはsulfidequinone reductase (SQR) により酸化され、生成する還元型quinoneがbd型ubiquinol oxidaseによって酸化される末端電子伝達系を提案した (図2)16)。この提案では、aa3型cyt. c oxidaseは鉄酸化にのみに関与し、硫黄酸化には関与していない。一方、Boneffoyらは、A. ferrooxidansを硫黄で増殖させると培養初期に鉄酸化酵素の成分であるaa3型cyt. c oxidaseが生合成されるが、培養後期には急速に減少すること、一方、rusticyaninは培養後期でも比較的減少しにくいことをRT-PCRで示したが、aa3型cyt. c oxidaseの減少の理由については明らかにしていない14-16)。

1985年に筆者は、A. ferrooxidansが元素硫黄を電子供与体にして酵素的に₃価鉄を₂価鉄に還元する酵素反応を偶然見出した (hydrogen sulfide :ferric ion oxidoreductase, SFORase) (図3)17-19)。その後、3価鉄を電子受容体として用いる別の鉄還元酵素sulfite : ferric ion oxidoreductase (sulfife :Fe3+ reductase) とtetrathionate hydrolase (4-THase) を見出した (図3)20,21,27)。これらの知見に基づいて、硫黄酸化酵素と鉄酸化酵素系が3価鉄 (Fe3+) 及び2価鉄 (Fe2+) を介してリンクする新規な硫黄酸化機構を提案した (図3)19,22)。
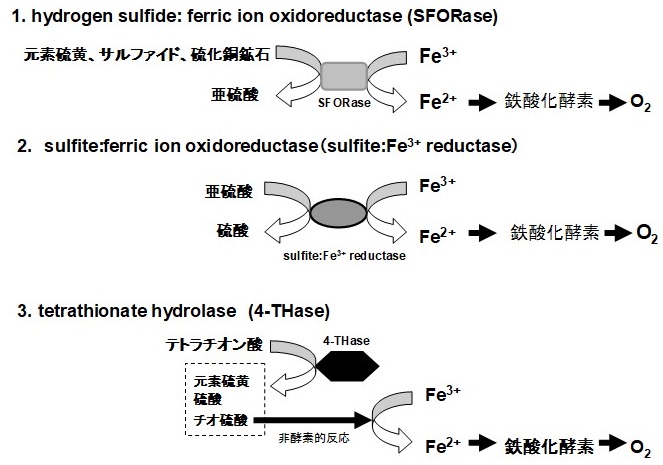
図3 A. ferrooxidansに存在する3種類の鉄還元酵素と鉄酸化酵素とのリンク
本稿では、A. ferrooxidansの硫黄酸化は、元素硫黄を亜硫酸に酸化する部分と、亜硫酸を硫酸に酸化する部分に分けられること、両者はFe3+とFe2+を介してリンクしていること、還元型無機硫黄化合物依存性の鉄還元酵素の作用で生成される2価鉄は、鉄酸化酵素で酸化されること、鉄酸化酵素の成分であるcyt. c oxidaseは2種類の生理機能を持っていることなどについて紹介したい。
2.硫黄培地に増殖する際、培養初期に高い鉄酸化活性が観察される
鉄酸化細菌の標準株A. ferrooxidans ATCC 23270株を用いて、硫黄培養時における鉄酸化酵素活性の消長について検討した。3,000 ml容の三角フラスコに300 mlの培養液を添加し、30℃で振とう培養を行った24)。この培養法は、通気撹拌培養法より増殖速度が速く、6日目に最大菌体収量90 mg protein・l-1を与えた (図6A参照)。硫黄培養2日目は、最大増殖量の約25~35%を与えるが (図6A参照)、鉄酸化活性は2価鉄生育菌の最大活性 (5µmol Fe2+ oxidized・mg-1・min-1) の約75%を保持していた (図4)。なお、2価鉄生育では、接種時、1日目、2日目、3日目、4日目、5日目、6日目、8日目、10日目、15日目の鉄酸化酵素活性は、それぞれ0.5、1.2、3.2、5.0、3.7、3.2、3.0、1.4、1.2、0.5µmol Fe2+ oxidized・mg-1・min-1であり、鉄酸化酵素活性は培養3日目に最大値を与えた。硫黄培養をさらに継続すると鉄酸化活性は減少し、最大生育収量を与える培養6日目には、2価鉄培地生育菌の最大活性の約12%となった (図4)。ATCC 23270株以外のA. ferrooxidans菌株についても硫黄培地に4日、5日、あるいは6日間培養した後、鉄酸化活性を測定した。D3-2株、ATCC 33020株、NASF-1株、ATCC 19859株のすべてが、硫黄培地で増殖した時もATCC 23270株とほぼ同レベルの鉄酸化酵素活性を持っていた (図4)。
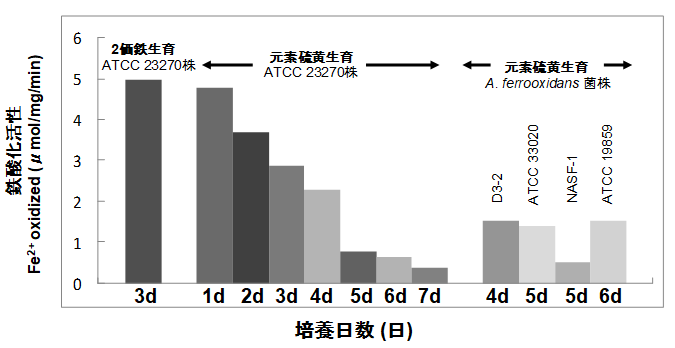
図4 2価鉄または元素硫黄培地で増殖したA.ferrooxidans株の鉄酸化活性
硫黄培地にA. ferrooxidansを培養する場合、培養初期に鉄酸化酵素が誘導されるのと同様にSFORase活性も10~20倍に誘導された24)。SFORaseは“硫黄依存性の2価鉄生成酵素”と呼ぶこともできる。硫黄とFe3+が存在すると2価鉄が生成するので、A. ferrooxidansは硫黄培養時においても鉄酸化酵素を生合成すると考えられる。
3.硫黄培地で増殖したA. ferrooxidansからの鉄酸化酵素成分の精製と鉄酸化酵素の再構成
硫黄培養時に生合成される鉄酸化酵素は、2価鉄培養時に生合成される鉄酸化酵素と同じ酵素なのかを検討した。硫黄培地で4日間培養したATCC 23270株から、aa3型 cyt. c oxidase、銅タンパク質rusticyaninを単一標品として精製した。また、2種類のc型チトクローム (Cyc1とCyc2) は、両者の混合物として部分精製した。これら4種類の鉄酸化酵素成分 (図1参照) は、スペクトル的にも、分子量的にも、またN末端アミノ酸配列の点からも、2価鉄で生育したATCC 23270株のものと一致した25)。このようにA. ferrooxidansは、元素硫黄で増殖しても、2価鉄で増殖しても、同じ鉄酸化酵素を生合成する。鉄酸化酵素の再構成を試みた。硫黄生育菌から精製した4種類の鉄酸化酵素成分 (aa3型 cyt. c oxidase、rusticyanin、Cyc1、Cyc2) すべてを存在させた時にのみ鉄酸化活性が出現した。一方、それぞれ単独、あるいは2種類を組み合わせた系では鉄酸化酵素活性は、ほとんど見られなかった (図5)。
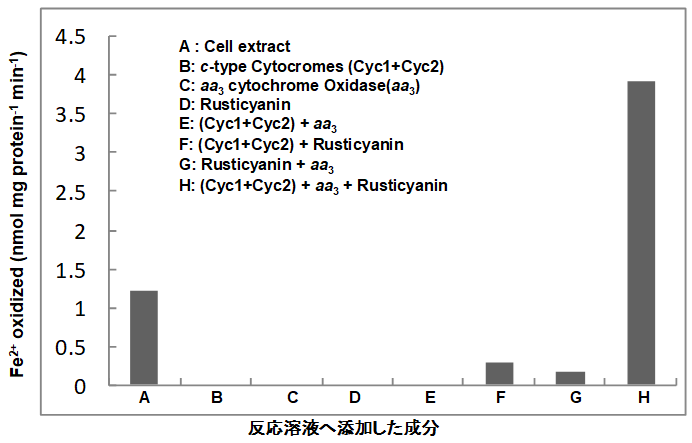
図5 元素硫黄培地生育A. ferrooxidans23270株から単離した鉄酸化酵素成分による鉄酸化酵素の再構成
4.テトラチオン酸依存性の鉄還元酵素活性
元素硫黄と同様に、A. ferrooxidansはテトラチオン酸 (4-TH) を唯一のエネルギー源として増殖できる。4-THをエネルギー源にする場合、硫黄培地に比較してより短い培養日数 (3日目) で増殖は最大に達した (図6A)。培養3日目において4-TH生育菌は、2価鉄生育菌の最大鉄酸化酵素活性の約65%の活性を有していた。培養を継続すると鉄酸化活性は低下したが、硫黄生育の場合より減少速度は穏やかで、10日間培養後においても2価鉄生育菌の最大鉄酸化酵素活性の約30%の活性を有していた (図6B)。一方、10日間培養後硫黄生育菌では、鉄生育菌の最大鉄酸化酵素活性の約5%の活性しか残存していなかった。
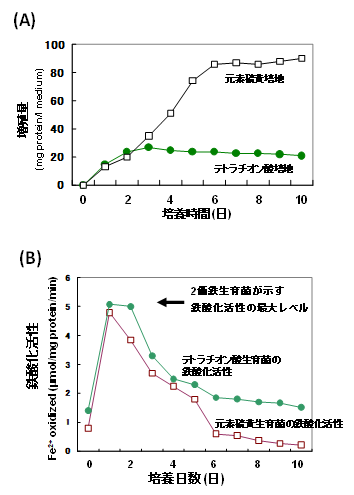
図6 テトラチオン酸培地、及び元素硫黄培地におけるA. ferrooxidansATCC 23270株の増殖 (A)、並びに鉄酸化活性 (B)
4-THで増殖した菌は、4-THを電子供与体にした時、高い鉄還元活性 (1.35µmol Fe2+ produced mg-1・min-1) を示した。これに対して硫黄増殖菌は、4-TH生育菌の約1/10の4-TH依存性の鉄還元活性を示すのみであった。この結果は、4-THで増殖することによって、4-TH依存性の鉄還元酵素が誘導されることを示している。
2価鉄生育、元素硫黄生育、4-TH生育細胞から、4-TH依存性の鉄還元酵素の精製をおこなった27)。洗浄細胞を2%の1-O-n-octyl-β-D-glucopyranoside (OGL) を含むpH 2.0の緩衝液で可溶化した。可溶化画分の鉄還元活性は、2価鉄、元素硫黄、4-TH生育菌に対して、それぞれ0.04, 0.08, 0.72 mU/mgであった。また、単一に精製後の鉄還元活性は、それぞれ7.90, 7.70, 7.97 mU/mgであり、可溶化画分よりそれぞれ270倍、93倍、11 倍に精製された27)。3種類の培養菌から精製した鉄還元酵素の分子量はいずれも52.3 kDaであり、N末端アミノ酸配列はいずれもAVAVPMDSTGであった。N末端アミノ酸配列はATCC 23270株の4-THaseと一致した28)。
5.テトラチオン酸酸化の電子伝達系
4-THaseは、4-THを元素硫黄、チオ硫酸、硫酸に分解する (図3参照)。元素硫黄と硫酸は3価鉄を還元しないが、チオ硫酸は酸性pHで3価鉄を非酵素的に素早く還元する。以上の知見に基づき、4-THaseにより2価鉄が生成する機構を、“4-THaseから生成したチオ硫酸が非酵素的に3価鉄を還元し、2価鉄を生成する”と考えた (図3参照)。硫黄培地で増殖したATCC 23270株より部分精製したc型チトクローム (Cyc1及びCyc2)、及びaa3型cyt. c oxidaseは、精製した4-THaseの存在下でのみ4-THによって還元された29)。一方、4-THaseが存在しないとこの還元反応は起こらないことから、4-THはFe3+/Fe2+を介して、最終的には鉄酸化酵素によって酸化されると考えられる (図3、図8参照)。
6.亜硫酸酸化機構
元素硫黄が硫酸に酸化される際、中間体として亜硫酸が生成する (S0 → SO32- → SO42-)。したがって、元素硫黄酸化を理解するためには、亜硫酸生成酵素と亜硫酸酸化酵素の両方を解明する必要がある。A. ferrooxidansAP19-3株の細胞膜からsulfite :Fe3+ reductaseを精製した (図3参照)20,21)。この酵素は亜硫酸を酸化する際3価鉄を電子受容体にするので2価鉄が生成される (図3参照)。生成された2価鉄は鉄酸化酵素によって酸化される (図3、図8参照)。
最近、A. ferrooxidansにsulfite : Fe3+ reductaseとは異なる亜硫酸酸化活性の存在を明らかにした。A. ferrooxidans D3-2株は、チリ共和国の銅鉱山から分離した株で、銅精鉱から銅イオンを溶出する活性が高い菌株として選抜された30)。このD3-2株がなぜ他の菌株よりバイオリーチング活性が高いのかを検討する過程で、D3-2株の最大の特徴は、高い亜硫酸酸化活性を持つとともに、亜硫酸に耐性であることを見出した30)。
2%のOGLを含む緩衝液 (pH 2.0) で可溶化後、D3-2株から新規亜硫酸酸化酵素を均一に精製した31)。精製酵素の吸収スペクトルはA. ferrooxidansのaa3型 cyt. c coxidaseと一致した (図7)。精製亜硫酸酸化酵素の3種類のsubunitの分子量、及びγ-subunitのN末端アミノ酸配列 (AAKKG) は、ATCC 23270株のcyt. c oxidaseと一致した31)。また、2価鉄並びに硫黄で増殖したD3-2株から精製した亜硫酸酸化酵素 (cyt. c oxidase) の活性は、cyt. c oxidaseに対して調製した抗体によって完全に阻害された31)。以上の結果は、A. ferrooxidansのaa3型cyt. c oxidaseが、呼吸活性を持つとともに、亜硫酸酸化活性を合わせ持つ多機能性酵素であることを示している。2価鉄、並びに硫黄で増殖した D3-2株のcyt. c coxidaseが触媒する亜硫酸酸化活性はA. ferrooxidansATCC 23270株、MON-1株、AP19-3株から同様の方法で精製した亜硫酸酸化酵素 (cyt. c oxidase) の活性より約2倍高かった31)。
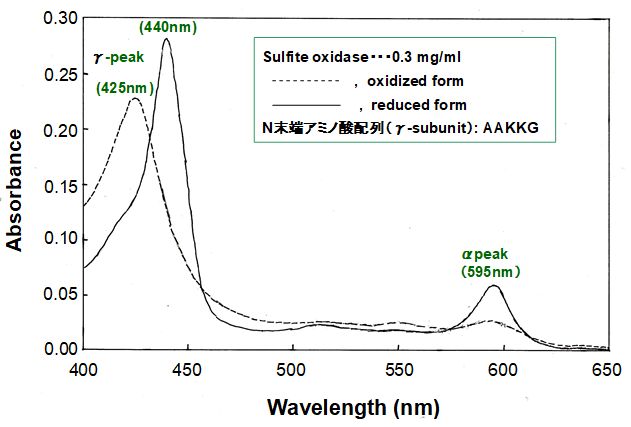
図7 A. ferrooxidansD3-2株から精製した亜硫酸酸化酵素の吸収スペクトル
7.バクテリアリーチング活性と亜硫酸酸化酵素活性との関係
亜硫酸酸化酵素活性の高い菌株はなぜバイオリーチング活性が高いのであろうか。亜硫酸は生物毒性が非常に強い物質である。亜硫酸を酸化分解できるA. ferrooxidansに対しても、亜硫酸はこの菌の増殖を強く阻害する32-34)。亜硫酸は、硫黄酸化、並びに銅鉱石 (カルコパイライト CuFeS2) 酸化の中間代謝物である。亜硫酸による増殖阻害の原因の一つは、鉄酸化酵素、特にcyt. c oxidaseを強く阻害することにある34,35)。バイオリーチングの現場において銅溶出に関与している菌は、1か月以上もの長期間、銅鉱石と接触し、鉱石中の鉄成分、硫黄成分 (サルファイド) を酸化分解しなければならない。このように長期間を要するバイオリーチングにおいては、D3-2株のように、銅鉱石からたえず中間代謝物として生成してくる毒性の強い亜硫酸を少しでも速く分解できる菌株が有利となる30)。D3-2株が亜硫酸に耐性である理由として、D3-2株のcyt. c oxidaseそのものが亜硫酸に耐性であることを示す結果が、現在集積しつつある。
8.おわりに
バイオリーチングで重要な役割を果たしているA. ferrooxidansの硫黄酸化機構について、特に、硫黄酸化に鉄酸化酵素が関与しているかの長年の問題に検討を加え、下記の①~⑥の結果を得た。①元素硫黄依存性、並びに亜硫酸依存性に加えて、4-TH依存性の鉄還元酵素が存在することを明らかにした。即ち、A. ferrooxidansは還元型無機硫黄化合物依存性で2価鉄を生成する3種類の酵素活性を持っている。②硫黄で増殖する際A. ferrooxidansは、特に増殖初期に2価鉄生育菌とほぼ同レベルの高い鉄酸化酵素活性を持つが、培養を続けると鉄酸化酵素活性は急速に減少する。③硫黄で増殖したA. ferrooxidansは、2価鉄生育菌と同じ鉄酸化酵素を生合成することを再構成実験を用いて明らかにした。④4-TH依存性の鉄還元活性が4-THaseに起因することを明らかにした。さらに4-THaseの存在下でのみ、鉄酸化酵素の成分であるc型 cytochromesとcyt. c oxidaseが4-THによって還元されることを初めて示した。⑤ Cyt. c oxidaseは、本来のcyt. c oxidase活性とともに亜硫酸酸化活性を合わせ持つことを示した。⑥バイオリーチング活性の高いD3-2株は、高い亜硫酸酸化活性 (cyt. c oxidase活性) と亜硫酸耐性能を持ち、硫黄酸化の中間体である毒性の強い亜硫酸をより速く酸化分解できる。
以上の結果、並びに、以前得られた結果に基づき、“A. ferrooxidansの元素硫黄酸化には鉄酸化酵素が関与している”と結論した (図8)。幾多の検討にもかかわらず、硫黄生育A. ferrooxidans株のOGL抽出液中にd型チトクロームの特徴的ピークが観察されなかったことから、硫黄酸化の末端酸化酵素としてチトクロームbdが機能しているかどうかについてはさらに検討を加える必要があると考えている (図8)。

A. ferrooxidans株を元素硫黄培地で培養すると、培養初期に観察された高い鉄酸化酵素活性が培養後期に急速に減少するという現象に出会う。この現象があるために、硫黄酸化への鉄酸化酵素の関与が長年認められないままになっていた。この活性減少の原因は、現在完全には解明できてはいないが、硫黄酸化の中間代謝物である亜硫酸の生成に原因があるのでは・・と推定している。一方、先に述べたように、2価鉄培地で培養した場合にも、鉄酸化酵素活性は培養3日目に最大値を示した後、徐々に減少し、培養15日目には最大活性の約12%に減少するので36)、培養経過に伴う鉄酸化酵素活性の減少は、鉄生育、硫黄生育に関わらないA. ferrooxidansの鉄酸化酵素に特有の性質と言える。ただ、硫黄生育時の方が鉄酸化酵素活性の減少が著しく速いのは事実である。予備的な実験で、亜硫酸がcyt. c oxidaseの分解を促進するという結果を得ているが、さらに詳細に検討したいと考えている。
文献
1) Lundgren, D. G., Silver, M.: Ann. Rev. Microbiol., 34, 263 (1980).
2) Rawlings, D. E.: Ann. Rev. Microbiol., 56, 65 (2002).
3) Cobley, J. G., Haddock, B. A.: FEBS Lett., 60, 29 (1975).
4) Ingledew, W. J., Cox, J. C., Halling, P. J.: FEMS Microbiol. Lett., 2, 193 (1977).
5) Cox, J. C., Boxer, D. H.: Biochem. J., 174, 497 (1978).
6) Ingledew, W. J.: Biochim. Biophys Acta, 683, 89 (1982).
7) Kai, M., Yano, T., Tamegai, H., Fukumori, Y., Yamanaka, T.: J. Biochem., 112, 816 (1992).
8) Iwahori, K., Kamimura, K., Sugio, T.: Biosci. Biotechnol. Biochem., 62, 1081 (1998).
9) Sugio, T., Iwahori, K., Takai, M., Takeuchi, F., Kamimura, K.: Hydrometallurgy, 71, 159 (2003).
10) Cavazza, C., Giudici-Orticoni, M.-T., Nitschke, W., Appia, C., Bonnefoy, V., Bruschi, M.: Eur. J. Biochem., 24, 308 (1996).
11) Appia-Ayme, C., Bengrine, A., Cavazza, C., Giudici-Orticoni, M., Bruschi, M., Chippaux, M., Bonnefoy, V.: FEMS Microbiol. Lett., 167, 171 (1998).
12) Appia-Ayme, C., Guiliani, N., Ratouchniak, J., Bonnefoy, V.: Appl. Environ. Microbiol., 65, 4781 (1999).
13) Giudici-Orticoni, M.-T., Leroy, G., Nitschke, W., Bruschi, M.: Biochemistry, 39, 7205 (2000).
14) Yarzabal, A., Brasseur, G., Ratouchniak, J., Lund, K., Lemesle-Meunier, D., DeMoss, J. A., Bonnefoy, V.: J. Bacteriol., 184, 313 (2002).
15) Yarzabal, A., Appia-Ayme, C., Ratouchniak, J., Bonnefoy, V.: Microbiology, 150, 2113 (2004).
16) Brasseur, G., Levican, G., Bonnefoy, V., Holmes, D., Jedlicki, E., Lemeslep-Meunier, D. G.: Biochimica Biophysica Acta, 1656, 114 (2004).
17) Sugio, T., Domatsu, C., Munakata, O., Tano, T., Imai, K.: Appl. Environ. Microbiol., 49, 1401 (1985).
18) Sugio, T., Mizunashi, W., Tano, T., Imai, K.: Agric. Biol. Chem., 50, 2755 (1986).
19) Sugio, T., Mizunashi, W., Inagaki, K., Tano, T: J. Bacteriol., 169, 4916 (1987).
20) Sugio, T., Katagiri, T., Moriyama, M., Zhen, Y. L., Inagaki, K., Tano, T.: Appl. Environ. Microbiol., 54, 153 (1988).
21) Sugio, T., Hirose, T., Zhen, Y. L., Tano, T.: J. Bacteriol., 174, 4189 (1992).
22) 杉尾剛:醗酵工学, 67, 173 (1989).
23) Sugio, T., White, K. J., Shute, E., Choate, D., Blake II, R. C.: Appl. Environ. Microbiol., 58, 431 (1988).
24) Sugio, T., Taha, T. M., Kanao, T., Takeuchi, F.: Biosci. Biotechnol. Biochem., 71, 2663 (2007).
25) Taha, T. M., Kanao, T., Takeuchi, F., Sugio, T.: Appl. Environ. Microbiol., 74, 6808 (2008).
26) Sugio, T., Taha, T. M., Negishi, A., Takeuchi, F.: Advanced Materials Research, 71-73, 745 (2009).
27) Sugio, T., Taha, T. M., Takeuchi, F.: Biosci. Biotechnol. Biochem., 73, 1381 (2009).
28) Kanao, T., Kamimura, K., Sugio, T.: J. Biotechnol., 132, 16 (2007).
29) Taha, T. M., Takeuchi, F., Sugio, T.: Advanced Materials Research, 71-73, 243 (2009).
30) Sugio, T., Wakabayashi, M., Kanao, K., Takeuchi, F.: Biosci. Biotechnol. Biochem., 72, 998 (2008).
31) Sugio, T., Ako, A., Takeuchi, F.: Biosci. Biotechnol. Biochem., 74, 2242 (2010).
32) Hirose, T., Suzuki, H., Inagaki, K., Tanaka, H., Tano, T., Sugio, T.: Agric. Biol. Chem., 55, 2479 (1991).
33) Sugio, T., Uemura, S., Makino, I., Iwahori, K., Tano, T., Blake, R. C.: Appl. Environ. Microbiol., 60, 722 (1994).
34) Sugio, T., Iwahori, K., Uemura, S., Makino, I., Tano, T.: Biosci. Biotech. Biochem., 58, 2109 (1994).
35) Iwahori, K., Kamimura, K., Sugio, T.: Biosci. Biotech. Biochem., 62, 1081 (1998).
36) Sugio, T., Wada, K., Mori, M., Inagaki, K., Tano, T.: Appl. Environ. Microbiol., 54, 150 (1988).