【トピックス】
全自動2次元電気泳動装置 (Auto2D) の開発
鵜沼 豊、丸尾祐二
シャープ・研究開発本部
1.はじめに
当社は昨年 (2011 年9月) 2次元電気泳動の自動化装置「Auto2D」の商品化を発表しました。当社としては初めてのバイオ関連分析機器の商品化となり、各方面から大きな反響をいただきました。また本商品は日刊工業新聞社がその年の革新的な新商品に対して贈る2011 年の十大新製品を受賞することができました。発表以来多くの方から何故シャープがバイオ関連の機器を開発したのか、しかも何故2次元電気泳動なのかと尋ねられます。本稿では開発の経緯も含めて装置の紹介をさせていただきます。
シャープにおけるバイオ関連の基礎研究は30年前に着手されましたが、本格的な分析装置開発は2003年から検討が開始されました。2003年は丁度人の全遺伝子の解読が宣言された年であり、遺伝子検査による診断応用を目指して高速なDNAシーケンス解析やSNPs検査のためのDNAチップ等が商用へ向けて開発が始まったころでもあります。しかし当社はDNAではなくタンパク質をターゲットとして選びました。約2万個のヒト遺伝子をもとに多くのタンパク質が作られますが、このヒト体内のタンパク質が実際の体調変化や疾病などの生命活動に深く関わる重要な役割を担っています。これらのタンパク質は、合成された後に受ける化学的な修飾や分子の切断などによって変化を続けて、結果的には数十万種類にもなると考えられます。また、同じ遺伝子を持っていても機能が異なる細胞では合成されるタンパク質が異なりますし、がん化した細胞のタンパク質は、正常時と異なる化学変化を受けています。つまり、病気などの詳しいメカニズムや薬の効き方などを解明するためには、遺伝子だけではなく、タンパク質を網羅的に研究する必要があります。タンパク質の網羅的な分析には、従来から2次元電気泳動法と呼ばれるタンパク質の分離方法が主に用いられますが、各工程の操作が非常に難しく、再現性のよい結果を得るためには、熟練した研究者が数日掛けて作業する必要がありました。そのため、多くのタンパク質の変化を網羅的に研究するためには、簡便で高速なタンパク質解析手法の開発が望まれていました。
2.2次元電気泳動法について
図1に従来の2次元電気泳動法の説明と本開発で自動化した分析作業工程についての概要を示しました。2次元電気泳動法とは、各タンパク質分子の持っている2種類の物理的性質 (等電点、分子量) の違いを利用して、タンパク質の混合物を2次元的なパターンに分離する方法です。実際には、試料であるタンパク質の混合物を、ポリアクリルアミドを材料とする特殊なゲルの中を通過させることで、分子量や等電点の違いで分離します。
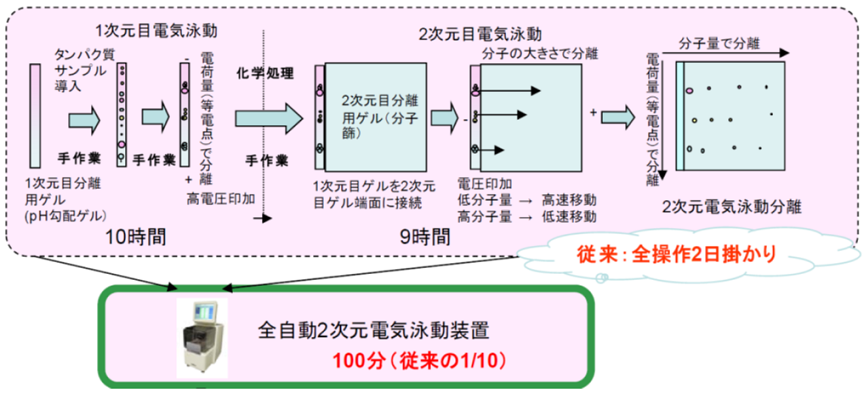
図1 2次元電気泳動法と自動化
1次元目の電気泳動分離は、タンパク質のもつ電気化学的性質の1つである等電点の違いを利用します。等電点電気泳動 (Isoelectric focusing:IEF) と呼ばれる方法です。細長い1次元目分離用ゲル (pH勾配固定化ゲル) に、何種類ものタンパク質が含まれる試料を染み込ませて高電圧を印加すると、それぞれのタンパク質がもつ等電点の値に応じた位置にタンパク質が移動して、そこに留まることで分離が行なわれます。
2次元目の電気泳動分離は、タンパク質の分子量の違いを利用します。ドデシル硫酸ナトリウム ポリアクリルアミドゲル電気泳動 ( sodium dodecylsulfate polyacrylamide gel electrophoresis:SDS-PAGE) と呼ばれる方法です。1次元目の分離が完了した1次元目分離用ゲルを、長方形の2次元目分離用ゲルの一辺に接続し、電圧を印加します。ゲルの網の目構造がもつ分子ふるい効果により、分子量の大小で移動速度が異なるため、分子量に応じた位置にタンパク質を分離することができます。
最終的には、矩形シート状の2次元目分離用ゲルに、網羅的に分離された数多くのタンパク質がそれぞれ異なるスポットに収束して分布します。そのスポットの2次元的な位置関係や濃度が各々のタンパク質の分析情報となります。
従来の2次元電気泳動による分析では、一連の実験操作が全て手作業です。1次元目や2次元目の電気泳動はそれぞれ別の器具を用いますが、柔軟で変形しやすいゲルは取扱いが難しく、実験操作は煩雑であり、再現性の良い結果を得るためには高度な技と熟練を要しました。また、分析開始から結果を得るまでの全操作が2日掛かりとなるため、大量のサンプル分析を必要とする臨床研究においては、著しく効率が悪く、ごく限られた利用に留まっていました。
この問題点を解決するために、1次元目分離から2次元目分離までのすべての作業工程を連続自動化する技術の実用化に向けて取組み、全自動の2次元電気泳動装置 (タンパク質分析装置「Auto2D」) を開発しました。今回開発した装置を用いると、従来法と比べて約10分の1の時間で、誰が操作しても再現性のよい結果を得られます。さらに、従来法に比べ約5倍の分解能を有しているので、疾病のパターンなどをより正確に分析することが可能となります。
シャープマニファクチャリングシステム株式会社で製造・販売する装置「Auto2D」および分析用サプライ品を図2および図3に示します。「Auto2D」は、医療用手袋のままでも認識可能なタッチパネル画面ですべての操作をおこなうスタンドアローン型の装置です。分析用サプライ品は、分析目的に合わせて選択できるように、数種類の分離ゲル仕様 (pHレンジ、PAGEゲル濃度) を提供します。
本装置「Auto2D」による分離画像例を図4に示します。分析試料はマウス肝臓で、タンパク質は蛍光色素で染色されており、2次元電気泳動分離後の2次元目ゲル (PAGEゲル) を蛍光検出イメージスキャナで検出した画像です。所要時間わずか100分の自動動作で非常に簡便に、分解能の良好な分離結果が得られています。

図2 タンパク質分析装置 Auto2D

図3 分析用サプライ品

図4 マウス肝臓サンプルの分離画像例
3.自動化のための技術
精密搬送機構で自動化を実現した2次元電気泳動装置の内部機構図を図5に示します。自動化を可能にした最も重要なポイントの1つは、柔軟で変形しやすい1次元目分離用ゲルを支持体に一体化したことです。樹脂製の支持体は柔らかいゲルとは異なり、機械的なクランプで挟んで保持して搬送することが容易です。2軸の自動搬送機構を用いてゲルを位置精度よく搬送し、複数の処理工程を連続的に自動化することが可能になりました。
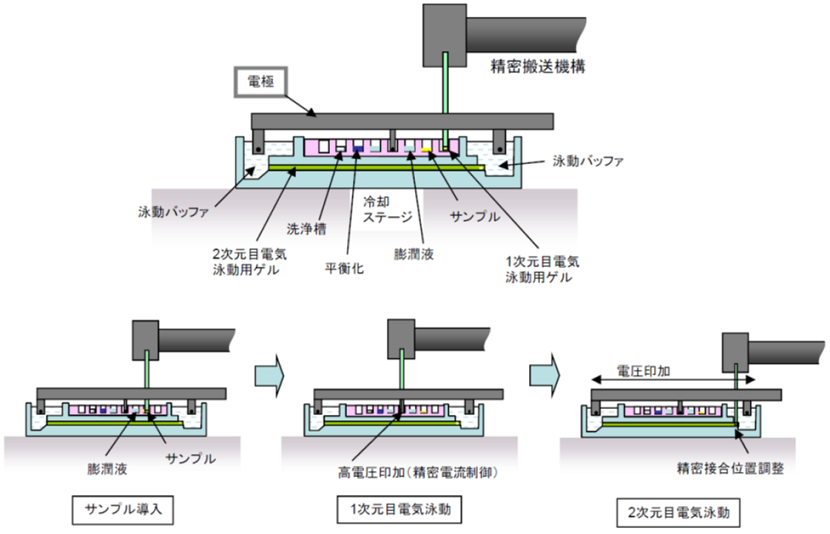
図5 2次元電気泳動装置の内部機構図
また、ゲルを支持体に固定すると柔らかくても形状が保てるため、1.2 mm幅の細いゲル (従来のゲルは幅3 mm以上) が使用できます。医学研究で用いる試料は量が少なくて貴重なものが多いのですが、幅の細いゲルは少量の試料:5µg (従来法の10分の1以下) でも十分に分析が可能です。さらに幅の細いゲルと少量の試料の組み合わせは、ゲル中に試料を染み込ませるタンパク質サンプル導入工程に要する時間も大幅に短縮 (従来法の10分の1以下) できました。
電圧を印加する1次元目電気泳動分離の工程でもメリットがありました。1次元目電気泳動では数kVの高電圧を印加して分離するのですが、ゲル中を流れる電流量が多いとゲルが発熱して乾燥し、さらに発熱が進行すると部分的に炭化してしまう不具合が発生します。その点、幅の細いゲルと少量の試料の組み合わせは、1次元目分離用ゲル中に流れる電流を20µA以下と少なくできるため、発熱が抑えられ、比較的容易に高電圧を印加できます。高電圧を印加すると、ゲル中の電位勾配が急峻になるので、タンパク質がすばやく移動し、また留まるべき位置では分離したタンパク質の収束が密になるので高い分解能が得られます。幅の細いゲルを用いる構成は、1次元目電気泳動時間:30分間 (従来法の10分の1以下) と高分解能:0.02 pH (従来法の約5倍程度) の実現にも効果を発揮しました。
自動化することによって、操作の簡便性と分離結果の再現性の向上を目指しました。分析毎に使用する分離ゲル類は、ディスポーザブルのサプライ品として供給します。片手で扱いやすいサイズ70 mm角の樹脂製 (従来法は100~250 mm角程度のガラス板製) のチップとし、その内部に分離ゲルを封入した気密包装ですので、開封して直ぐに装置にセットできます。分析する試料と試薬類を投入しスタートすると、その後はすべて「Auto2D」が自動でおこないますので、約100分後には2次元分離が完了しています。従来法では、途中で何度か煩雑な作業が必要なため、常に次の作業タイミングを気にしながら2日掛かりの分析となりますので、自動化により簡便性は格段に進化したと言えます。
また、従来の2次元電気泳動では、分離結果の再現性が悪い、そのため定量的な比較は困難である、と考えられていました。研究者の熟練度合いが再現性に反映される側面が多々ありますので、2次元電気泳動が敬遠される理由の1つでもありました。自動化にあたっては、電気泳動時の各条件が正確に再現されれば、分離結果の再現性も必ず改善するはずと考え、いくつかの施策を講じています。
まず、精密搬送機構による位置の再現性です。いくつかの工程の中で、1次元目の分離が完了した1次元目分離用ゲルを、長方形の2次元目分離用ゲルの一辺に接続するときの位置関係が最も重要となります。それは“細い”1次元目分離用ゲルから“薄い”2次元目分離用ゲルへと確実にまた再現よくタンパク質を移動させる必要があるからです。従来法の手作業では正確な位置の再現は困難でしたが、「Auto2D」では1µom単位で設定可能な2軸の精密搬送機構を採用することによって、正確に位置を再現させることが可能となりました。
次に、電気泳動の電圧印加の再現性です。電気泳動で印加する電圧値と電流値は、印加時間や設定値とその変化過程を最適化した印加プログラムで制御され、常に計測・フィードバックする高電圧印加の精密制御システムを用いました。
最後に、温度の再現性です。従来法では、室温により変動するような受動的な水冷方式がよく用いられますが、「Auto2D」では分析用のチップが接触するアルミプレート部分にペルチェ素子を組み込んで温調冷却ユニットとしました。実験室環境に関わらず、電気泳動の各工程で最適な温度設定を実現し、温度条件についても高い再現性を可能としました。再現性の評価結果および等電点、分子量の分解能評価結果を図6に示します。マウスの肝臓サンプルを用いて5回電気泳動を行い、同一スポットの蛍光強度ばらつき (CV) が10%以下、等電点方向の位置ばらつきはpH値に対して1%以下、分子量方向の位置ばらつきは分子量に換算して4%以下を実現し、サンプル間の高確度なスポットマッチングと定量的比較が可能なレベルを実現しています。

図6 再現性評価結果および分解能
以上、本開発装置で実現している内容を従来技術との比較として簡単に表1にまとめました。
表1 従来技術と本開発の比較

4.分析応用例
図7に本開発装置を用いたビメンチンタンパク質の分離を示します。ビメンチンタンパク質はがん化に関連するタンパク質であり、翻訳後修飾によって複数のスポットに分離します。1種類のタンパク質が、合成された後に受ける化学的な修飾や分子の切断などによって変化を続けて、各々が異なる機能を発揮すると考えられています。そのタンパク質の変化が分離・分析できるか否かが分析装置の有用性に大きく関わります。本開発装置は、1次元目電気泳動において高電圧印加が可能であり、短時間で高分解能の分離結果が得られます。ビメンチンタンパク質の分離結果から分かるように、疾病等に関わるタンパク質のリン酸化、およびN末端の切断による僅かな等電点のシフトが分離可能であることが確認されました。このようにタンパク質のリン酸化等のシフトが検出可能であることは医学研究分野にとって非常に有効です。
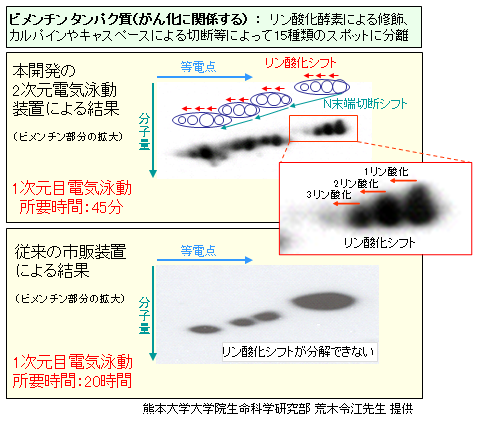
図7 本開発装置を用いたビメンチン タンパク質の分離
図8は抗がん剤の感受性・非感受性を2次元電気泳動パターンで判断可能、であることを示唆する分析応用例です。グリオーマ (脳腫瘍の一種) のビメンチンタンパク質を本開発装置で分離した結果になります。脳腫瘍の治療に用いられる抗がん剤が効く (感受性) 患者と効かない (非感受性) 患者が存在します。「Auto2D」を用いた2次元電気泳動結果の分析により、感受性患者と非感受性患者のビメンチンタンパク質のリン酸化パターンに明確な違いがあることが明らかとなりました。
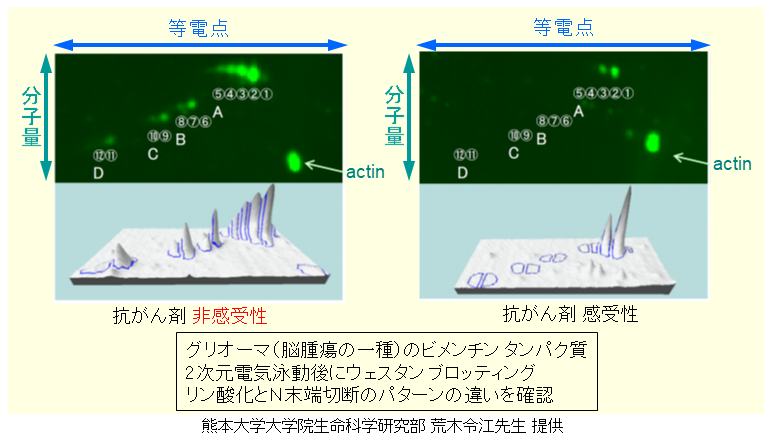
図8 抗がん剤の感受性・非感受性を2次元電気泳動パターンで判断可能
脳腫瘍患者の抗がん剤の感受性と非感受性は、医療現場で従来から行なわれている腫瘍組織検査では判別できない項目です。
5.おわりに
今回開発した装置は、全自動かつ短時間で2次元電気泳動結果をもたらします。これにより、大量の臨床データを処理することが必要であった疾病プロテオミクス分野でも、広く2次元電気泳動法を用いることが可能となります。さらに、医学研究のみならず、製薬業界や食品検査等でタンパク質を網羅的に分析する場合や、微細な化学変化を含む分析が必要とされる分野でも、本開発成果の利用が期待されます。
謝辞
本開発は、科学技術振興機構 (JST) の研究成果展開事業【先端計測分析技術・機器開発プログラム】の成果です。JST事業は、熊本大学大学院生命科学研究部腫瘍医学分野・荒木令江准教授との共同開発チームで取組みました。
また、本開発の基礎となる技術1) は、新エネルギー・産業技術総合開発機構 (NEDO) の助成事業 (平成15年度~20年度) の研究課題がベースとなります。NEDO助成事業は、産業技術総合研究所、東京工科大学、凸版印刷株式会社との共同研究です。
文献
1) Hiratsuka, A., Kinoshita, H., Maruo, Y., Takahashi, K., Akutsu, S., Hayashida, C., Sakairi, K., Usui, K., Shiseki, K., Inamochi, H., Nakada, Y., Yodoya, K., Namatame, I., Unuma, Y., Nakamura, M., Ueyama, K., Ishii, Y., Yano, K., Yokoyama, K.: Anal. Chem., 79, 5730 (2007).