【トピックス】
好熱性シアノバクテリア由来Photosystem Iの安定化技術の開発と太陽電池への応用
松本和也、大島敏久
九大院・農
1.はじめに
近年の地球温暖化や原発リスクへの関心の高まりから、従来の化石燃料や原子力に代わる再生可能な代替エネルギーの開発が求められている。代替エネルギーの中でも、太陽光のエネルギーを直接的に電力に変換する太陽電池への注目は高く、低炭素社会の成長産業として期待されている。太陽電池の普及には、他の電源と比較して割高な発電コストの低減が必要であり、発電コストの大部分を占める太陽電池本体価格の低減を目指した発電出力の更なる向上に関する開発が進められている。
一方、自然界には太陽電池をはるかに上回る効率で光エネルギーを電力 (還元力) に変換するタンパク質複合体として、PhotosystemI (PS-I) やPhotosystemⅡ (PS-Ⅱ) が存在する。PS-Iは、光合成を行う細菌、シアノバクテリア (藍藻)、藻類、植物の全てが保有する反応中心のうちの1つであり、チラコイド膜上に膜貫通タンパク質として存在し、光を捕捉し膜の表裏での電荷分離を引き起こすことによって、電子をルーメン側からストロマ側に移動させる。その光エネルギーの利用効率はほぼ100%と非常に高いエネルギー変換効率を有しており1)、太陽電池への応用が実現すると、理論上、現在主流のシリコン系太陽電池 (変換効率20%) を大幅に上回る発電効率が期待できる。
PS-Iの太陽電池への応用のためには、その複雑なタンパク質複合体構造をin vitroで安定に保つ技術の開発が不可欠である。好熱性シアノバクテリアThermosynechoccus elongatusのPS-Iは、分子質量が1.07 MDaのホモ3量体からなる巨大タンパク質複合体構造をとっている。その単量体は12個のタンパク質と、127個のコファクターからなる複雑な複合体を形成しており、34個 (3量体のPS-I全体では102個) の膜貫通αへリックスを持ち、PS-I全体は脂質二重膜中に包埋されている2)。このように、PS-Iが多数の膜貫通へリックスを持ち、チラコイドの脂質二重膜と複雑に相互作用していることは、PS-Iの応用開発を困難なものにしている。
このような背景の下、筆者らは、超高性能光エネルギー変換素子として利用するためのPS-I活性の維持と安定化に関する技術、及びその技術を発展させた太陽電池の開発に成功した。本稿では、先ずタンパク質との相互作用を制御できる両親媒性ペプチドを利用したT .elongatus由来PS-Iの活性促進・安定化技術、および同様の効果をより低濃度で示すポリアミノ酸の開発について、続いて、安定化したPS-Iを利用した太陽電池の開発について述べる。
2.両親媒性ペプチドによるPS-Iの高活性化
細胞や細胞小器官の脂質二重膜中に存在する膜貫通タンパク質の多くは、機能解析や応用開発のために膜から水溶液中に可溶化すると、立体構造が壊れ変性失活を伴う凝集を引き起こす。これを防ぎ、安定化を図るために、一般的にはグリセロールやスクロースのような糖類、Triton X-100のような界面活性剤、アルコール、ペプチド、合成ポリマーなどの添加剤がタンパク質の種類に応じて利用されている。一方、膜貫通タンパク質であるPS-Iの安定化剤に関しても、これまで色々な安定化剤の検討が行われきたが、多分に経験的手法がとられ、安定化剤とPS-Iとの相互作用の解析などに基づく科学的な検索は殆ど行われてこなかった。そこで、松本らは、PS-Iの安定化剤として各種両親媒性ペプチドについて検討し、新しい技術を見出したので、以下に解説する。
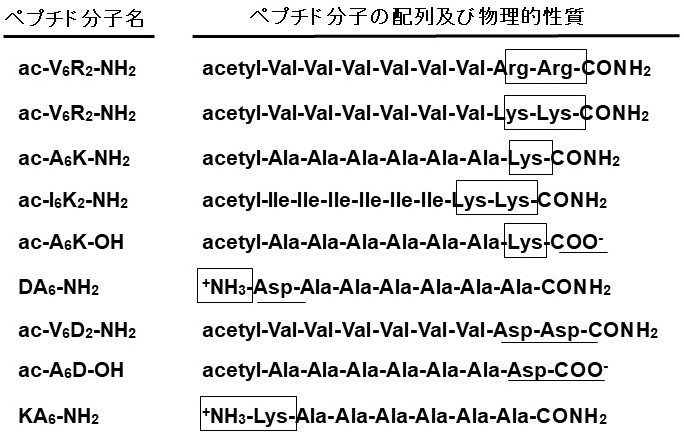
両親媒性ペプチドは、膜貫通タンパク質との相互作用を制御することを目的として開発されたペプチドである3,4)。従来から一般的に利用されているTriton X-100のような界面活性剤よりも膜貫通タンパク質に対してのダメージが少ない等の穏和な作用を示し、またその構成アミノ酸の種類やデザインを変更することで膜貫通タンパク質とペプチド間の相互作用の強度を調整できる利点がある。マサチューセッツ工科大学のZhangらのグループは、両親媒性ペプチドが、水溶液中のEscherichia coli由来膜結合型グリセロール-3-リン酸デヒドロゲナーゼ5)、Enterococcus casseliflavus由来NADHペルオキシダーゼ5)、Gタンパク質結合型受容体であるウシロドプシン6) を、一般的な界面活性剤より効果的に安定化できることを報告している。またホウレン草由来のPS-Iの構造が、機能性カチオン両親媒性ペプチドacetyl-AAAAAAK-NH2の添加によって、乾燥状態でも維持されることを、PS-Iのクロロフィル蛍光変化で確認している7)。この両親媒性ペプチドの特徴を生かし、アミノ酸の配列や組成の異なる9種類のペプチドを合成し (図1)、PS-Iの水溶液中での可溶化と安定化への効果を解析した。植物 (ホウレン草、カエデ、オーク等)、及び微生物 (シアノバクテリア) 由来のPS-Iについて精製法を検討した結果、精製操作での失活が少なく高純度な標品を簡便に調製できた好熱性シアノバクテリアT. elongatus由来のPS-Iを安定化の解析に用いた。また、水溶液中でのPS-Iの安定化効果は光応答電子移動活性の測定から評価した。

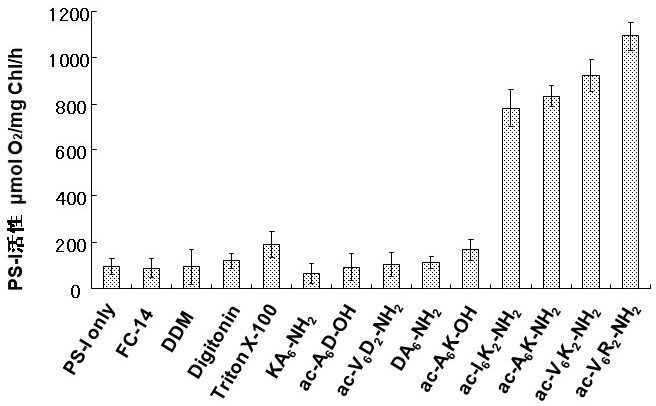
その結果、acetyl-AAAAAAK-NH2 (ac-A6K-NH2) やacetyl-VVVVVVRR-NH2 (ac-V6R2-NH2) 等のC末端側に陽イオン性アミノ酸残基を持つ両親媒性ペプチドが、一般的な界面活性剤であるTriton X-100やn-dodecyl-β-D-maltopyranoside (DDM) 等の10倍ものPS-I活性化効果を有することを見出した。一方、acetyl-AAAAAADOH (ac-A6D-OH) 等の陰イオン性両親媒性ペプチドや、acetyl-AAAAAAK-OH (ac-A6K-OH) 等の中性両親媒性ペプチド、及びN末端側に陽イオン性残基を持つNH3+-KAAAAAA-NH2 (KA6-NH2) では活性の上昇は認められなかった (図2)。

この両親媒性ペプチドとPS-Iとの相互作用の機構を明らかにするため、原子間力顕微鏡 (Atomic force microscopy: AFM) 分析による両親媒性ペプチド-PS-I複合体の形態観察を行い、両親媒性ペプチドがPS-Iを包埋した小胞を形成することを見出した (図3)。このペプチド小胞は、PS-Iを活性化するac-A6K-NH2だけでなく、その効果が認められないac-A6D-OHの場合も形成された。そこで其々のペプチド小胞の安定性を評価するため、小胞内からの蛍光色素の漏出速度の測定を行った。その結果、PS-Iを活性化しないac-A6D-OHやKA6-NH2の場合の小胞よりも、PS-Iを活性化するac-A6K-NH2の場合の小胞は構造強度が著しく高いことを見出した。このことからPS-Iの安定化に伴う高活性の維持には、両親媒性ペプチドの正電荷と強固な小胞を形成する能力が重要な役割を果たしているという作用機構に関する知見を得ることに成功した8)。

![]()
3.ポリアミノ酸によるPS-Iの高活性化
前章で述べたように両親媒性ペプチドは、PS-Iの安定化・活性化に顕著な効果が有ることが示された。しかし、合成ペプチドは高価な化合物であるため、PS-Iを用いる装置の実用化の際には、より安価、且つ低濃度でも効果が高いものが望ましい。そこでPS-Iの近傍に正電荷が高密度で存在することが活性の増強と安定化に必要という、上記の両親媒性ペプチドの結果から得られた成果を踏まえ、類似の特徴を持ち、より安価なイオン性のポリアミノ酸誘導体による効果を次に検討した。
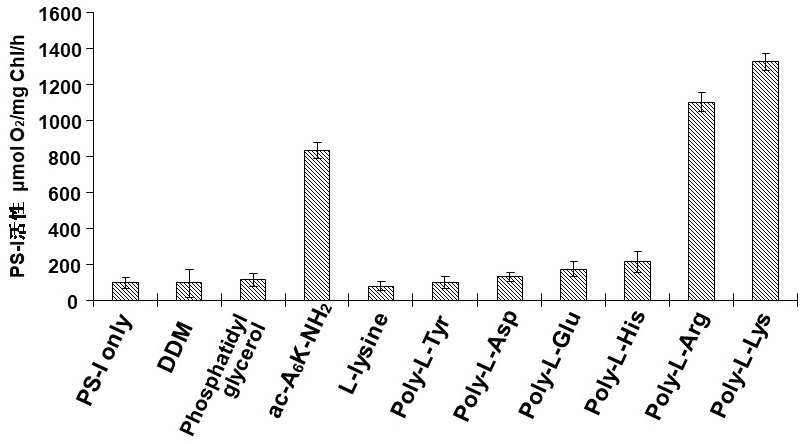
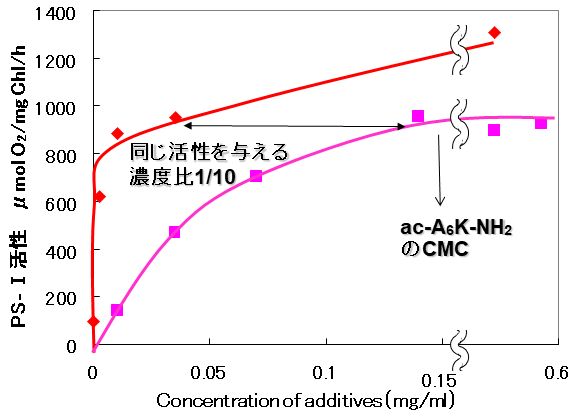
その結果、期待通り、陽イオン性のポリ-L-リジンやポリ-L-アルギニンが、水溶液中でのPS-I活性を大幅に増大させることを見出した (図4)。ポリ-L-グルタミン酸等の陰イオン性ポリアミノ酸、疎水性のポリ-L-チロシンの場合にはそのような効果は認められなかった。また、ポリ-L-リジンを添加した場合には無添加に比較して14倍の活性増強効果が得られ、ac-A6K-NH2を使用した場合と比べて約1/10の低濃度 (約0.01 mg/ml) でも同じ効果が維持できることが分かった (図5)。また、AFMを利用してポリアミノ酸-PS-I複合体の形態を分析した結果、ポリ-L-リジンやポリ-L-アルギニン添加はPS-Iのホモ3量体構造の形成を促進することが分かった (図6)。このことからポリ-L-リジンやポリ-L-アルギニンはPS-Iに対し3量体構造 (4次構造) の形成を促進・安定化させ、それを活性化することが明らかとなった。また、ポリアミノ酸を添加したPS-Iでは、凍結乾燥状態で長期間保存後においても高活性が維持され、その添加は長期保存にも有効であることが示された。ポリアミノ酸は分子構造が単純であり、微生物による大量生産も可能なことから、合成ペプチドより安価に製造することができることでも優れていると言える。このように陽イオン性ポリアミノ酸はPS-Iの活性の増強と安定化を従来よりも安価に達成させるので、PS-Iのバイオ電池などの開発に有用性が期待できる9)。
![]()
![]()


4.PS-Iの太陽電池への応用
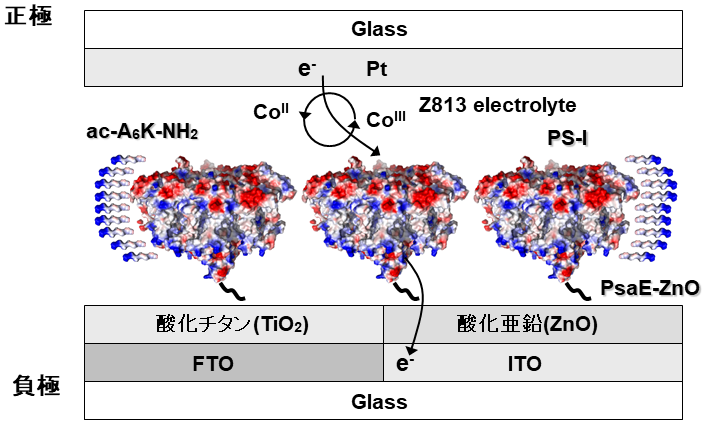
以上開発したPS-I活性化技術を応用した太陽電池を試作した。PS-Iの電極上への固定にあたっては、PS-Iの安定化と同時にその配向の制御が重要となる。そこで無機半導体である酸化亜鉛表面に親和性を有するZnOペプチドタグ (24アミノ酸残基タグ:RSNTRMTARQHRSANHKSTQRARS)10) と、PS-Iのストロマ側に配向する10kDaのサブユニットであるPsaEとの融合タンパク質PsaE-ZnOを、遺伝子工学的に作製した。このPsaE-ZnOタンパク質をPS-Iとインキュベートし、PS-I複合体中の天然型PsaEと交換することで、ZnOペプチドタグ化PS-Iを調製した。それを両親媒性ペプチドac-A6K-NH2と混和後、酸化亜鉛電極、及び酸化チタン電極にZnOペプチドタグの親和力を用いて、分子配向性を有する固定化を行った。このPS-I固定化電極を用いた太陽電池の作製にあたっては、スイス連邦工科大学のGraetzelらの協力を得るとともに、彼らの色素増感太陽電池の設計を参考にした11)。PS-Iが光応答電子を電極に受け渡した後に、PS-Iが放出した電子を補って電気回路を形成するために、メディエーターとしてコバルトイオンを含むZ813 electrolyteを利用した (図7)。試作したPS-I太陽電池を用いて光発電に成功し、起電力 (electrical power density) 81µW/cm2、起電密度 (photocurrent density) 362µA/cm2の値を達成した。これまで報告されたPhotosystemベースの太陽電池と比べ、4桁上回る高出力が得られた12)。

5.おわりに
本研究において、PS-Iの太陽電池への応用のため分子設計した両親媒性ペプチド、及びポリアミノ酸によるPS-I活性の増強に成功し、また無機物質表面親和性ZnOペプチドタグによるPS-Iの配向を制御した固定化技術の開発にも成功した。試作できたPS-I太陽電池は、これまでに開発されたPhotosystemベースの太陽電池に比べて、出力が格段に優れていた。しかし現時点ではシリコン系太陽電池の出力と比較するとまだ十分とはいえない。今後、電極表面へのPS-Iの固定化密度の向上、最適なメディエーターの選定などの改良を加えることで、更に高い出力が得られる装置の開発が期待できる。
生体内において膜貫通タンパク質は、PS-Iに代表されるエネルギー変換、ホルモン受容体のような情報伝達、イオンチャンネル等の物質輸送を担う重要な高機能分子である。これら膜貫通タンパク質の活性は、環境変化に応じて制御されており、その制御には膜貫通タンパク質の4次構造の変化が関与すると考えられている13)。本研究により両親媒性ペプチドは、膜貫通タンパク質の安定化に利用できるだけでなく、PS-I活性化の分子機構の解析から明らかになったように、膜貫通タンパク質の4次構造変化と活性の相関を解析するツールとしても利用でき、非常に有用性が高いと言える。また、ここで用いた両親媒性ペプチドの分子設計を行い、タンパク質の活性化や構造の安定化条件を解析し、その知見を基にポリアミノ酸のような、より安価で実用に好都合な物質を見出す手法は、不安定なために応用面での利用が遅れている多くの膜貫通タンパク質の研究開発に有効な技術となることが期待できる。本稿で紹介した各種ペプチドの利用技術が、バイオテクノロジーにおける膜貫通タンパク質の利用を検討する際の参考となれば幸いである。
文献
1) Marcus, R. A., Sutin, N.: Biochim. Biophys. Acta., 811, 265 (1985).
2) Jordan, P., Fromme, P., Witt, H. T., Klukas, O., Saenger, W., Krauss, N.: Nature, 411, 909 (2001).
3) Vauthey, S., Santoso, S., Gong, H., Watson, N., Zhang, S.: Proc. Natl. Acad. Sci. USA, 99, 5355 (2002).
4) von Maltzahn, G., Vauthey, S., Santoso, S., Zhang, S.: Langmuir, 19, 4332 (2003).
5) Yeh, J. I., Du, S., Tortajada, A., Paulo, J., Zhang, S.: Biochemistry, 44, 16912 (2005).
6) Zhao, X., Nagai, Y., Reeves, P. J., Kiley, P. J., Khorana, H. G., Zhang, S.: Proc. Natl. Acad. Sci. USA, 103, 17707 (2006).
7) Kiley, P., Zhao, X., Vaughn, M., Baldo, M. A., Bruce, B. D., Zhang, S.: PLoS Biol., 3, 1180 (2005).
8) Matsumoto, K., Vaughn, M., Bruce, B. D., Koutsopoulos, S., Zhang, S.: J. Phys. Chem. B, 113, 75 (2009).
9) Matsumoto, K., Zhang, S., Koutsopoulos, S.: Biomacromolecules, 11, 3152 (2010).
10) Kjærgaard, K., Sorensen, J. K., Schembri, M. A., Klemm, P.: Appl. Environ. Microbiol., 66, 10 (2000).
11) Graetzel, M.: Nature, 414, 338 (2001).
12) Mershin, A., Matsumoto, K, Kaiser, L., Yu, D., Vaughn, M., Nazeeruddin, M. K., Bruce, B. D., Graetzel, M., Zhang, S.: Sci. Rep., 2, 234 (2012).
13) Uchida, H., Banba, S., Wada, M., Matsumoto, K., Ikeda, M., Naito, N., Tanaka, E., Honjo, M.: J. Mol. Endocrinol., 23, 347 (1999).