【トピックス】
高分解能結晶構造に基づく光合成水分解・酸素発生の分子機構
沈 建仁
岡山大院・自然科学研究科
1.はじめに
光合成は、太陽の光エネルギーを利用してCO2と水から有機物を合成する一連の反応の総称である。この一連の反応の中で、最初に起きるのが光エネルギーを利用した水分解・酸素発生反応であり、チラコイド膜に存在する光化学系II (Photosystem II, 以下PSIIとする) と呼ばれる複合体がこの反応を触媒している。この反応によって放出される酸素が大気中に供給し続けられることによって、現在のような好気的大気環境を維持することが可能になり、また、水分解によって得られるプロトンと電子は、それぞれ高エネルギー物質であるATPとNADPHの合成に利用され、最終的にCO2からの有機物合成に使用されることになる。したがって、PSIIによる水分解反応は光合成だけでなく、地球上ほぼすべての生物の生存にとっても重要であると言える。しかし、PSIIは17種の膜貫通サブユニットと3種の膜表在性サブユニットを含む、分子量350 kDaの膜タンパク質超分子複合体であるため、その高分解能結晶化・構造解析が困難と思われていた。筆者らのグループは好熱性ラン藻Thermosynechococcus vulcanus由来PSIIについて、標品の純度や結晶化条件の改善により、高分解能結晶の作成に成功し、その構造をSPring-8の放射光を利用して1.9 Å分解能で解析した1,2)。本稿では、得られたPSIIの高分解能結晶構造とそれに基づく水分解反応の仕組みを紹介する。
2.PSIIの全体構造
二量体として存在するPSIIの構造を図1に示す。図1の構造では、1回膜貫通へリックスを持つ低分子量サブユニットの一つPsbYが脱落し、単量体当たり19個のサブユニットがあり、計35本の膜貫通へリックスが存在している。1.9 Å分解能で解析されたPSII構造の最大の特徴の一つは、多くの水分子が見つかったことである (図1)。最終的に決定された構造では、PSII二量体あたり2795個の水分子が同定された。同じ結晶を用いて、1.75 ÅのX線波長で収集した回折データを用いて解析された2.5 Å分解能の構造では、二量体あたり862分子の水しか見つからなかったので1)、水分子の同定に高い分解能が如何に重要かが分かる。
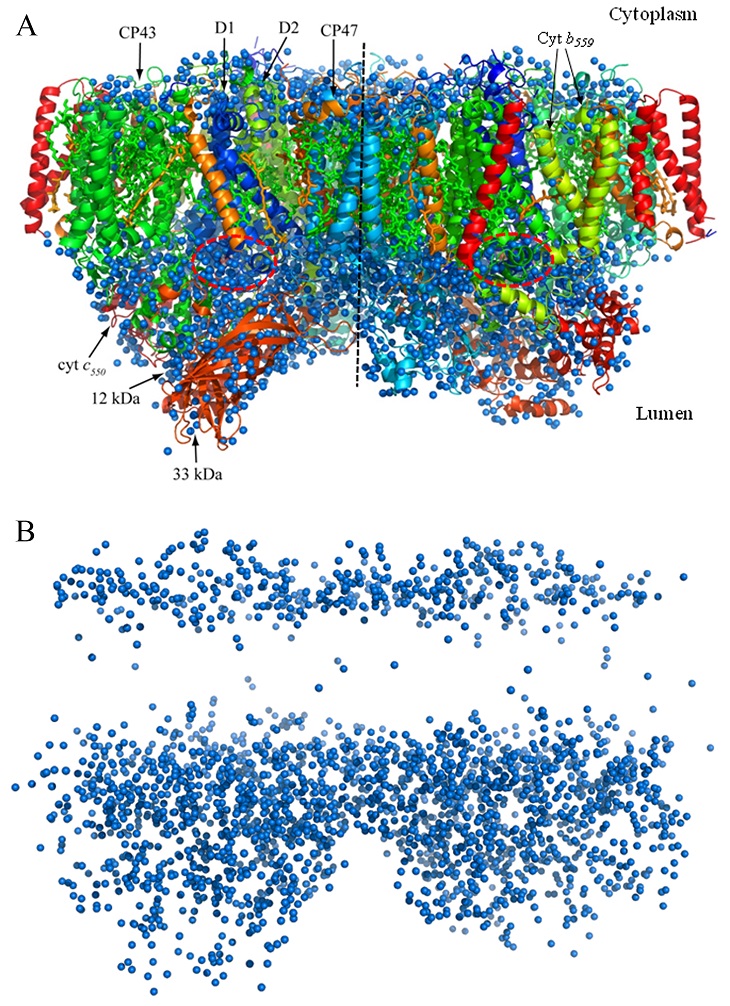

水のほとんどは、チラコイド膜のストロマ表面とルーメン表面という2つの層に分布しており、膜貫通領域にはわずかな水しか存在していない (図1B)。これは膜タンパク質の一般的な特徴とも言えるが、PSIIではチラコイド膜のルーメン側により大きな親水性領域があり、より多くの水分子が分布している。また、水分子は、膜表面から突き出ているD1, D2, CP47, CP43と呼ばれる4つの大きな膜貫通サブユニットの親水性ループや3つの表在性タンパク質の中にも多く存在し、ルーメン側に大きな親水性領域が存在することと対応している。これら水分子には、水分解の触媒中心であるMn4CaO5クラスターの配位子や水素結合ネットワークの形成に関与しているものもあり、PSIIにとって重要な機能の一部を担っている (後述)。
膜貫通領域は疎水性であり、水はほとんど存在しないとされていたが、PSIIの膜貫通領域にはいくつかの水分子が存在し、それらのほとんどはクロロフィルの配位子、あるいはその水素結合相手になって働いている1)。
3.PSIIにおける電子伝達系
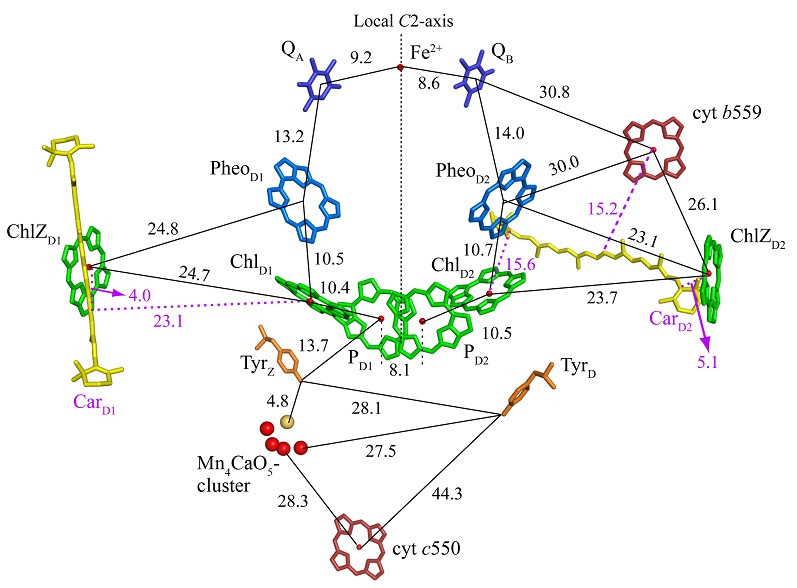
PSIIでは、反応中心のクロロフィルにおいて光エネルギーを吸収し、一連の電子伝達反応を行っている。その電子伝達系の配置を図2に示す。これらの電子伝達成分は、D1, D2と呼ばれる2つの反応中心サブユニットに結合しており、左右で疑似2回対称性を持つ2本のブランチを形成しているが、電子伝達は、左側のD1ブランチでのみ行われる。このような電子伝達活性の非対称性には、左側の水分解触媒のMn4CaO5クラスターの存在 (後述)、反応中心におけるクロロフィル配置の非対称性1)、およびD1, D2両サブユニットのいくつかの対称的な位置でのアミノ酸の相違1,3) などの因子が寄与していると思われる。
![]()
光エネルギーは、まずD1側のChlD1 (アクセサリークロロフィル) によって吸収され、このクロロフィルから電子が励起し、最初の電子受容体であるフェオフィチン (PheoD1) に渡され、さらに結合型プラストキノンであるQA, QBの順に伝達され、最終的にシトクロムb6f複合体、PSIを経由してNADP+をNADPHに還元するのに使用される。一方、電子供与体側では、クロロフィル二量体のうちの一つPD1から電子がChlD1に供給され、そしてPD1は近傍のチロシン残基 (D1-161, YZと呼ばれる) から電子を受け取り、このチロシン残基はMn4CaO5クラスターから電子を受け取る。最後にMn4CaO5クラスターは水から電子を奪い取り、2分子の水から4つの電子が奪い取られ、これに伴って4つの水素イオンが放出されると、水が分解され、1つの酸素分子を生じることになる:
![]()
4.Mn4CaO5クラスターの構造
上記の水分解反応を直接触媒しているMn4CaO5クラスターは、これまで長い間詳細な構造が不明であった。1.9 Å分解能において、この構造をはっきりと同定することができ、Mn4CaO5という化学式であることが初めて明らかになった (図3)。解析されたMn4CaO5クラスター構造の最大の特徴は、ゆがんだ椅子型であるということが言える。このうち、3つのMn,1つのCa,4つのオキソ酸素が歪んだキュバン型の座部を作り、4つ目のMnはその椅子の外側にあり、オキソ酸素を通してつながっている。
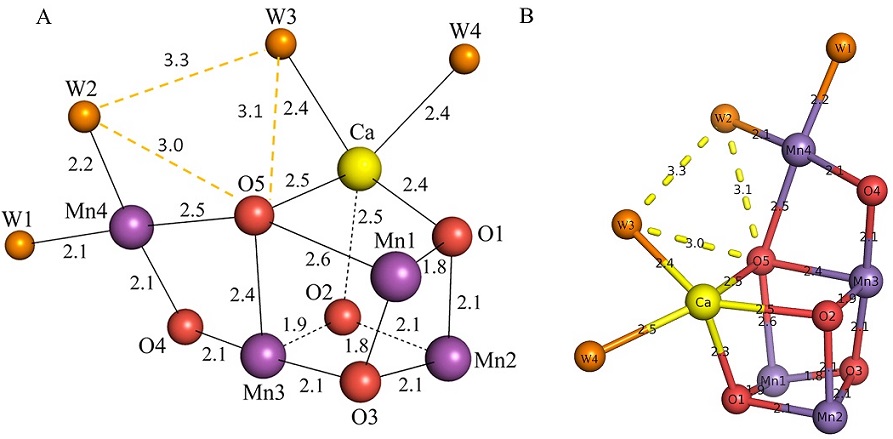

このようなゆがんだ形を作り出している要因は2つあり、1つはMn-O間とCa-O間の結合距離の違い、もうひとつは5つのオキソ酸素の間で、金属イオンとの結合距離に違いがあることである。Mn-Oの典型的な結合距離は1.8-2.1 Åであるが、それに対して、Ca-O間の結合距離は2.3-2.5 Åと明らかに長い。また、5つのオキソ酸素のうち、O1-O4に比べて、O5とMn、あるいはO5とCaとの結合距離が明らかに長くなっていた。例えば、O5-Mn3の距離は2.4 Åで、O5-Mn1, O5-Mn4の距離はそれぞれ2.6 Å,2.5 Åであった。これらの距離は、無機Mn化合物と比較すると長く、結合していないことを示唆している。このことは、5つのオキソ酸素のうち、特にO5は周りの金属イオンとの結合が弱くて切れやすい、言い換えれば、O5が高い反応性を有していることを示唆している。
Mn4CaO5クラスターの構造が非対称で「ゆがんでい る」ことは、水分解反応の触媒機構を考える上で重要意味を持っているかもしれない。水分解の触媒として働くためには、それ自身が反応の過程で構造変化を行い、基質である水の分解に伴い構造が元に戻るという構造上の「柔軟性」を備え持つ必要がある。Mn4CaO5クラスターがもし対称的で規則正しい構造を形成していれば、反応に伴う構造の変化が容易ではなく、触媒活性が発揮できないかもしれない。これは、水分解の人工触媒を合成する上でも重要な意味を持っており、触媒活性を持つ人工触媒を得るには、非均一触媒 (heterogeneous catalysisあるいはasymmetric catalysis) の原理を応用した非対称構造を持つ化合物を見つけることが重要かもしれない。
Mn4CaO5クラスターには、4つの水分子が配位している。そのうち、2つはキュバンの外側にあるMn4に (W1, W2)、残りの2つはCaに結合しており、これら水分子のうちの1つまたは2つは水分解の基質として働いていることを示唆している。上に述べたように、O5が反応部位の一部を形成している可能性が高いことを考えると、O-O結合が形成されるのは、O5付近である可能性が高い。4つの配位水のうち、Mn4に結合しているW2とCaに結合しているW3はO5と最も近く、それぞれO5と水素結合距離内にある。したがって、O5, W2, W3のうちのどれか2つの分子種が水分解の基質として働き、O-O結合を作っていることが示唆された。
オキソ酸素と水以外に、7つのアミノ酸がMn4CaO5クラスターの配位子として働いていることが分かった (図4)。このうち、6つがカルボキシル基で、1つがHis残基であった。カルボキシル基のうち、1つがCP43というサブユニット由来のGlu354で、他はすべてD1サブユニットのものであった (D1-Asp170, Glu189, Glu333, Asp342, およびC末端であるAla344)。そして、His残基もD1由来のHis332であった。His残基はMnと1本の結合を作っているが、カルボキシル基のうち、D1-Asp189以外はすべてそれぞれ2つの金属イオンにブリッジする形で2本の結合 (bi-dendate結合) を作っている。その結果、すべてのMnには6つの配位子、そしてCaには7つの配位子が存在していることになる。
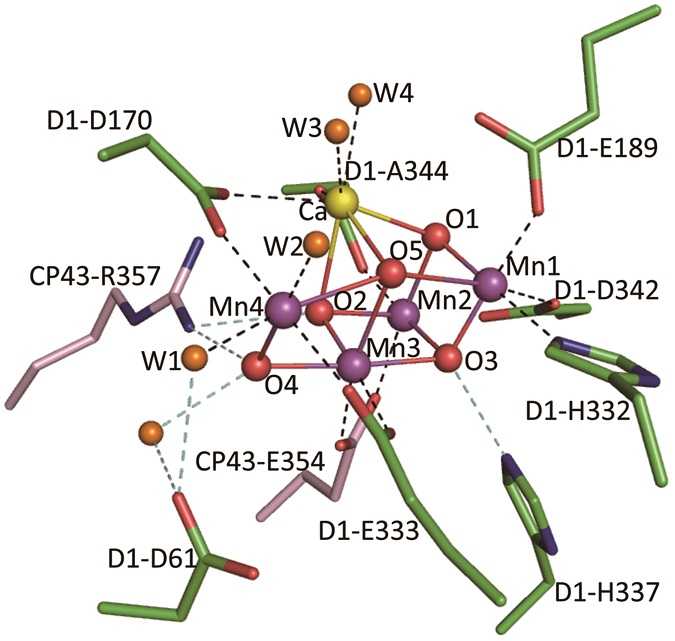
図4 Mn4CaO5クラスターの配位構造。
5.水素結合ネットワーク
水分解反応において、2分子の水が分解される時、4つのプロトンが放出されることになるが、Mn4CaO5クラスターはチラコイド膜の表面に存在し、大きな親水性タンパク質領域に覆われているので、プロトンを素早く複合体表面、ルーメン側のバルク溶液に排出する必要がある。このようなプロトンの排出経路として、1.9 Å分解能構造ではMn4CaO5クラスターと複合体表面をつなぐ水素結合ネットワークが複数個見つかった。そのうちの典型的なものを2つ紹介する。
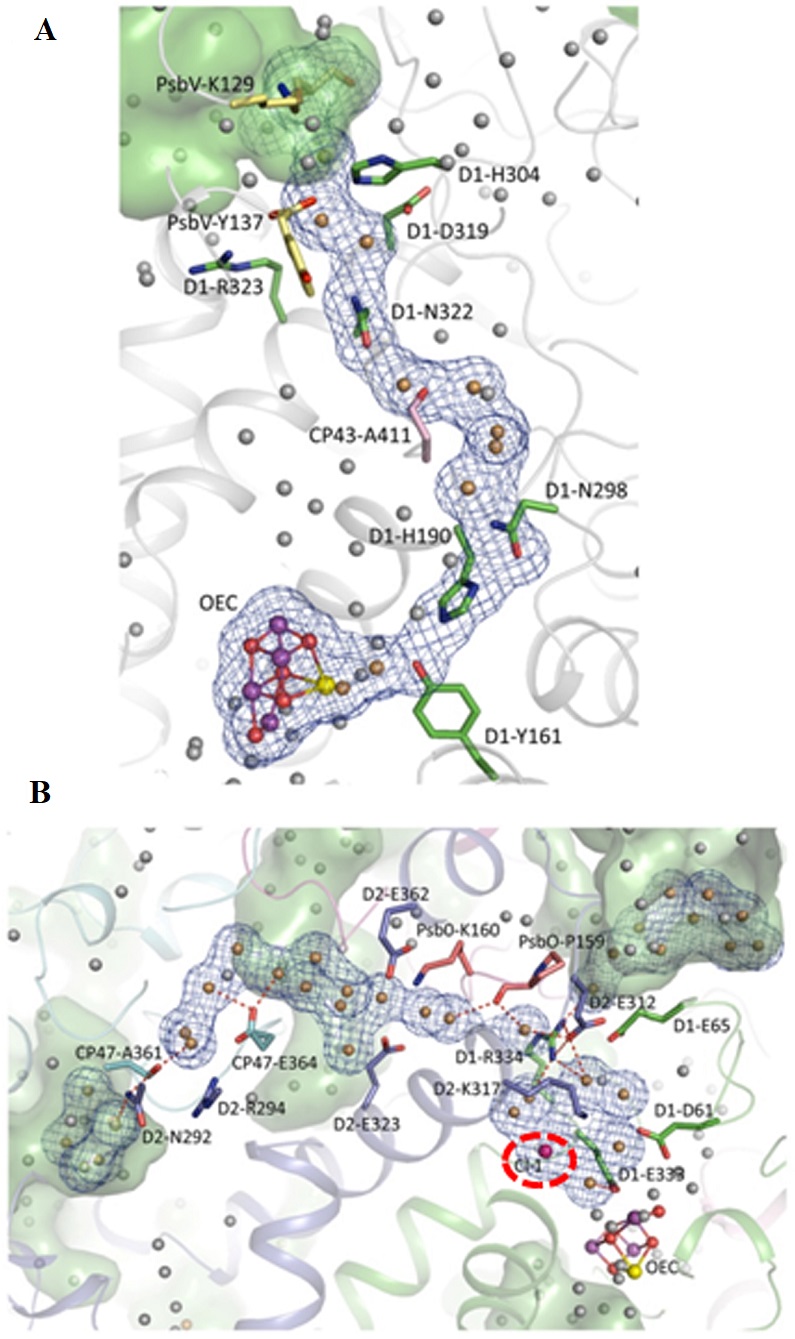
水素結合ネットワークの1つはYZを経由したものである。YZがPSIIの反応中心クロロフィルとMn4CaO5クラスターの間の電子伝達だけでなく、水分解に伴うプロトンの排出にも関わっていることは以前から示唆されていた4,5)。高分解能構造において、YZはCaに結合している水分子W4と直接、またはW3、さらにMn4に結合しているW1, W2とは別の水分子を経由して間接的に水素結合でつながっている (図5A)。一方、Mn4CaO5クラスターの反対側でYZはD1-His190と水素結合し、D1-His190はさらにD1-Asn298や他のいくつかの荷電/親水性アミノ酸、および水分子と水素結合ネットワークを形成し、このネットワークは最終的にルーメン側の溶液と接している。したがって、このネットワークはMn4CaO5クラスターからルーメン側溶液へのプロトンチャンネルとして働いている可能性がある。このネットワークは、YZの電子伝達活性と連動していることから、PCET (proton-coupled electron transfer) パスとも呼ばれている。
水素結合ネットワークの2つ目の例は、Mn4に結合している水分子の1つであるW2を起点として、D1-Asp61,Cl-1、およびいくつかの荷電/親水性アミノ酸、水分子によって構成され、最終的にルーメン側溶液に接している (図5B)。このうち、Cl-1はMn4CaO5クラスターの近傍に見つかった2つの塩素結合部位のうちの1つで6,7)、これを通したプロトンチャンネルは以前の構造で示唆されていたが8-11)、水素結合ネットワークが形成されていることは高分解能の構造で初めて明らかになった。Cl-1はMn4CaO5クラスターからの水素結合ネットワークの起点に近い位置にあり、プロトンチャンネルの構造維持に役立っているかも知れない。

6.おわりに
2.0 Å分解能を超える膜タンパク質複合体の構造解析において、PSIIはこれまで最大のものである。これによって水分解の触媒中心であるMn4CaO5クラスターの詳細な構造、水分子の存在位置、水素結合ネットワークなど多くの新しい知見が得られ、水分解・酸素発生の反応部位についても重要な情報が得られた。しかし、解析された構造は主に暗黒で安定な状態 (S1状態) のものであり、この構造のみから水分解の反応機構を決定することは困難である。今後はS状態遷移に伴う中間状態の構造を解明する必要がある。また、プロトンチャンネル、水チャンネルを明確に同定するには、各水素結合ネットワークを構成しているアミノ酸残基を改変し、得られた変異株の構造・機能解析を行う必要がある。さらに酸素チャンネルの同定も必要であるが、これは疎水性チャンネルの可能性が高く、酸素に近い性質を持つ不活性化ガスを導入した結晶構造解析を行う必要がある。そしてPSIIの多くの構成サブユニット、特に10 kDa以下の低分子量サブユニットの機能を解明するため、それぞれの欠失変異体の構造・機能解析を行い、サブユニットの欠失により引き起こされる構造変化を明らかにする必要がある。
なお、本稿で述べた筆者らの研究は、神谷信夫、梅名泰史、川上恵典諸博士との共同研究であり、この場を借りて深くお礼を申し上げる。
文献
1) Umena, Y., Kawakami, K., Shen, J.-R., Kamiya, N.: Nature, 473, 55 (2011).
2) Kawakami, K., Umena, Y., Kamiya, N., Shen, J.-R.: J. Photochem. Photobiol. B, 104, 9 (2011).
3) Saito, K., Ishida, T., Sugiura, M., Kawakami, K., Umena, Y., Kamiya, N., Shen, J.-R., Ishikita, H.: J. Am. Chem. Soc., 133, 14379 (2011).
4) Hoganson, C. W., Babcock, G. T.: Science, 277, 1953 (1997).
5) Tommos, C., Babcock, G. T.: Biochim. Biophys. Acta, 1458, 199 (2000).
6) Murray, J. W., Maghlaoui, K., Kargul, J., Ishida, N., Lai, T.-L., Rutherford, A. W., Sugiura, M., Boussac, A., Barber, J.: Energy Environ. Sci., 1, 161 (2008).
7) Kawakami, K., Umena, Y., Kamiya, N., Shen, J.-R.: Proc. Natl. Acad. Sci. USA, 106, 8567 (2009).
8) Murray, J. W., Barber, J.: J. Struct. Biol., 159, 228 (2007).
9) Ho, F. M., Styring, S.: Biochim. Biophys. Acta, 1777, 140 (2008).
10) Guskov, A., Kern, J., Gabdulkhakov, A., Broser, M., Zouni, A., Saenger, W.: Nat. Struct. Mol. Biol., 16, 334 (2009).
11) Gabdulkhakov, A., Guskov, A., Broser, M., Kern, J., Müh, F., Saenger, W., Zouni, A.: Structcure, 17, 1223 (2009).