【トピックス】
一つの活性中心で二つの反応を触媒する酵素超好熱菌FBPA/Pの二機能性の構造基盤
若木高善
東大院・農
1.はじめに
Beadle&Tatumは、遺伝子の実態が明確でない1940年代初めに、カビの栄養要求性変異株の解析から、「一つの遺伝子は一つの酵素に対応する」と考えた。この考えは「一つの遺伝子が一つのタンパク質を規定する」と一般化され、実際に鎌形赤血球貧血症の異常ヘモグロビンの研究などを通して、確認されていった。
酵素は反応特異性が高く、特定の反応しか触媒しない。アミノアシルtRNA合成酵素などは、基質を取り違えれば突然変異を招くことになるので、極度に高い基質特異性を示す。逆に、特異性が緩くて、グルコースでもガラクトースでもアラビノースでもキシロースでも酸化してしまうような解糖系初段酵素が報告されている。このような酵素は“promiscuous”と形容されるが、どの基質も同じ反応機構によって脱水素されて対応する酸に変換されるので、反応自体は一種類である。
稀に、二機能性 (bifunctional) の酵素と呼ばれるものがある。この種の酵素においては、一つの酵素が二つの異なる反応を触媒するが、ほとんどの場合、構造上歴然と区別される二つのドメインから成り立ち、その各々が異なる酵素として働く。一例として、ホスホフルクトキナーゼ2 / フルクトース- 2,6 - ビスホスファターゼ (PFK2/F26BPase) という酵素がある。
従来「二機能性酵素」と呼ばれていたものには、このように、特異性の広いものから二つのドメインの各々が二つの反応を受け持つものがあり、その他にも、酵素としての触媒機能とは別に翻訳反応の調節機能をも兼備するもの (たとえばアコニターゼ) も含まれることがある。いずれにしても、一つの活性中心で二つの異なる化学反応をこなすものは知られていなかった。
2010年に、ドイツのFuchsのグループは、超好熱菌のFBPアルドラーゼ (FBPA) を探索した結果、従来報告されていたFBPホスファターゼ (FBPP) とFBPAとが同一の酵素であることを発見した1)。一つの酵素が反応機構の異なる二つの反応をどのようにおこなうのかが次の問題であった。最近我々は、これらの反応を一つの活性中心で遂行するために微細な構造変化を起こしていること、それこそがこの二機能性酵素の反応機構であることを発見した2)。
この小論では、“FBPA/Pが従来の二機能性酵素とは異なる、一活性中心二反応酵素である”、という新しい概念を打ち出した研究の流れを追い、その反応機構について述べてみたい。
2.独立栄養性超好熱性古細菌の糖新生機構
生命誕生の初期には、すべての生命体は、炭酸ガスのような無機炭素化合物からすべての有機化合物を合成する「独立栄養性」であったと考えられている。また、初期の生命は生育至適温度が80℃以上の「超好熱性」であったとも考えられている。超好熱菌の大部分はWoeseが1977年/1990年に提唱したArchaebacteria/Archaea (古細菌と呼ぶことにする) のグループに属する3,4)。超好熱性の古細菌は、熱水中で誕生した最初の生物の末裔であると考えられる。現存の超好熱性古細菌の中には独立栄養性のものがあり、炭酸ガスからアセチルCoA、有機酸を経て糖に至る代謝系路は極めて重要である。これらには、炭酸をアセチルCoAへと固定するカルビン回路 (還元的ペントースリン酸回路)、還元的TCA回路、還元的アセチルCoA経路、3-ヒドロキシプロピオン酸二重回路、ヒドロキシプロピオン酸-ヒドロキシブチル酸回路、ジカルボキシレート-ヒドロキシブチル酸回路などがあり、生成したアセチルCoAはピルビン酸等の有機酸に変換され、「糖新生系路」を経由してグルコースなどの六炭糖へと代謝されてゆく5)。糖新生系路の途中で、三炭糖のリン酸化物 (トリオースリン酸) であるグリセルアルデヒド-3-リン酸 (GAP) とジヒドロキシアセトンリン酸 (DHAP) とが縮合して六炭糖であるフルクトース-1,6-ビスリン酸 (FBP) が形成される段階がある。この反応は可逆的であり、酵素FBPアルドラーゼによって触媒される。FBPは脱リン酸化酵素であるFBPaseによってフルクトース-6-リン酸 (F6P) と無機リン酸に分解され、F6Pは二段階の反応を経てグルコースに至る。
独立栄養性の超好熱性古細菌においては、上記の代謝にかかわる酵素がすべて揃っているはずである。ところが、ゲノムが解析されても、それに対応する遺伝子がわからない、ということがよく知られていた。
FBPaseの例を挙げよう。この酵素は、糖新生系において働く、重要な酵素であり、従来クラス1~3の三種類の酵素が知られていたが、上記の独立栄養性超好熱性古細菌には該当する遺伝子が認められなかった。古細菌のFBPaseとして最初に報告されたのは、メタン生産菌のMJ0109という遺伝子産物であって、その機能は従来、イノシトールモノリン酸 (IMP) ホスファターゼとして知られていたが、IMPよりもむしろFBPのほうが基質として好まれることがわかり、古細菌に保存されたタンパク質としてクラス4のFBPaseとして分類されることになった6,7)。ところがその後、別のタンパク質が古細菌の真のFBPaseである、と報告された8)。このタンパク質は、FBPaseの活性を持つだけでなく、その遺伝子を欠損させると菌が糖新生条件では生育しないこと、これに対して同じ菌のクラス4のFBPaseの遺伝子を欠損させても糖新生条件で生育できることから、このFBPaseこそ糖新生に関わる真のFBPaseであると考えられたのである9)。これをクラス5のFBPaseと呼ぶ。
クラス5のFBPaseが提唱された時に我々は直ちに、その重要性から立体構造の解析に着手した。スルホロバスという好酸好熱性古細菌のST0318という遺伝子産物がクラス5のFBPaseであると考えられたので、まず精製した酵素を結晶化した。酵素単独では結晶が出来なかったが、FBP共存下で結晶を得た。X線結晶構造解析法により、ドーナツ状の四量体が重層したホモ八量体構造を得た。基質はサブユニットの界面に、加水分解されることなく直鎖状で結合し、4個のMgが1位のリン酸の近傍に位置していた。FBPは溶液中では直鎖状では不安定であり、活性中心に結合していても直鎖になる必要は無いはずなので、疑問が残った10)。
一昨年、ドイツの研究グループが衝撃的な論文を発表した。彼らは、独立栄養性超好熱性古細菌にはFBPアルドラーゼの遺伝子が見当たらないが、細胞抽出液に酵素活性はあることから、新規のアルドラーゼを探索した。DHAPとGA3Pから形成されるFBPは、直接検出しにくいので外部からFBPase (クラス5) を加えて生ずるF6Pを測定するという方法をとった。無細胞抽出液を分画して、どこにFBPアルドラーゼがあるのか調べようとしたのである。ところが意外なことに、分画した酵素標品など加えなくても、活性があったのである。このことから、FBPase (クラス5) はFBPアルドラーゼの活性も併せ持つ、FBPA/P (FBPアルドラーゼ/ホスファターゼ) と呼ぶべき酵素であることが分かった。さらに彼らは、アルドラーゼ反応の中間体として、DHAPが酵素のLys232と共有結合してシッフ塩基を形成することを示した1)。当時クラス5FBPaseの構造を示したのは、我々の報告したST0318-FBP複合体だけであった。そこでは、直鎖状のFBPのDHAP相当部分とLys232とは17Åも離れており、このままでは反応が不可能であった。従って、DHAPと結合した酵素は、FBPと結合した酵素と,構造的に大きな違いがあるはずである。我々はST0318とDHAPとの複合体の結晶構造解析を行った。
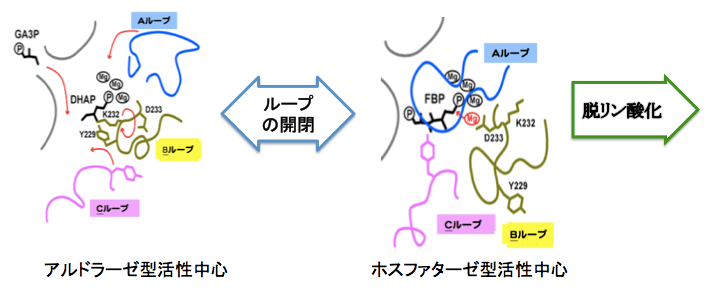
ST0318が、FBPアルドラ−ゼの活性を持つこと、つまりFBPA/Pであることを、先ず確認した。続いて、ST0318をDHAP共存下に結晶化し、X線結晶構造解析を行い、環状のホモ八量体構造を得た。これは以前に得たST0318-FBP複合体とよく似ていたが、詳しく調べると、活性中心部分で、DHAPはLys232とシッフ塩基を形成しており、その近傍にTyr229があった。これらの残基の乗っている「Bループ」は、ST0318-FBP複合体においては大きく移動して、FBP結合部位からは離れており、入れ替わりに二つのループがFBP結合部位を覆うように接近している。すなわち、活性中心にはFBPあるいはDHAPとの結合部位近傍にある三つのループが、基質の結合に応じて相互の位置を変えることによって触媒機能を切り替えている、という仕組みが明らかになった。Lys232はシッフ塩基形成に必須の残基であり、Tyr229は、Alaに置換するとアルドラーゼ活性は激減したがホスファターゼ活性には変化無かったことから、アルドラーゼ反応の酸塩基触媒として働くことが確認された。FBPA/PがDHAPと結合している状態を「アルドラーゼ型」、FBPと結合している状態を「ホスファターゼ型」と呼び、図に示すような反応スキームを提案した2)。ドイツのグループも同様の報告を同時に行った11)。
![]()
3.おわりに
このようにFBPA/Pにおいて、一つの活性中心が基質に応じて三つのループを開閉して二つの機能を発揮するのは、前例の無い反応機構で、生化学の常識である一酵素一反応をくつがえすものとして注目される。この酵素は、原始糖新生系で働いていると思われるが、二つの活性を一つの遺伝子でまかなうことで遺伝子を節約している。また、ある種の超好熱性古細菌の解糖系の初めの2段階の酵素系は”promiscuous”で、グルコース以外の6炭糖でも利用できることが知られている12,13)。これも遺伝子節約のためかも知れない。今回紹介したような二機能性酵素は、原始生命に限定されるものではなく、今後他の生物でも発見されるのではなかろうか。
文献
1) Say, R. F., Fuchs, G.: Nature, 464, 1077 (2010).
2) Fushinobu, S., Nishimasu, H., Hattori, D., Song, H. J., Wakagi, T.: Nature, 478, 538 (2011).
3) Woese, C. R., Fox, G. E.: Proc. Natl. Acad. Sci. USA, 74, 5088 (1977).
4) Woese, C. R., Kandler, O., Wheelis, M. L.: Proc. Natl. Acad. Sci. USA, 87, 4576 (1990).
5) Berg, I. A., Kockelkorn, D., Ramos-Vera, W. H., Say, R. F., Zarzycki, J., Hugler, M., Alber, B. E., Fuchs, G.: Nature reviews. Microbiology, 8, 447 (2010).
6) Stec, B., Yang, H., Johnson, K. A., Chen, L., Roberts, M. F.: Nature structural biology, 7, 1046 (2000).
7) Stieglitz, K. A., Johnson, K. A., Yang, H., Roberts, M. F., Seaton, B. A., Head, J. F., Stec, B.: J. Biol. Chem., 277, 22863 (2002).
8) Rashid, N., Imanaka, H., Kanai, T., Fukui, T., Atomi, H., Imanaka, T.: J. Biol. Chem., 277, 30649 (2002).
9) Sato, T., Imanaka, H., Rashid, N., Fukui, T., Atomi, H., Imanaka, T.: J. Bacteriol., 186, 5799 (2004).
10) Nishimasu, H., Fushinobu, S., Shoun, H., Wakagi, T.: Structure, 12, 949 (2004).
11) Du, J., Say, R. F., Lu, W., Fuchs, G., Einsle, O.: Nature, 478, 534 (2011).
12) Theodossis, A., Walden, H., Westwick, E. J., Connaris, H., Lamble, H. J., Hough, D. W., Danson, M. J., Taylor, G. L.: J. Biol. Chem., 279, 43886 (2004).
13) Lamble, H. J., Theodossis, A., Milburn, C. C., Taylor, G. L., Bull, S. D., Hough, D. W., Danson, M. J.: FEBS letters, 579, 6865 (2005).