【トピックス】
新規液体麹の開発と応用
小路博志
アサヒビール・醸造研
1.はじめに
麹菌は日本の伝統的な醸造産業において古くから用いられている。醸造に必要な様々な酵素を高生産できると共に、安全な微生物として広く認められている。麹菌の培養方法には、蒸煮処理後の原料表面に麹菌の分生子を接種して培養する方法 (固体培養法) と、水に原料およびその他栄養分を添加して液体培地を調製し、殺菌のための加熱・冷却後、麹菌の分生子などを接種し培養する方法 (液体培養法) がある。それぞれの培養物を固体麹または液体麹と呼ぶ。固体麹は一般的に、装置:専用、原料:蒸すことが必要、麹菌:分生子が着生しやすい株、という制限があるが、醸造に必要な多種類の酵素などを大量生産できる大変すぐれた方法である。一方、液体麹は無菌培養ができることに加え、装置:汎用ジャーファーメンター、原料:固体・液体何でもかまわず、麹菌:菌糸植菌もできるので低分生子形成株でも可能、他に培養パラメーターの管理をしやすいという面でも優れた点が多い。しかしながら、従来の液体麹は、複数の酵素を同時高生産するのが苦手な方法であり、固体麹と比較すると、アミラーゼ、セルラーゼなどの酵素の生産性が全般的に低下することが知られていた1)。そのため、醸造産業分野では固体麹を用いる方が一般的であり、液体麹を利用することはきわめて稀であった。筆者らは液体麹でも多種類の酵素を高生産できることが可能となれば、従来はできなかった商品の開発が可能となることを期待し、新規液体麹の製造法について検討した。
2.新規液体麹
筆者らが携わる事業に直結することから、まずは焼酎に応用できる液体麹の開発に取組むこととした。すぐに現場展開するために、培地原料は食品を用いることにし、コンセンサスを得にくい遺伝子組換え麹菌は用いないことにした。また焼酎は高付加価値商品でないため、高価な設備を必要とする培養法も検討項目から外した。
焼酎の醸造工程では、並行複発酵によりアルコールが生成されるため、酵母へのグルコース供給に影響を与える糖質分解関連酵素が非常に重要となる。また、清酒と比較して暖かい地域で製造することが多いため、腐造防止を目的として、低いpH環境下にて醸造する。そこで、筆者らは焼酎醸造工程にて非常に重要となる、低pH環境下でも活性を有するグルコアミラーゼ (GA) 活性と耐酸性α-アミラーゼ (ASAA) 活性を指標に培養法を検討した。
麹菌 焼酎用白麹菌 (Aspergillus kawachii NBRC4308) は、固体培養にてGAとASAAを高生産できるので、まずはこの株を用いて培地検討を進めた。酵素活性測定法は別報を参照していただきたい2)。
培地・培養方法 麹菌を液体培地中で培養する際、原料由来の糖質が可溶化しやすいため、酵素が少量生産された時点でグルコース濃度が高くなる。環境中にグルコースが高濃度で存在すると、糖質分解酵素の生産が抑制される3)。ただし、グルコースが必要量存在しないと、麹菌の生育が遅れ、培養時間が長くなる反面もある。一般的な焼酎原料を用い麹菌の液体培養を試みたが、予想通り高い酵素活性を得ることができなかった。筆者らは、基礎データとして、難分解性糖質を液体麹の炭素源として利用すると、グルコース濃度が低く維持され、酵素生産性が高まることを見いだしていた4)。そこで何らかの方法により、麹原料からのデンプン溶出速度をコントロールできないか考えた。着目したのは穀皮である。通常焼酎原料となる大麦などは、利用しやすいように穀皮を搗精 (とうせい) 工程で除去してある。しかしながら、穀皮にある程度覆われた原料は、穀皮のない原料より分解しにいのでないかと予想した。ラボ搗精機を用いて精麦度の異なる大麦を調製し、無菌液中で糖質分解酵素と反応させた場合のグルコース生成量を比較した (図1)。なお、精麦度100%は玄麦を示す。精麦度が小さくなる (外側がより削られる状態) に従い、グルコース生成量が高くなった。すなわち分解しやすくなることが判明した。一方、これらの原料を粉砕してしまうと、グルコース生成量に差が認められないことから、穀皮の存在が糖質溶出を物理的に抑制するものと考えられた。
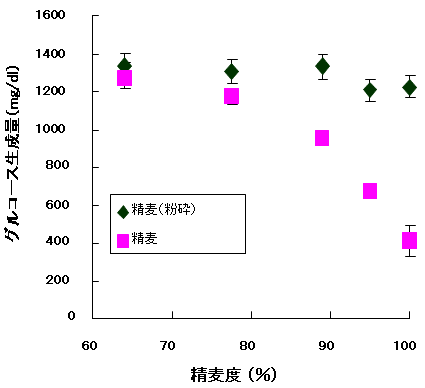
図1
これらの精麦を用いて液体麹を製造した。丸麦 (精麦度65%に相当) 8 gと水100 mlを500 mlバッフル付三角フラスコに張り込み、121℃、15分間オートクレーブ滅菌を行った。これに白麹菌分生子を1白金耳植菌し、37℃、24時間、100 rpmで振とう培養することにより前培養液を得た。次に、各精麦2 gとミネラル水100 mlを500 mlバッフル付三角フラスコに張り込み、121℃、15分間オートクレーブ滅菌した。これに上記の前培養液を1 ml添加した。37℃、48時間、100 rpmで振とう培養することにより本培養液を得た。グルコース生成量が低い精麦 (100%精麦、95%精麦) を用いた液体麹に含まれるGA活性やASAA活性は、当時目標としていたスペックを優に越えていた (図2)。特に液体培養でのASAAの生産については、長時間培養で生産された報告しかなく5)、このような簡便な方法を用いることにより、短時間でGAとASAA両方の同時高生産を達成できたのは初めてである。次に各種原料を用いて培養した際のグルコース量の変化を調べた2)。丸麦、粉砕玄麦、デンプンを用いた場合、培養初期に急激にグルコース濃度が上昇し、培養12時間で0.5%以上となった。一方、穀皮を有する玄麦を用いた場合、グルコース濃度は、培養中常に0.1%以下になっていた (図3)。これらの液体麹のGA活性を比較すると、穀皮を有する玄麦を用いた場合のみ高生産されていた。一方、粉砕した玄麦・デンプン・丸麦を用いた場合は同等のGA活性を示した (図4)。玄麦でのみ高い酵素活性が得られたことより、低いグルコース濃度を保持し続けることで、グルコースリプレッションを回避した可能性が高いと思われる。
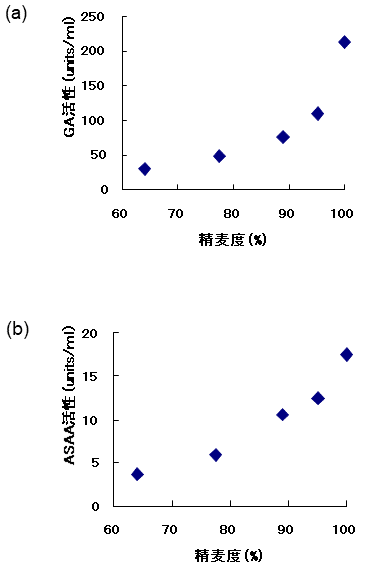
図2
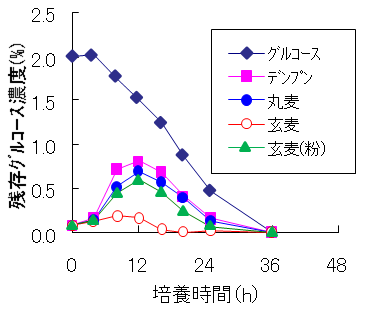
図3
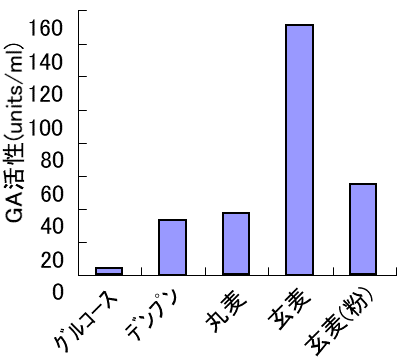
図4
3.液体麹を用いた焼酎製造
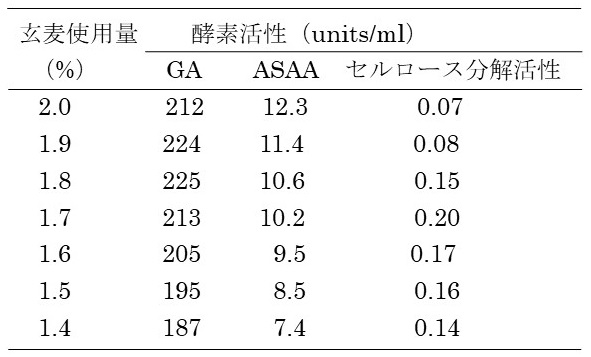
醸造特性向上 洗浄殺菌・培地調製時間を考慮すると、現場で2日に1回の出麹を達成するためには、培養時間は42時間程度に制限される。GAやASAAは、培養12時間くらいから活性が検出される。一方、セルラーゼ系の酵素の中には、培養終期 (36時間程度) から酵素活性が検出されるものがある。玄麦の使用量を減らすことにより、デンプンが早く消費され、培養後期に生産される酵素群の生産時間が増大し、結果として安定生産に寄与しないか検討した6)。玄麦量を2.0〜1.4%の範囲で調製し、42時間培養した (表1)。玄麦使用量を制限しても、GA活性の大幅な低下は認められなかった。大麦添加量の多い方がASAA活性は高かったが、極端に低下しなかった。セルロース分解活性は、中間となる1.7%玄麦使用量の場合が最も高かった。
表1 玄麦使用量を変更した液体麹に含まれる酵素活性比較
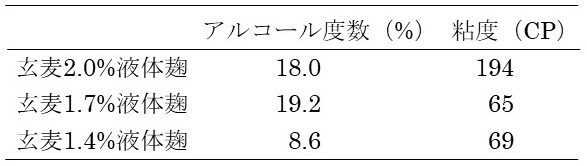
玄麦使用量2.0%、1.7%、1.4%の液体麹を用いて、ラボスケールで発酵試験を試みた (図5)。発酵中に炭酸ガスが放出されるので、もろみ重量が減少する。重量減少積算値の大きい方が、発酵が進んでいることを示す。1.7%の液体麹を用いた場合最も発酵が進んだ (発酵日数削減)。同時にもろみアルコール度数は一番高く (アルコール収得量向上)、もろみ粘度は一番低い (減圧蒸留時の突沸抑制) というメリットも判明した (表2)。培地・培養条件を工夫することにより、さらなる酵素バランスの向上が図れるものと期待している。
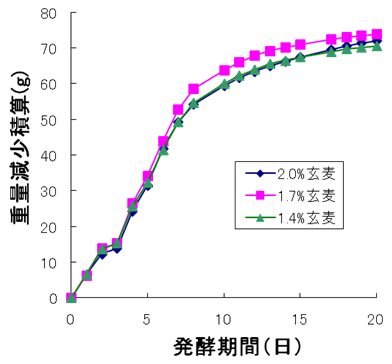
図5
表2 玄麦使用量を変更した液体麹を用いた焼酎もろみ比較
筆者らは、新規な液体麹焼酎の製造法と伝統的な固体麹焼酎の製造法およびブレンド技術を組み合わせることにより、新しいタイプの焼酎「本格麦焼酎 かのか」を上市した。ほどよくふくらみのある飲み口と雑味のないすっきりとした後味が特長となっている。
4.黒麹菌を用いた液体麹について
黒麹菌は、古くから泡盛の製造に使用されている。また、明治以降、九州の焼酎製造にも使われ始めた7)。黒麹菌 (Aspergillus awamori NBRC4388) でも可能であると考え、同様の手法により液体麹の製造を検討した。液体培地として炭素源2%、各種ミネラルを添加した。なお炭素源としては、各種精麦、および粉砕玄麦を用いた。48時間培養終了後のGA活性およびASAA活性を測定した (図6)。白麹菌と同様に、精麦度の高い状態の大麦を用いた液体麹がGAおよびASAA共に高生産された。菌株が異なるためでもあるが、今回作製した黒麹菌の液体麹は、白麹菌のものとは香気に差が認められた。また、酵素バランスも異なると予想されることから、目的により使い分けることが可能となろう。
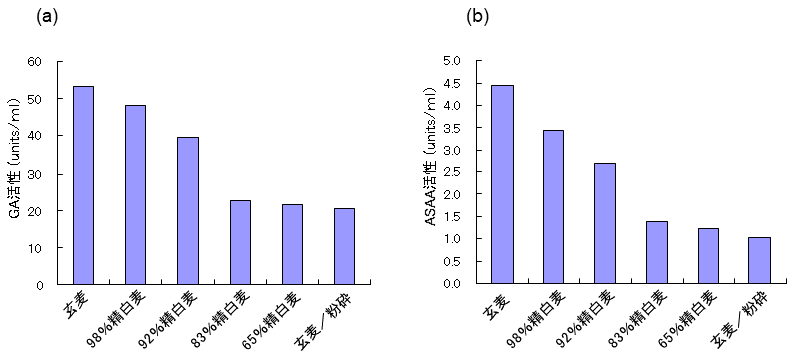
図6
5.黄麹菌を用いた液体麹について
黄麹菌を用いた固体麹は、清酒・みりん・甘酒・味噌・醤油・食酢等の製造に用いられる。代表的な黄麹株であるAspergillus oryzaeにおいてもまた、その液体培養物におけるGA活性が著しく低いことが報告されている8)。黄麹菌でも、清酒等の発酵飲食品製造の鍵酵素となるGAおよびα−アミラーゼ (AA) の活性が高い液体麹を製造できるか検討した。まずは液体麹製造における酵素生産性に対する炭素源の影響を調べるため、以下のような方法で液体麹を製造し、酵素活性を測定した9)。液体培地として炭素源2%、各種ミネラルを添加した。なお炭素源としては、可溶性デンプン、デキストリン、65%精麦、98%精麦、98%精麦をミルで粉砕処理したものを用いた。このように調製した培地に、黄麹菌 (Aspergillus oryzae RIB40) の分生子を植菌し、30℃、72時間、100 rpmで振とう培養した。培養終了後、それぞれの培養上清中のGA活性とAA活性を測定した (図7)。GAは98%精麦の場合でのみで顕著に生産され、一方、これを粉砕した原料や穀皮を有さない原料を用いた場合では酵素生産性が著しく抑制された (図7(a))。AAは生産挙動がGAとは若干異なるものの、やはり98%精麦の場合で多量の酵素を生産した (図7(b))。このように黄麹菌でも、表面が穀皮で覆われた穀類を用いることで、GAやAAといった発酵飲食品の製造に必要な酵素群を同時高生産できることが判明した。
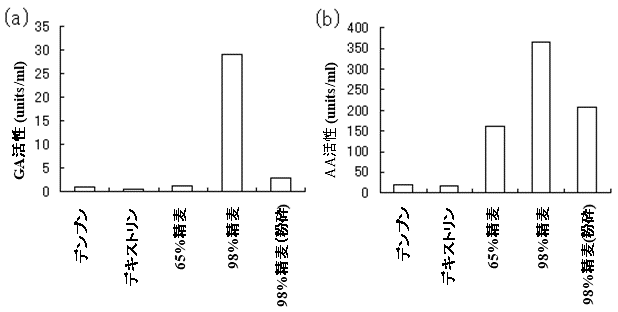
図7
6.紅麹菌を用いた液体麹について
紅麹菌を用いた固体麹 (紅麹) は、古くから中国、台湾等において、紅酒、老酒等の酒類の製造に用いられている。ただし紅麹の生産はきわめて煩雑なため、日本ではあまり普及していない7)。紅麹を用いた液体麹が、各種酵素を生産し、かつ簡便に製造できるのならば、新しい提案が可能になると考えた。白米8 gと水100 mlを500 mlバッフル付三角フラスコに張り込み、121℃、15分間オートクレーブ滅菌し前培養培地とした。この前培養培地に紅麹菌 (Monascus purpureus NBRC4484) 菌糸を1白金耳植菌し、37℃、24時間、100 rpmで振とう培養することにより前培養液を得た。この培養時間で菌体は十分に増殖していた。本培養の培地は、玄米4.0%、各種ミネラルとした。液体培地3000 mlを調製し、容量5000 mlのジャーファーメンターに張り込み、121℃、15分間オートクレーブ滅菌した。この本培養培地へ上記の前培養液を30 ml添加した。その後、温度37℃、攪拌速度300 rpm、通気量0.5 vvmにて48時間培養を行い、液体麹を得た。GA活性は71.7 units/ml、AA活性は32.0 units/mlであった。これらを用いて焼酎の製造が可能であることも判明している10)。
7.液体麹を用いた無蒸煮発酵
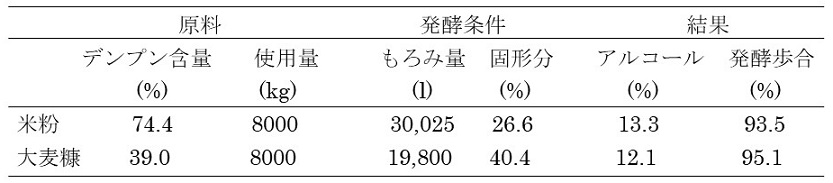
原料を蒸煮せずに糖化させると、糖化工程中の粘度上昇を回避できるため、高濃度仕込みが可能となる。焼酎用麹菌を用いて製造した固体麹のGAとASAAには生デンプン吸着部位が存在するため、生デンプンを糊化せずに直接分解できることが知られている。今回筆者らが製造した液体麹を用いても、生デンプンを直接分解できることが判明した11)。この特性をさらに強化した液体麹を開発し、効率的無蒸煮発酵を検討した。キャッサバはデンプン粒子が大きく、かつ複雑な構造であるため、分解しにくく、無蒸煮発酵の原料として大きなスケールで成功した例はなかった。パイロットプラントを用いて、1.6 kl発酵スケールのキャッサバ無蒸煮発酵を試みた11)。雑菌数は10の5乗オーダー以下をキープし、アルコール度数は10.3%にまで到達した。発酵歩合は92.7%となり、キャッサバ無蒸煮発酵としては、非常に高い数値を得ることができた (図8)。さらに実証設備を用いて、30 kl発酵スケールの米粉、20 kl発酵スケール大麦糠の無蒸煮発酵を試みた (表3)。米粉の場合、雑菌数は10の2乗オーダー付近をキープし、アルコール度数は13.3%にまで到達した。発酵歩合は93.5%と高かった。大麦糠は玄麦から丸麦へと加工する際に発生する副産物である。デンプン含量が少ないため、もろみ中のアルコール濃度を高めるために、固形分40%以上の高濃度仕込みとした。この高濃度仕込みでももろみ粘度が大きく上がらず、雑菌数は10の4乗オーダー以下をキープし、アルコール度数は12.1%にまで到達した。発酵歩合は95.1%と、低デンプン含量原料を用いたにも関わらず、かなり高いものとなった。いずれの場合でも、段仕込みで酵母の優位性を保つ製造法を採用しており、それが功を奏したものと考えている。
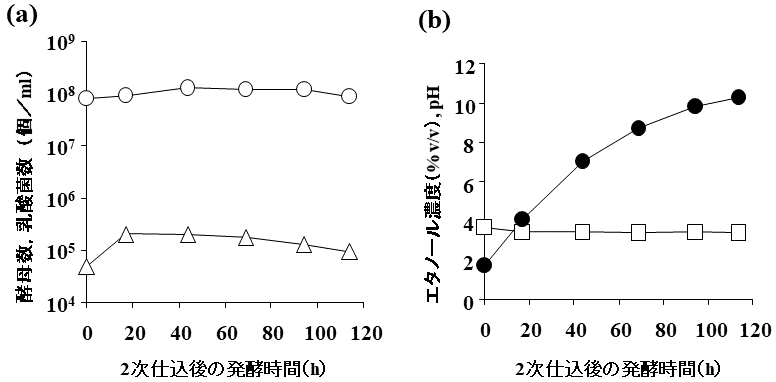
![]()
表3 液体麹を用いた米および大麦糠無蒸煮発酵試験結果
8.おわりに
穀皮で覆われた原料を用いるというコンセプトにより、白麹菌・黒麹菌・黄麹菌・紅麹菌を用いた液体培養による酵素高生産を実現した。酵素バランスや香りなど、目的に応じて麹菌や培地を選択できるというメリットも得られた。白麹菌および黄麹菌液体麹を用いると、清酒・みりん・甘酒・醤油・みそなどを問題なく製造できることも判明している。今回開発した新規液体培養法は、麹菌の物質生産能力を最大限に引き出すのに適した培養技術であると考えており、麹菌の更なる高度利用に貢献できるのでないかと期待している。
文献
1) Iwashita, K., Todoroki, K., Kimura, H., Shimoi, H., Ito, K.: Biosci. Biotechnol. Biochem., 62, 1938 (1998).
2) Shoji, H., Sugimoto, T., Hosoi, K., Shibata, K., Tanabe, M., Kawatsura, K.: J. Biosci. Bioeng., 103, 203 (2007).
3) Ruiter, G. J., Visser, J.: FEMS Microbiol. Lett., 151, 103 (1997).
4) Sugimoto, T., Horaguchi, K., Shoji, H.: J. Ind. Microbiol. Biotechnol., 38, 1985 (2011).
5) 赤尾 健, 須藤茂俊, 佐藤和夫, 大場俊輝:醸協, 89, 913 (1994).
6) 杉本利和, 小路博志: 特許第4113252号.
7) 村上英也:麹学, 日本醸造協会 (1987).
8) Ishida, H., Hata, Y., Ichikawa, E., Kawato, A., Suginami, K., Imayasu, S.: J. Ferment. Bioeng., 86, 301 (1998).
9) 杉本利和, 小路博志: 特許第4068649号.
10) 杉本利和, 小路博志: 特許第4908815号.
11) Sugimoto, T., Makita, T., Watanabe, K., Shoji, H.: J. Ind. Microbiol. Biotechnol., 39, 605 (2012).