【トピックス】
糸状菌由来メロテルペノイド化合物の生合成研究およびその応用
松田侑大、阿部郁朗
東大院・薬
1.はじめに
二百余年前にモルヒネをアヘンより単離して以来、我々は膨大な数の天然有機化合物 (天然物) を手にし、医薬品を始め、種々の材料資源として利用してきた。天然物の大きな魅力は、その構造多様性ならびに、それに付随した多岐にわたる生物活性にある。天然物の複雑でユニークな骨格は、一連の生合成酵素によって生み出される。したがって、これら生合成酵素の機能解析を通じて、天然物の複雑な構造の由来を明らかにすることができるとともに、生合成酵素の機能改変や生合成経路の再構築によって新たな機能を有する新規化合物の創成を行うこともできる。近年、様々な生物種に対してゲノムプロジェクトが展開されたことと相俟って、これら生合成酵素をコードする遺伝子情報を比較的容易に手にすることが可能になり、天然物の生合成研究が飛躍的に加速している。本稿ではその一例として、糸状菌のゲノム上に見出されたメロテルペノイド生合成遺伝子の機能解析や、その応用利用について取り上げる。
メロ (mero-) とは、“部分の”“部分的な”といった意味を持つ接頭辞であり、メロテルペノイドとはすなわち、構造中にテルペノイド骨格を有する化合物の総称である。非テルペノイド部位の多様性とテルペノイド部位の多様性が融合することで、本化合物群は実に大きな構造多様性を有している。その中でも、糸状菌由来メロテルペノイド化合物はとりわけ多様性に富み、同時に、顕著な生物活性を示すものも報告されている1)。例えば、Aspergillus fumigatusの産生するpyripyropene Aはコレステロール貯蔵に関与する酵素acyl-CoA: choresterolacyltransferase (ACAT) を強力に阻害することから、コレステロール低下剤や動脈硬化予防治療薬として臨床応用が期待されており、すでに多数の誘導体の合成や、動脈硬化発症マウスへの投与実験などが行われている化合物である2-4)。このように、糸状菌由来メロテルペノイドは分子構造的にも医薬資源としても大変興味深い化合物群ではあるが、これまでにその生合成遺伝子はほとんど明らかにされていなかった。筆者らは、その端緒を開くべく、pyripyropene AやAspergillus terreusの産生するメロテルペノイドterretoninの生合成研究を行ってきたので、以下に紹介したい。
2.PyripyropeneAの生合成研究-新規膜結合型テルペン環化酵素の発見
Pyripyropene A (1) は、ピリジン環、ピロン環およびファルネシル基に由来する三環性のテルペノイド部位を有する化合物である。その生合成については、標識酢酸の投与実験等を通じて推定がなされてきた。すなわち、開始基質であるニコチン酸 (2) がニコチニルCoA (3) を経て、酢酸経路 (ポリケタイド経路) によりピロン体 (4) へと変換された後、ファルネシル基の付加、末端二重結合のエポキシ化、さらにテルペン部位の環化を経てpyripyropene類に共通の基本骨格 (7) が構築される (図1)5)。そこで、この生合成経路に基づきpyripyropene Aの生合成遺伝子の探索を行った。
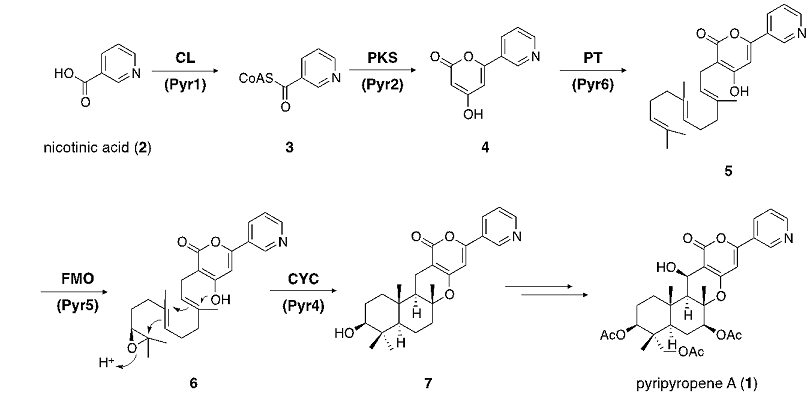
図1 Pyripyropene Aの生合成経路
一般に、微生物においては、ある化合物の生合成遺伝子群は染色体上にクラスターをなして存在している。先述の生合成経路を踏まえると、pyripyropene Aの生合成には、ポリケタイド合成酵素 (PKS) およびプレニル基転移酵素 (PT) が関与していると予想されるため、これらをコードする遺伝子が近傍に存在する領域をA. fumigatusのゲノムデータベース中に求めることとした。その結果、PKS、PTの他に、CoAリガーゼ (CL)、フラビン依存型モノオキシゲナーゼ (FMO)、シトクロムP450およびアセチル基転移酵素遺伝子を含む9遺伝子からなるクラスターが見出された6)。意外なことに、テルペン環化酵素 (CYC) をコードすると考えられる遺伝子はクラスター中には存在していなかったが、本クラスターのpyripyropeneA生合成への関与を予想し、遺伝子の機能解析を行うこととした。
生合成遺伝子の機能解析に際しては、異種糸状菌Aspergillus oryzaeを発現ホストとし用い、予想生合成経路に沿って、順次生合成酵素の発現系を構築した。まず、CL遺伝子pyr1およびPKS遺伝子pyr2をA. oryzaeに導入し、ニコチン酸存在下誘導培養を行ったところ、予想されたピロン体4が生成した。次いで、両遺伝子に加えてPT遺伝子pyr6を共発現させたところ、ファルネシル基が結合した5の生成が確認された。さらに、エポキシ化を担うと考えられたFMO遺伝子pyr5の機能解析を行ったところ、予想されたエポキシ体6の生成は確認できなかったものの、エポキシドが加水分解を受けたと考えられるジオール体が生成していた。これは、6がホスト由来の加水分解酵素により、容易に加水分解されることに起因すると考えられる。
ここまでで、4つの酵素により予想された生合成経路の再構築に成功したが、本生合成遺伝子クラスター中には、テルペン環化酵素をコードすると予想される遺伝子は存在していない。先述のとおり、クラスター中にはシトクロムP450やアセチル基転移酵素遺伝子も存在するが、これらは閉環反応後の修飾反応に関与すると予想されることから、環化反応を担う可能性は低いと考えられた。そこで、クラスター中の遺伝子で、唯一機能既知の遺伝子と相同性を有さないpyr4に着目した。Pyr4の発現系を構築し、機能解析を行ったところ、環化産物7の生成を確認することができた。このように、メロテルペノイド生合成に関与する新規テルペン環化酵素を同定するとともに、pyripyropene類に共通の基本骨格7の生合成を異種糸状菌A. oryzaeにて再構築することに成功した。Pyr4は、integral membrane proteinとアノテーションされており、既知のテルペン環化酵素とは配列相同性を示さないものの、興味深いことに、paxillineや後述するterretoninなど、他のメロテルペノイド生合成遺伝子クラスター中にもPyr4のホモログをコードする遺伝子が存在している7)。このことから、Pyr4ホモログは、メロテルペノイド生合成におけるテルペン環化酵素として、広く分布していることが示唆される。
続いて、これら一連の生合成遺伝子群を利用した新規物質生産を検討すべく、本来の開始基質であるニコチン酸に代えて安息香酸 (8) を投与したところ、一連の生合成酵素が作用し、pyripyropene類のピリジン環がベンゼン環に置換した新規類縁体9が生成した (図2)。本化合物は、選択的アセチルコリンエステラーゼ阻害活性を有するarisugacin類やterritrem類の基本骨格に相当する8)。このように、一連の生合成酵素群がピリジン環をベンゼン環に置換した中間体を受け入れることが判明したことから、さらに異なる基質を作用させることによる、新たな化合物の創出も期待される。
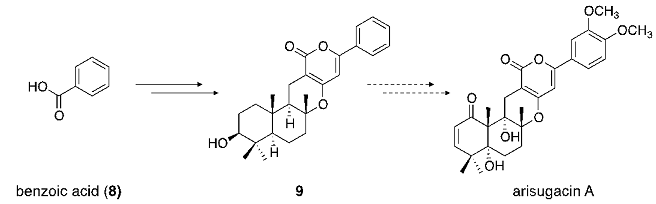
図2 Pyripyropene A生合成酵素群による新規類縁体の創出
3.Terretoninの生合成研究-環化反応におけるメチル基の重要性
続いて、筆者らはA. terreusの産生するメロテルペノイドterretonin (10)9) に着目した。本化合物もpyripyropene Aと同様の生合成経路にて生合成されると考えられている。すなわち、PKSにより3,5-dimethylorsellinic acid (DMOA, 11) が合成されたのち、PTによるファルネシル基の付加、FMOによる末端二重結合のエポキシ化、CYCによる閉環反応を経て環化体14が生成、さらに、酸化反応等の修飾反応を受けてterretoninが生合成される (図3)10)。本生合成経路における環化前駆体 (13) は、terretoninのみならず、異なる閉環様式を経て、austinol (15)、andrastin A (16)、anditomin (17) など他のメロテルペノイドの生合成にも関与していることが予想されており11-13)、terretoninの生合成研究はこれら他のメロテルペノイドの生合成研究にも大きく寄与することが期待される (図4)。
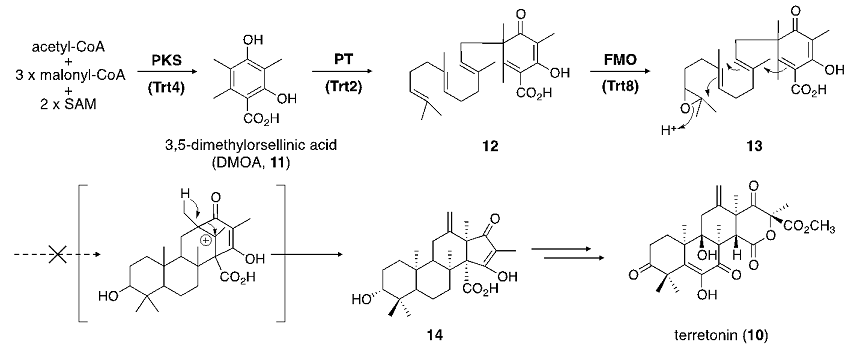
図3 Terretoninの予想生合成経路
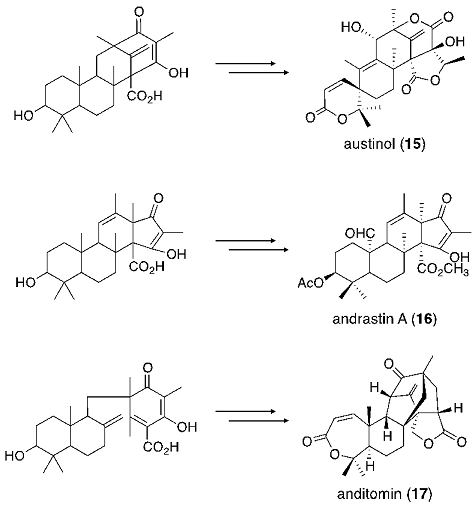
図4 DMOAに由来するメロテルペノイドとその予想生合成前駆体
先述の生合成経路に基づき、A. terreusのゲノムデータベース中にterretoninの生合成遺伝子クラスターを探索したところ、PKS、PT、FMO、CYC遺伝子を含むクラスターが見出された14)。そこで、やはりA. oryzaeをホストとした異種発現系を構築し、各生合成遺伝子の機能解析を行うこととした。まず、PKS遺伝子trt4をA. oryzaeに導入し、誘導培養を行ったところ、予想通り11が生成した。次いで、PT遺伝子trt2を共発現させたところ、ファルネシル基が結合した12が生成し、加えて、エポキシ化を担うと考えられたFMO遺伝子trt8を共発現させたところ、エポキシ体13および、エポキシドが加水分解を受けたと考えられるジオール体が生成した。しかしながら、環化産物14を得るべく、CYC遺伝子trt1を加えた4遺伝子発現系を構築したところ、予想に反して、環化産物の生成を確認することはできなかった15)。すなわち、Trt1は推定生合成中間体13を環化する酵素ではないことが示唆された。
このように、4遺伝子発現系からは環化産物を得ることはできなかったが、クラスター中には、環化酵素をコードすると考えられる遺伝子がtrt1以外に存在しなかったことから、やはりTrt1がterretonin生合成に関与する環化酵素であると予想し、Trt1による環化反応以前に未知の反応が要求される可能性を考えた。ここで、terretoninと同様にDMOAに由来するandrastin Aなど他のメロテルペノイドの構造に着目すると、DMOAに由来するカルボキシル基がメチル化を受けた化合物が多数存在する一方で、調べた限りにおいて、この部位が遊離カルボン酸として存在する化合物は見出されなかった。これより、このカルボキシル基のメチル化がDMOAに由来するメロテルペノイド生合成における共通の反応であり、また、メチル化反応は構造多様性が生まれる環化反応以前に起こるのではないかと予想した。Terretonin生合成遺伝子クラスター中にはメチル基転移酵素 (MT) をコードするtrt5という遺伝子が存在していたことから、Trt5がカルボキシル基のメチル化に関与すると推定し、Trt5の機能解析に着手した。
Trt5、PKSの共発現系、および、Trt5、PKS、PTの共発現系を構築し、生成物を分析したところ、前者からはメチル化を受けた化合物を検出することはできなかったが、後者において、12のメチルエステル18が生成していた。これより、Trt5は12を基質とするMTであると判明するとともに、18がFMOおよびTrt1によって環化体21へと変換されることが期待された。そこで、上述の計5遺伝子発現系を構築したところ、高収率で環化産物20を得ることができた。以上のことから、Trt1は当初予想されていた13ではなく、そのメチルエステル体19を基質とすることが明らかとなった (図5A)。
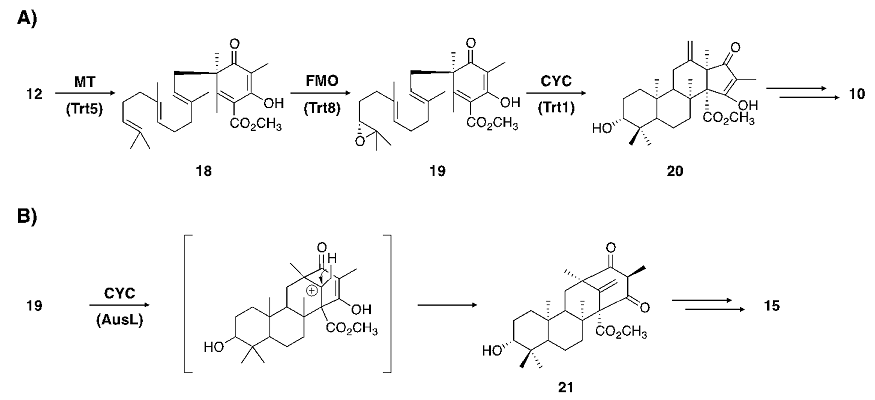
図5 A) 今回判明したterretoninの生合成経路 B) 環化酵素の入れ替えによる異種閉環産物の生成
さて、前述の通り、terretonin生合成における環化前駆体は、種々のメロテルペノイド生合成への関与が予想されている。そこで、Trt1とは異なる活性を有する環化酵素を発現させることによる、新たな環化体の取得を検討することとした。Aspergillus nidulansの産生するaustinolはterretoninと同じくDMOAに由来するメロテルペノイドであり、最近その生合成遺伝子群が遺伝子破壊実験を通じて同定された16)。それら遺伝子群のうち、ausLと命名された遺伝子がテルペン環化酵素をコードしていると予想されたことから、ausLの機能解析を行うこととした。Trt1に代えてAusLを発現する5遺伝子発現系を構築し、その生成物を分析したところ、Trt1とは異なる閉環様式を経た環化産物21の存在が確認された (図5B)。AusLもTrt1と同様に、メチル化を受けていない13を基質として受け入れなかったことから、カルボキシル基のメチル化はDMOAに由来するメロテルペノイド生合成において一般的に要求される反応であることが示唆される。さらに異なる閉環産物を得るべく、現在、新たな環化酵素遺伝子の探索ならびにその機能解析を進めている。
4.おわりに
以上のように、筆者らは2つのメロテルペノイドの生合成研究を通じて、新規膜結合型テルペン環化酵素を発見し、terretoninやaustinolの生合成においては、カルボキシル基のメチル化が環化酵素による閉環反応に必須であることを見出した。最近では、paxillineの生合成に関与するPaxB17)や放線菌の産生するxiamycin Aの生合成に関与するXiaE18)など、類似の環化酵素の報告例も増えてきており、本環化酵素群の詳細な構造機能解析が待たれる。これまでに、Pyr4に対する変異導入実験を通じて、ホモログ間で高度に保存された二つの酸性アミノ酸残基が触媒活性に重要な役割を果たしていることを見出しているが6)、Trt1とAusLがどのようにして生成物を作り分けているかなど、今後解明すべき点は山積している。
また、本稿では、生合成における環化反応までを取り上げたが、terretoninやaustinolの生合成においては、環化反応後にさらに大きな構造変換を受けており、環化後の修飾反応のメカニズムにも大変興味がもたれる。これら修飾反応については部分的に明らかにされているものの16,19)、未解明の部分も少なくなく、今後は、それらを解明するとともに、ユニークな生合成反応を触媒する酵素の研究や、新たな有用化合物の創成につなげていきたい。
文献
1) Geris, R., Simpson, T.: Nat. Prod. Rep., 26, 1063 (2009).
2) Tomoda, H., Nishida, H., Kim, Y. K., Obata, R., Sunazuka, T., Omura, S., Bordner, J., Guadliana, M. ,Dormer, P. G., Smith, A. B.: J. Am. Chem. Soc., 116,12097 (1994).
3) Obata, R., Sunazuka, T., Tomoda, H., Harigaya,Y., Omura, S.: Bioorg. Med. Chem. Lett., 5, 2683 (1995).
4) Ohshiro, T., Matsuda, D., Sakai, K., Degirolamo, C., Yagyu, H., Rudel, L., Omura, S., Ishibashi, S.,Tomoda, H.: Arterioscler. Thromb. Vasc. Biol., 31,1108 (2011).
5) Tomoda, H., Tabata, N., Nakata, Y., Nishida, H.,Kaneko, T., Obata, R., Sunazuka, T., Omura, S.: J.Org. Chem., 61, 882 (1996).
6) Itoh, T., Tokunaga, K., Matsuda, Y., Fujii, I., Abe, I.,Ebizuka, Y., Kushiro, T.: Nat. Chem., 2, 858 (2010).
7) Saikia, S., Nicholson, M., Young, C., Parker, E., Scott, B.: Mycol. Res., 112, 184 (2008).
8) Kuno, F., Otoguro, K., Shiomi, K., Iwai, Y., Omura, S.:J. Antibiot., 49, 742 (1996).
9) James, P. S., Joe, W. D., Richard, J. C., Richard, H. C.: J. Org. Chem., 44, 4852 (1979).
10) McIntyre, C. R., Simpson, T. J.: J. Chem. Soc.,Chem. Commun., 20, 1043 (1981).
11) Simpson, T. J., Stenzel, D. J., Bartlett, A. J., O'Brien, E., Holker, J. S. E.: J. Chem. Soc., Perkin Trans. 1,11, 2687 (1982).
12) Uchida, R., Shiomi, K., Inokoshi, J., Sunazuka, T.,Tanaka, H., Iwai, Y., Takayanagi, H., Omura, S.: J.Antibiot., 49, 418 (1996).
13) Simpson, T. J.: Tetrahedron Lett., 22, 3785 (1981).
14) Itoh, T., Tokunaga, K., Radhakrishnan, E., Fujii, I., Abe, I., Ebizuka, Y., Kushiro, T.: ChemBioChem, 13,1132 (2012).
15) Matsuda, Y., Awakawa, T., Itoh, T., Wakimoto, T., Kushiro, T., Fujii, I., Ebizuka, Y., Abe, I.: ChemBioChem, 13, 1738 (2012).
16) Lo, H.-C., Entwistle, R., Guo, C.-J., Ahuja, M., Szewczyk, E., Hung, J.-H., Chiang, Y.-M., Oakley, B., Wang, C. C.: J. Am. Chem. Soc., 134, 4709 (2012).
17) Tagami, K., Liu, C., Minami, A., Noike, M., Isaka, T., Fueki, S., Shichijo, Y., Toshima, H., Gomi, K., Dairi, T., Oikawa, H.: J. Am. Chem. Soc., 135, 1260 (2013).
18) Xu, Z., Baunach, M., Ding, L., Hertweck, C.: Angew.Chem. Int. Ed., 51, 10293 (2012).
19) Guo, C.-J., Knox, B., Chiang, Y.-M., Lo, H.-C., Sanchez, J., Lee, K.-H., Oakley, B., Bruno, K., Wang, C. C.: Org. Lett., 14, 5684 (2012).