�y�g�s�b�N�X�z
�������Ȏ����Ǔ��Ɖu�@�̊J��
��_�M�V�A�����P�s
�R�X�~�b�N�R�[�|���[�V�����A����@�E�H
�P�D�͂��߂�
�R�͓̂���̍R������ٓI�ɔF�����镪�q�Ƃ��āAELISA�@�ɂ��R���̒�ʂ�A�Ɖu���F�@�ɂ��R���̌��o���A�����p�E�Տ������p����Ƃ��čL�����p����Ă���B�ߔN�ł́A�����������p�@�ɉ����A�R�̂����i�Ƃ��Đ��̓��ɓ��^����R�̈��Ƃ��Ă̗��p���@�����ɒ��ڂ���Ă���B�R�̂����i�Ƃ��ė��p����ׂɂ́A�s���������ɂ�镛��p��������邽�߂ɁA�����x�ɐ�������K�v������B�܂��A���i�Ƃ��āA����I�ɑ�ʐ��Y����K�v�����邽�߁A���m�N���[�i���R�̂����p����Ă���B�]�����m�N���[�i���R�̂́A�R�����e�퓮���ɖƉu���A���̂���R�̎Y���זE���E�������A�ړI�ɉ�������@�őI�ʂ��Ď擾����B���݂ł́A���炩���ߍ\�z�����R�̃��C�u�����[����X�N���[�j���O���Ď擾�����@�����p����Ă���1,2)�B
�Ɖu����R���Ƃ��ẮA�R���^���p�N��������זE�A�R���^���p�N����A�ᕪ�q�ʃy�v�`�h�E�����������������L�����A�[�^���p�N���A�R���^���p�N�����R�[�h����cDNA3)���A�e��R�������p�\�ł���B�R���̖Ɖu���@�Ƃ��ẮA���̂ւ̒��ږƉu�ȊO�ɁA�̊O�Ɖu�@4)����Ă���Ă���B�̊O�Ɖu�@�̓����́A
�E�R���ʂ����Ȃ��čς�
�E���Ԃ��Ԃ�������Ȃ�
�E�Ɖu�����ɑ��ēŐ��̂��镨���ł��Ɖu�ł���\��������
�Ƃ����_����������B
�M�҂�̃O���[�v�ł́A�̊O�Ɖu�@�𗘗p�����A�������Ȏ����Ǔ��Ɖu�@���J�����A�j���g���������]�`�[���ɑ��鍂�e�a���R�̂̎擾�ɐ������Ă���5)�B�{�e�ł́A�M�҂�̗p�����̊O�Ɖu�@�̉��Ǔ_�Ƃ��̌��ʁA����ꂽ�R�̂̐��\�ɂ��čŋ߂̒m�����Љ��B
�Q�D�̊O�Ɖu�@�̌����Ɖ���
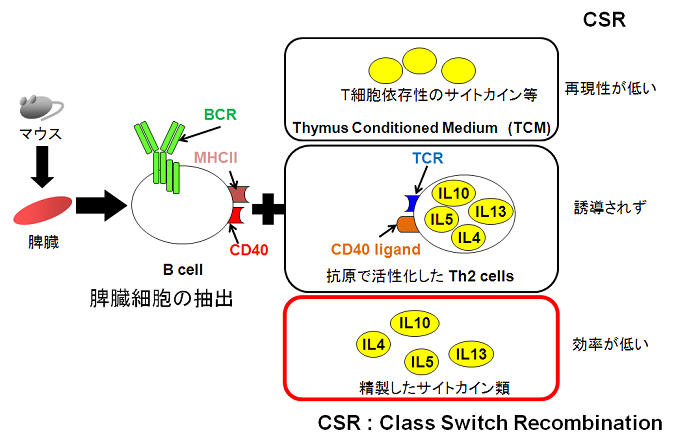
�̊O�Ɖu�@�́A���̓��Ŕ������Ă���Ɖu�����������Ǔ��ōč\�������@�ł���B���̓��ł͍R���ɂ��h�����ꂽB�זE�ɑ��āA�w���p�[T�זE�����ݍ�p���A�R�̂̐e�a�����n�Ȃǂ̖Ɖu�������U�������B���̂��߁A�̊O�Ɖu�@�́A�R�������삵��B�זE�ɑ��āAT�זE���̎h���������āA�����Ǔ��ŖƉu������U�������@�ƌ�����B
����܂ł̌����ł́A�@T�זE�������܂܂�鋹�B�זE��|�{���A���̔|�{�t��B�זE�������������@6)�A�A�R���Ŋ���������T�זE�Ƌ��|�{�����@7)�A�B�T�C�g�J�C����R�̂�Y�����āAB�זE�Ɏh�����������@8)�Ȃǂ���Ă���Ă���B�M�҂�́A�Č����ǂ��������s���A�������g���[�X���₷���B�̕��@���̗p���� (�}1)�B
�}1�@�����̑̊O�Ɖu�@
�M�҂�́A�e�a���̍����R�̂��擾���邽�߂ɁA�R�̂̐e�a�����n��U������K�v���ɒ��ڂ����B���̓��ł̍R�̂̐e�a�����n�Ɋւ��錤���́A�̊O�Ɖu�@����Ă��ꂽ1980�N�O�ォ���ׂĂ����ɐi�W���Ă���A�����͖��炩�ƂȂ��Ă��Ȃ��������ۂ�����������Ă���B�B������T�זE�Ƒ��ݍ�p����B�זE�́A�S (Germinal Center, GC) ���`������BGC�ɂ�����B�זE��6-12���ԂƂ������ɒZ���{�����Ԃő��B���A1��̍זE���ƂɍR�̂̉ϗ̈���R�[�h�����`�q��1�����̕ψق�����Ɛ��肳��Ă���9)�B���̈�`�q�ψق́A�̍זE�ψقƌĂ�AActivation Induced Cytidine Deaminase (AID) ���֗^���Ă��邱�Ƃ����炩�ƂȂ��Ă���10)�B�����̂��Ƃ���A�M�҂�́A�����Ǔ���GC�̌`����U�����A���AAID�̔����ɂ��R�̈�`�q�̑̍זE�ψق�U�����邱�Ƃɂ���āA�R�̂̐e�a����ω���������̊O�Ɖu���@�ƂȂ�ƍl�����B
����܂ł̑̊O�Ɖu�@�ł́AB�זE��T�זE�̑��ݍ�p�ɂ����ďd�v�ȓ���������CD40���q11)��AB�זE���|���N���[�i���Ɋ�����������q�Ƃ���Lipopolysaccharide (LPS) ���L���p�����Ă���12)�B�M�҂�͂����̈��q�ɉ����āAAID�̔�����U������IL-4�AIL-5�Aanti-CD38�R��13)�������āA�������Ȏ����Ǔ��Ɖu���@���m������Ɏ������B
�M�҂�̎��{�����̊O�Ɖu�@�̂̊T�v���}2�Ɏ����B4-6�T��̎���BALB/c�}�E�X�����B���זE���擾���A1x107cells/mL��RPMI�|�n��p���Ē������A�̊O�Ɖu�Ɏg�p�����B���̍זE1 mL��1 nmol�̃j���g���������]�`�[�� (Hen Egg Lysozyme, HEL) ��Y�����A������15���Ԋ��삳�����B�����Ɏh�������Ƃ���IL-4�AIL-5 (�e50 ng/mL)�Aanti-CD40�R�́Aanti-CD38�R�� (�e5��g/mL)�ALPS (200��g/mL) ��Y�����A40%FBS���܂�RPMI�|�n��5�{��߂��A�����Ԕ|�{���A�̊O�Ɖu���ꂽ�זE���擾�����B
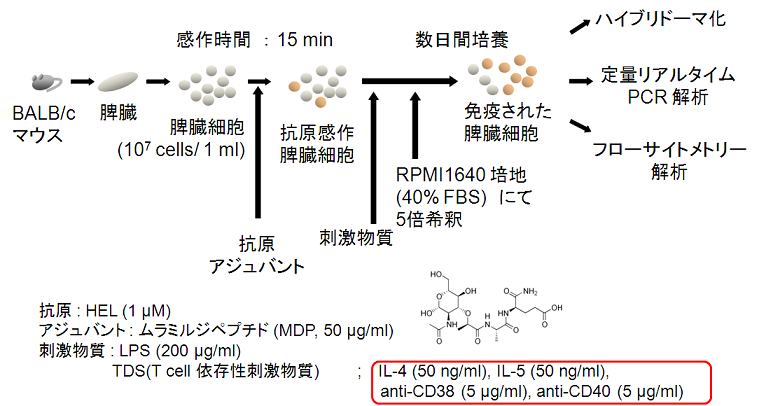
�}2�@�̊O�Ɖu�@�̎����T�v
�R�DAID�̔����U��
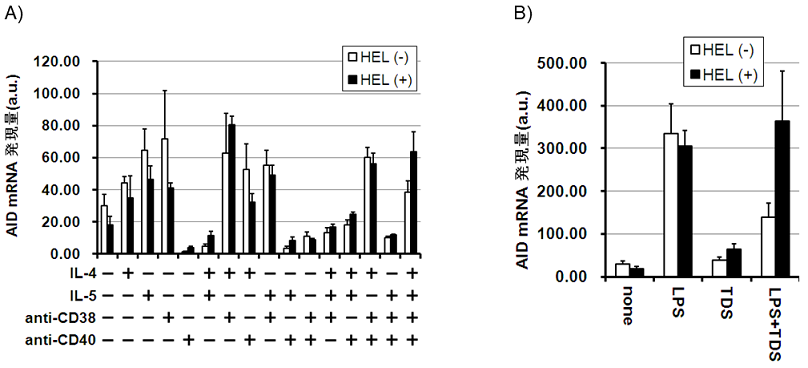
�O�q�̃T�C�g�J�C���ނނ���ƁAT�זE���̎h�����q�Ƃ��āAIL-4�AIL-5�Aanti-CD38�R�́Aanti-CD40�R�̂�4��AT�זE��ˑ����̎h�������Ƃ���LPS����������B�܂��́AT�זE���̎h�����q�̌��ʂׂ�ׂɁA�e�T�C�g�J�C���̑g�ݍ��킹�h���ɂ��AID �̔����ʂ�Real-Time PCR�@�Œ�ʂ��� (�}3)�B�R���h���A�T�C�g�J�C���ނɂ��h�������ɉ����Ȃ������ꍇ�ɔ�ׂāA�l�X�Ȏh��������AID�̔������U������Ă����B�������A�R���h���ɂ��D�ʂȔ����ʏ㏸���F�߂��Ă���A�����h�����������ʂ��㏸���Ă����T�C�g�J�C���ނ̑g�ݍ��킹�́AIL-4�AIL-5�Aanti-CD38�R�́Aanti-CD40�R�̂̑g�ݍ��킹�ł������B���̎h���ɂ����AID�̔����ʂ́A�̊O�Ɖu�O��64�{ (�R����Y�����Ȃ������ꍇ��1.7�{) �ɏ㏸���� (���̑g�ݍ��킹���ȉ�T cell Dependent Stimuli (TDS) �Ɨ���)�B
![]()
�܂��ALPS�Ŏh�����邱�ƂŁA�̊O�Ɖu�O��300�{����AID�����U�����ώ@���ꂽ���ALPS�P�Ǝh���̏ꍇ�͍R���h���̗L���ŗD�ʂȍ��ق͔F�߂��Ȃ������B�������ALPS��TDS�ŋ��h�������ꍇ�ɂ́A�R���h���̗L���Ŕ����ʂɗD�ʂȍ��ق��F�߂��A�R���h���ɂ�荂��AID�����ʂ��U�����ꂽ�B
�S�DGC�̌`���U��
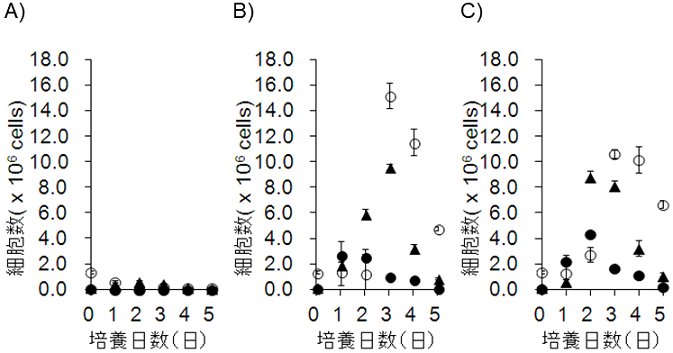
���ɁALPS��TDS�̋��h����GC�̌`�����U������Ă��邩���AFlowcytometry�ɂ�茟�������B�}�E�X��GC B�זE�́A�\�ʍR���Ƃ���CD38�̔����ʂ��������邱��14)��AB�זE�̃}�[�J�[�ł���CD45R�̔������F�߂��邱�Ƃ�����Ă���15)�A�����̕\�ʍR���̔����ʂ��w�W�Ƃ��āAGC B�זE�l��phenotype������GC-like B cell�AGC-like B cell�ɕ����r���ƍl������Pre GC-like B cell�A����ɁAGC B�זE����PlasmaBlast (PB) �ɕ����r���ƍl������Pre-PB like B cell�̍זE���ׂ� (�}4)�B���̌��ʁA�R���h���̂Ȃ��ꍇ�ɔ�ׂđ�����GC-Like B cell�����o����ALPS��TDS�̋��h���ɂ���Ď����Ǔ���GC�̌`�����U������邱�Ƃ��������ꂽ�B

�T�D�̍זE�ψق̗U��
�O�q�̒ʂ�AGC�̌`���ƁAAID�̔������U���ł���̊O�Ɖu�@���m�������B���̎�@��p���邱�ƂŁA�̍זE�ψق��R�̈�`�q�ɒ~�ς���邱�Ƃ��\�z���ꂽ�̂ŁA�R�̈�`�q�ւ̕ψق̒~�ς��ȉ��̕��@�Ŋm�F�����B�̊O�Ɖu��̍זE����R�̈�`�q��PCR�@�Œ��o���A��{���R�� (scFv) �̃��C�u�������\�z�����B�R�����ő�������ELISA plate��p���āA�e�a���̂���N���[����I�������B����ꂽ�N���[���̖�30���ōR���ɑ��Đe�a���̂���N���[���ł������B�e�a���̂������N���[���̂����AELISA�@�ł̑���l�̍����N���[�����I�����A���̈�`�q�z������肵���B����ꂽ��`�q�z����A���J����Ă���R�̈�`�q�Ɣ�r���A�_�ψق̌��E�p�x���m�F���� (�\1)�B
�\1�@�̊O�Ɖu�ɂ���`�q�ψق̓�����
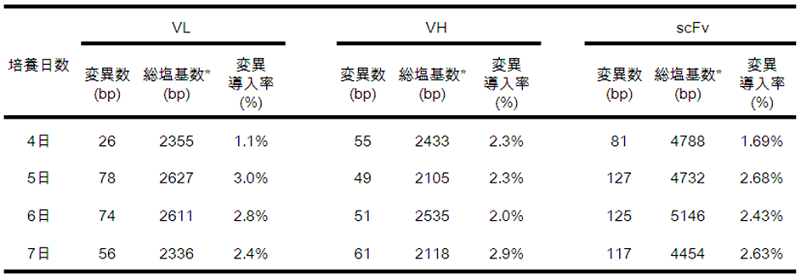
�̊O�Ɖu��̔|�{����4���ځ`7���ڂ܂ʼn�͂����Ƃ���A5���ڈȍ~��2���ȏ�̕p�x�ŕψق��~�ς���Ă���A���R�ˑR�ψق������p�x�Ɉ�`�q�ψق��~�ς���Ă���16)�B�|�{�������o�邲�Ƃɕψق̌��E�p�x�͏㏸���邱�Ƃ��\�z���ꂽ���A����̌��ʂł́A��2���O��ň��肵�Ă����B���̌��ʂ́A���������N���[�����A�R���ɑ��Đe�a���̂���N���[����p�����ׂł���ƍl����ꂽ�B
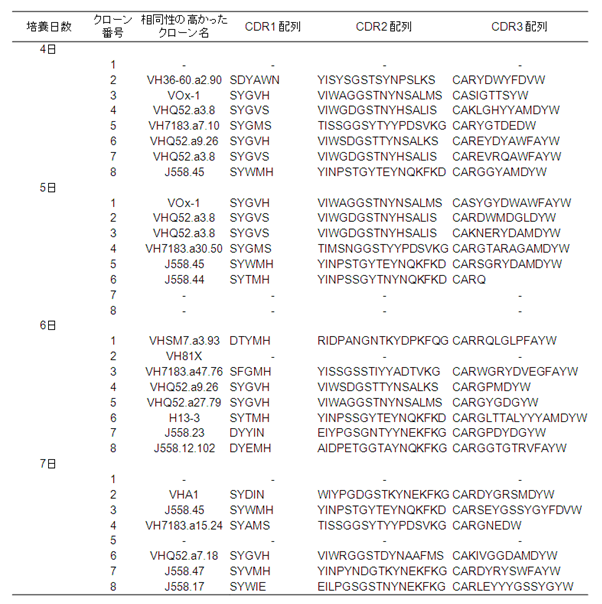
�܂��A�R�̒`�����̒��ϗ̈� (CDR) �̃A�~�m�_�z�����͂���ƁA����ꂽ�N���[�����A���ɑ��l�ȃo���G�[�V������L���Ă��邱�Ƃ������ꂽ (�\2)�B
�\2�@����ꂽ�RHEL�R�̂�VH���ϗ̈� (CDR) �A�~�m�_�z��
�U�D���e�a���R�̂̎擾
����܂ŏq�ׂ��ʂ�A�R�̈�`�q�ɕψق�~�ς��邱�Ƃ��ł���̊O�Ɖu�@���m�������B���̑̊O�Ɖu�@�ɂ���ĖƉu�����}�E�X�B���זE���n�C�u���h�[�}�����A���m�N���[�i���R�̂��擾�����B����ꂽ�N���[���̐e�a����BIACORE�ɂ���đ��肵�����ʁA���e�a���R�� (KD: 0.5 nM, kon: 9.9 x 105M-1s-1, koff: 5.5 x 10-4s-1) �������N���[���邱�Ƃɐ������� (�}5)�B
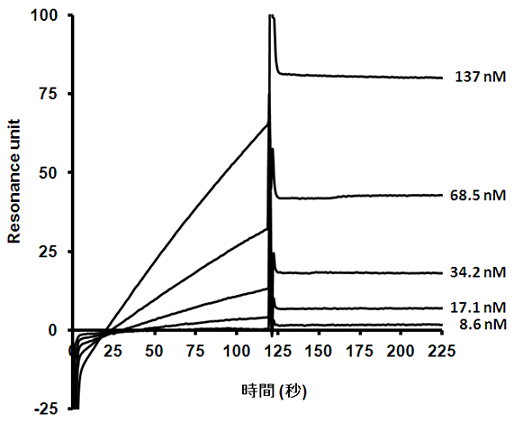
�}5�@BIACORE�ɂ��RHEL�R�̂̐e�a�����
�V�D������
�M�҂�́A����܂łɒ�Ă���Ă����̊O�Ɖu�@�ɁA�ŐV�̖Ɖu�����A���ɍR�̂̐e�a�����n�̏���������A���̊O�ōR�̈�`�q�ɕψق�~�ς��鎖�̏o����Ɖu���@���m�������B���̎����Ǔ��Ɖu���@��p���āA���e�a���R�̂邱�Ƃɂ����������B�܂��A����̌��ʂł́A����ꂽ�N���[���̖�30���Ƃ������ɍ��������ōR���ɑ��Đe�a���̂���N���[���������Ă���A�������Ȏ����Ǔ��Ɖu���@���m������Ɏ������B
���̓��̍R�̂̐e�a�����n�ł́A�̍זE�ψقɂ��N���[���̊g��Ǝ���זE�Ƃ̑��ݍ�p�ɂ�鍂�e�a���R�̂�����זE�̑I��I���B���N�����Ă���B��҂̎���זE��B�זE�̑��ݍ�p�������Ǔ��ōČ����邱�ƂŁA����ɗ��p���l�̍����R�̎擾���@�ƂȂ�ƍl���Ă���B
����
1) Seo, H., Masuoka, M., Murofushi, H., Takeda, S., Shibata, T., Ohta, K.: Nat. Biotechnol., 23, 731 (2005).
2) Knappik, A., Ge, L., Honegger, A., Pack, P., Fischer, M., Wellnhofer, G., Hoess, A., Wolle, J., Pluckthun, A., Virnekas, B.: J. Mol. Biol., 296, 57 (2000).
3) ���ъx�j: �����H�w, 86, 384 (2008).
4) Borrebaeck, C. A., Moller, S. A.: J. Immunol., 136, 3710 (1986).
5) Inagaki, T., Yoshimi, T., Kobayashi, S., Kawahara, M., Nagamune, T.: J. Biosci. Bioeng., 115, 339 (2013).
6) Luben, R. A., Mohler, M. A.: Mol. Immunol., 17, 635 (1980).
7) Uthoff, S., Boldicke, T.: J. Immunol. Methods, 166, 165 (1993).
8) Strike, L. E., Devens, B. H., Lundak, R. L.: J. Immunol., 132, 1798 (1984).
9) Michael, M.-H.: Trends in Immunology, 30, 157 (2009).
10) Martin, A., Bardwell, P. D., Woo, C. J., Fan, M., Shulman, M. J., Scharff, M. D.: Nature, 415, 802 (2002).
11) Parker, D. C.: Annu. Rev. Immunol., 11, 331 (1993).
12) Pasare, C., Medzhitov, R.: Nature, 438, 364 (2005).
13) Horikawa, K., Takatsu, K.: Immunology, 118, 497 (2006).
14) Shinall, S. M., Gonzalez-Fernandez, M., Noelle, R. J., Waldschmidt, T. J.: J. Immunol., 164, 5729 (2000).
15) Richard, R. H., Hayakawa, K.: Annual Review of Immunology, 19, 595 (2001).
16) Messmer, B. T., Albesiano, E., Messmer, D., Chiorazzi, N.: Blood, 103, 3490 (2004).