【トピックス】
医療技術開発と細胞内プロテインキナーゼ
片山佳樹
九大院・工
1.はじめに
生命現象はすべて細胞から生み出される。したがって、細胞機能発現のメカニズムを把握することは、あらゆる生命科学において根源的な問題である。細胞が外部環境に応じて最適の機能を作り出す場合、まず、外部刺激を受容すると、この情報をプロセシングして応答に変換する。この時、細胞内では膨大な種類の酵素反応が互いにネットワークを形成しながらカスケード的に引き起こされ、その反応の総体が細胞応答として出力される。この反応ネットワークを細胞内情報伝達系という。したがって、この反応システムこそが、あらゆる生命現象を生み出す本体である。ここには、ありとあらゆる酵素反応が含まれるが、それらの中でも情報処理と伝達に中核的な役割を演じるのが、プロテインキナーゼと呼ばれる一群のタンパク質リン酸化酵素である。従って近年、プロテインキナーゼは薬物標的や診断マーカーとして注目されており、今後の医療技術開発にとって極めて重要な対象となっている。ここでは、我々が現在開発を進めているプロテインキナーゼを計測する技術、あるいは利用する技術をご紹介しながら、プロテインキナーゼの医療技術への重要性を論じたい。
2.細胞機能とプロテインキナーゼ
プロテインキナーゼは、転移酵素に属する酵素群であり、ATPのγ位のリン酸を、タンパク質中のセリン/スレオニン残基、またはチロシン残基に転移する酵素である。前者をセリン/スレオニンキナーゼ、後者をチロシンキナーゼという。いずれも、活性中心を含むキナーゼドメインは、ある程度保存された3次構造を有し、さらに基質あるいは他のタンパクなどを認識するドメイン、活性を制御するドメインなどを有する。一般に、チロシンキナーゼ群は、細胞外から情報伝達分子が細胞膜上の受容体に結合すると、これを最初に識別しながら、細胞内に情報を入力する部分など、厳密な特異性を要求される部分に用いられることが多い。従って、特定の成長因子などに応答して細胞に情報を入力するチロシンキナーゼなどは、分子標的型制癌剤の標的分子として近年注目されている。これに対し、セリン/スレオニンキナーゼは、このシグナルを増幅しつつ、細胞内で情報をプロセシングするのに使われるものが多い。細胞質内での情報処理は、多方面から入力される細胞外情報を統合、処理して最適値を見つけ出す目的のため、種々の反応カスケードが互いにクロストークせねばならない必要上、基質が単独ではない場合も多く、ダイナミックな活性変化を引き起こすキナーゼが多い。実際の細胞機能を決定する下流にあるキナーゼであり、こちらを制御できれば細胞機能をより詳細に制御できる可能性もある。
プロテインキナーゼは、ゲノム上に500種余りがコードされているといわれ、細胞内タンパク質の3分の一以上が何らかのキナーゼの基質であることからもわかるとおり、細胞にとってリン酸化シグナルは、細胞内情報処理の共通言語であるといっても過言ではない。
3.疾患とキナーゼ、およびその活性計測の意義
上述したようにプロテインキナーゼは、事実上、細胞のあらゆる機能の形成や制御にかかわるので、その活性は厳密に制御されている。逆に、もし活性が異常に亢進すると細胞は正常に情報を処理できなくなる。これが疾患細胞である。実際、がんや炎症など種々の病態では、特定のプロテインキナーゼの異常亢進や高発現がみられる。種々のキナーゼの異常活性化 (病理シグナル) は、その病態の形成と深く関係しているので、特定の病態にかかわるキナーゼの活性を計測することは、薬物探索、疾患の診断に極めて有用である。
4.プロテインキナーゼ活性総体の計測
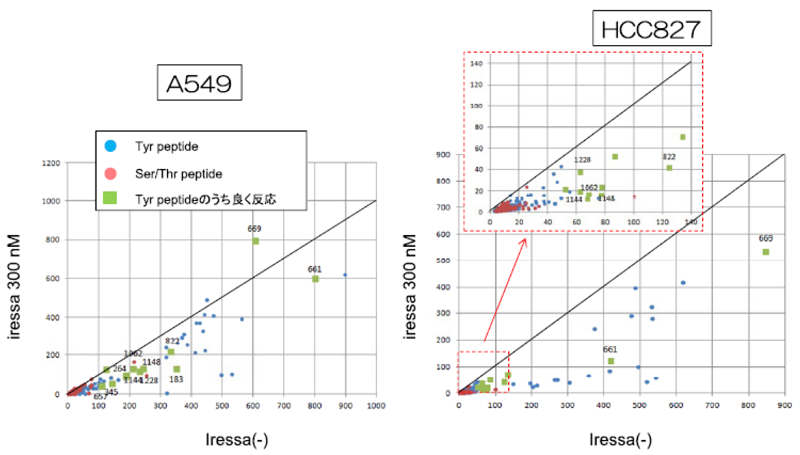
細胞内のプロテインキナーゼの活性を薬物探索の指標とする場合、それが正確な細胞の状態を表現できるものでなければならない。薬物の作用機序が明らかになり、これに特定のキナーゼが密接に関連していれば、1種類のプロテインキナーゼの活性を検出すれば十分であるが、創薬の段階ではスクリーニングする薬物群の作用機序は明らかでない。このような化合物の薬効を正確に評価するには、細胞の状態を詳細に反映する指標として種々の細胞機能形成にかかわる複数のプロテインキナーゼの活性のプロフィールが有効であると考えられている。このような細胞内キナーゼの総体をキノームと呼ぶ。我々は、キノームを解析するにあたって、種々のプロテインキナーゼに対する基質ペプチドを設計し、これを多数固定化したペプチドアレイを開発している。このアレイを細胞の破砕液で処理すると、細胞内に含まれる種々のキナーゼの活性により、基板上の各基質ペプチドがリン酸化される1-3)。これをリン酸基に選択的に結合するPhosTagという亜鉛錯体を結合し、さらにPhosTag分子内に存在するビオチンを利用して、蛍光標識ストレプトアビジンを結合させて各基質のリン酸化率を計測する (図1)4)。これにより、細胞内のキナーゼ総体の活性プロフィールを表すリン酸化パターンが得られる。例えば、図2は、制癌剤であるイレッサに感受性のがん細胞と抵抗性のがん細胞における各基質のリン酸化率を、イレッサなしの場合と、300 nMで処理した場合の比較である。感受性細胞では、イレッサ処理により多くの基質のリン酸化率が大きく低下するのに対し、抵抗性細胞ではその低下が弱いことがわかる。詳細な検討から、抵抗性細胞ではSrc (チロシンキナーゼの一種) の活性が高いことが抵抗性の発現にかかわっていることが明らかとなった。このように、ペプチドアレイ法は、薬物の作用機序の解明に非常に有効である。
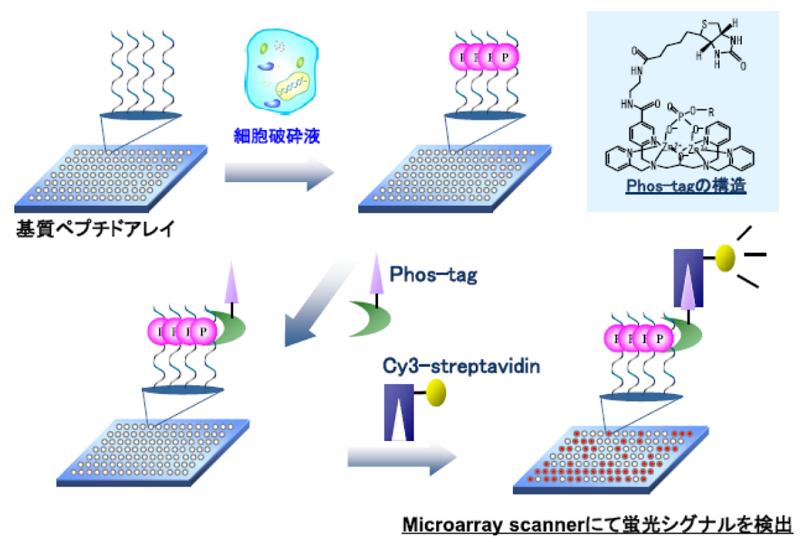
図1 ペプチドマイクロアレイによる細胞内キノーム検出プロトコール

5.特定キナーゼ活性の簡便迅速なアッセイ法
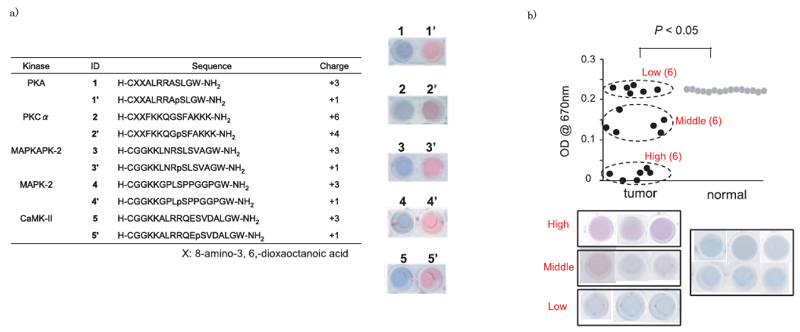
上述の手法は、作用機序が未解明の薬物の効果の判定に非常に有効な手法である。一方、ある薬物や病態に特定のキナーゼの活性が密接にかかわっていることが明らかな場合、さらに簡便で迅速な方法が有効である。我々は、迅速に特定のキナーゼ活性を評価するために金ナノ粒子を用いた比色法アッセイを開発している。本手法では、表面が負に帯電した金ナノ粒子と、標的キナーゼに特異的で正荷電を有するペプチド基質を用いる。両者を塩溶液中で混合すると、非常に鋭敏に金ナノ粒子の凝集を誘起して分散液は赤から青色に変化する。一方、もしペプチド基質が標的キナーゼでリン酸化されると、ペプチドの正荷電が減弱して、金粒子の凝集活性が著しく弱まるため、液は赤色を呈する (図3a)5,6)。従って、ペプチドをあらかじめキナーゼの溶液、あるいは細胞破砕液で処理してから金ナノ粒子を混合して呈色をみることで、標的キナーゼ活性を迅速に評価できる。ペプチドのリン酸化に依存した金ナノ粒子の凝集条件は、塩濃度により容易に設定できる。本手法の利点は、基質ペプチドのリン酸化条件と、金ナノ粒子分散液への添加は別過程であるので、キナーゼごとの条件最適化が非常に容易であることにある。実際、薬物ライブラリを用いて、種々の薬物をキナーゼ溶液に添加してから上記のアッセイを行うことで、迅速に特定キナーゼの阻害剤をスクリーニング可能であった。また、がんの悪性度に密接に関係するPKCα (Cキナーゼのαサブファミリー) の活性測定に適用したところ、がんと正常細胞の判定が可能であった。手術で摘出した乳がん組織では、正常組織はすべて青色を呈し、がん部は、活性が極めて高い群、中間の活性を有する群、比較的活性の低い群の3つのグループに分類でき、これが悪性度の分類に適用できる可能性が示された (図3b)7)。

6.プロテインキナーゼ活性を利用する分子システム
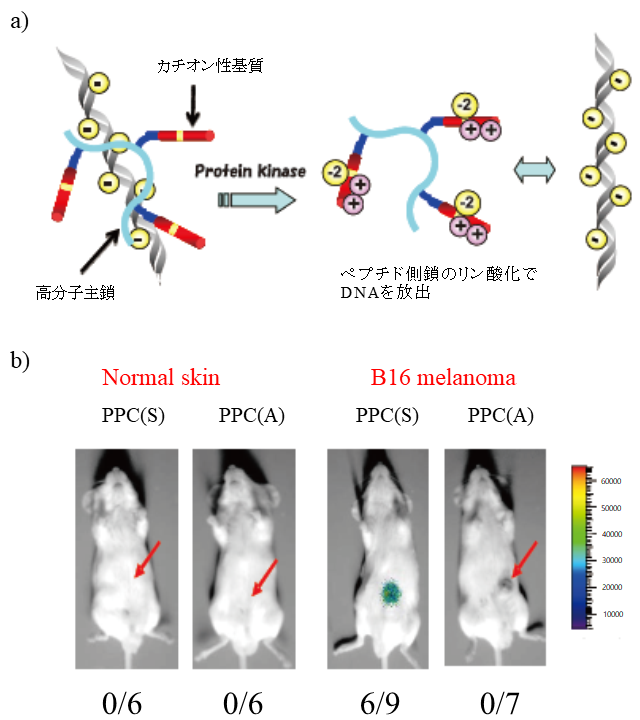
プロテインキナーゼの活性評価は、診断、創薬技術に非常に有効であるが、一方、もし疾患病態にかかわる異常活性化したキナーゼを薬物放出のトリガーに用いることができれば、疾患細胞でのみ薬物を働かせることができる。病理的シグナルを形成するキナーゼはもっとも直接的に細胞機能の異常にかかわっているので、通常の細胞表面のマーカーを用いるよりもはるかに高い特異性で疾患細胞のみを識別可能となる。このような例として、我々は、標的キナーゼに特異的で、正荷電を有する基質ペプチドを複数担持した高分子を開発している8-10)。この高分子は、静電相互作用によって遺伝子医薬と複合体を形成して、その活性を抑制できる。一方、複合体が標的疾患細胞に取り込まれた場合には、異常活性化した標的キナーゼが側鎖の基質ペプチドをリン酸化することで静電相互作用が減弱して複合体が崩壊し、遺伝子医薬を疾患細胞でのみ放出できる (図4a)。図4bは、前述したPKCαに応答する基質を担持した高分子を用いてルシフェラーゼ遺伝子を、マウスに局注した結果である11,12)。PKCα活性が高いがん組織に投与した場合でのみルシフェラーゼの発現がみられる。すでに、がんのほか、炎症部位、Rhoキナーゼ活性化細胞などでのみ働くシステムや、キナーゼの代わりにプロテアーゼに応答するシステムを用いてウイルス感染細胞でのみ働く系なども開発できている。この概念では、正常細胞では強く遺伝子医薬を抑制できるため、通常の細胞表面のマーカー分子を用いる場合に比べ、副作用が大きく抑制できる可能性がある。また、PKCαは、がんの悪性度に相関するので、このシステムでは、悪性のがん細胞ほど効果が現れると期待できる。一般に、がんの化学療法では、脆弱な細胞ほど効果が現れ、悪性度の高い細胞は残存する傾向があるのとは対照的である。

7.おわりに
以上、細胞におけるプロテインキナーゼの重要性と、それを利用した医療技術開発について、我々の研究を紹介した。細胞内シグナル伝達は、これまで基礎細胞生物学の研究対象であったが、今後、これを如何に医療に応用していけるかは、これを扱う新しい工学研究の創製にかかっている。多くの研究者が、プロテインキナーゼ関連の工学技術開発に関与されることを期待している。
文献
1) Han, X., Sonoda, T., Mori, T., Yamanouchi, G., Yamaji, T., Shigaki, S., Niidome, T., Katayama, Y.: Comb. Chem. High Throughput Screen., 13, 777 (2010).
2) Han, X., Yamanouchi, G., Mori, T., Kang, J-H., Niidome, T., Katayama, Y.: J. Biomol. Screen., 14, 256 (2009).
3) Han, X., Shigaki, S., Yamaji, T., Yamanouchi, G., Mori, T., Niidome, T., Katayama, Y.: Anal. Biochem., 372, 106 (2008).
4) Kinoshita, E., Kinoshita-Kikuta, E., Koike, T.: Proteomics, 12, 192 (2012).
5) Oishi, J., Asami, Y., Mori, T., Kang, J-H., Niidome, T., Katayama, Y.: Biomacromolecules, 9, 2301 (2008).
6) Oishi, J., Han, X., Kang, J-H., Asami, Y., Mori, T., Niidome, T., Katayama, Y.: Anal. Biochem., 373, 161 (2008).
7) Kang, J-H., Asami, Y., Murata, M., Kitazaki, H., Sadanaga, N., Tokunaga, E., Shiotani, S., Okada, S., Maehara, Y., Niidome, T., Hashizume, M., Mori, T., Katayama, Y.: Biosens. Bioelectron., 25, 1869 (2010).
8) Toita, R., Kang, J-H., Tomiyama, T., Kim, C-W., Shiosaki, S., Niidome, T., Mori, T., Katayama, Y.: J. Am. Chem. Soc., 134, 1540 (2012).
9) Tomiyama, T., Toita, R., Kang, J-H., Koga, H., Shiosaki, S., Mori, T., Niidome, T., Katayama, Y.: Nanoscale Res. Lett., 6, 532 (2011).
10) Tsuchiya, A., Kang, J-H., Asai, D., Mori, T., Niidome, T., Katayama, Y.: J. Controlled Release, 155, 40 (2011).
11) Toita, R., Kang, J-H., Kim, J-H., Tomiyama, T., Mori, T., Niidome, T., Jun, B., Katayama, Y.: J. Controlled Release, 139, 133 (2009).
12) Kang, J-H., Asai, D., Kim, J-H., Mori, T., Toita, R., Tomiyama, T., Asami, D., Oishi, J., Sato, Y. T., Niidome, T., Jun, B., Nakashima, H., Katayama, Y.: J. Am. Chem. Soc., 130, 14906 (2008).