【トピックス】
Brevibacillus in vivo cloning 法 (BIC法) を応用したタンパク質高生産株の選抜
花方 寛
ヒゲタ醤油株式会社
1.はじめに
現在、異種タンパク質の生産系として、数多くのタンパク質発現系が用いられている。種々のタンパク質発現系にはそれぞれに特徴があり、構造が複雑な抗体などの生産には動物細胞、最も一般的なタンパク質発現系である大腸菌、これ以外にも酵母、昆虫細胞、無細胞システムなどたくさんの発現系が存在し、目的タンパク質の性質に応じて使い分けられている。
バクテリアの発現系として最も実績の高い大腸菌はタンパク質の高生産に優れているが、細胞内に発現させた際に目的タンパク質が会合し、不溶性の封入体を形成することが多い。封入体は不活性なため、変性可溶化後、リフォールディングにより活性型に変換する必要があるが、この工程は煩雑で、また必ず成功するとは限らない。更に、グラム陰性細菌であるため、エンドトキシンを産生し、その除去工程がタンパク質の収率低下に結びつくこともある。
これらの欠点は本来エンドトキシンを産生しないグラム陽性細菌を用いて、目的タンパク質を菌体外に分泌生産できれば生産性の増大、正しい高次構造のタンパク質の取得、分離精製の単純化が期待される。このような観点から、髙木らはタンパク質の分泌生産能に優れ、プロテアーゼを生産せず、培養や遺伝子組換えが容易な菌株のスクリーニングを行い、Brevibacillus choshinensis HPD31 (Bacillus brevis) を見出した (図1)1)。しかしながら本菌はバチルス属細菌の特性として胞子を形成することが知られており、工業生産に用いる生産菌株としては、クロスコンタミネーションの問題があった。また、高感度のプロテアーゼ活性測定を行った結果、微弱ながらプロテアーゼ活性が残存していることが判明した。そこで、我々は複数の遺伝子を破壊する方法を開発し、胞子関連遺伝子と細胞内外のプロテアーゼ2種類の遺伝子を破壊し、汎用性の高いタンパク質生産宿主菌B. choshinensis HPD31-SP3株を創出した2)。

図1 Brevibacillus choshinensis
Brevibacillus発現システムの主なメリットを以下に示す。
・異種タンパク質を効率的に分泌生産する。
・生産されたタンパク質が培養液中でプロテアーゼによって分解されることが殆どない。
・エンドトキシンを生産しない。
・正しい立体構造を維持した活性型のタンパク質を生産できる。
・培養、滅菌、遺伝子操作が容易である。
・必要なコンポーネントが一括してキットとして販売されているため、誰でも発現試験を自ら行うことが出来る。
以上のような特長を生かし、これまでに300種類以上のタンパク質の分泌生産に成功し、特に分泌タンパク質の高生産を実現させてきた。さらに最近では、非常に簡単な遺伝子のクローニング手法を開発し、これを高発現プラスミド構築に応用している。今回は、分泌シグナルとプロモーターの組合せにより、高生産株を選抜した事例を紹介する。
2.相同組換を利用した簡便なプラスミド構築法 (BIC法) の開発
ブレビバチルス発現システムの最大の特徴は目的タンパク質を高い効率で菌体外に分泌生産することにある。その際、目的遺伝子はプラスミドDNA上の分泌シグナルの下流に挿入されなければならない。この工程は特に目的遺伝子のサイズが大きくなる程、制限酵素やリガーゼを使う従来法では時間と手間を要するステップとなる。現在、ブレビバチルスへの遺伝子導入法として、Tris-PEG法の改良法 (NTP法) を採用しているが、この方法を採用することで図2に示すような、菌体内相同組換による高効率な遺伝子クローン化が可能であることが見出された。BIC法と名付けたこの超簡便プラスミド構築法の特徴は、目的タンパク質をコードする遺伝子の両端に、直鎖状の発現ベクターの両末端と相同な15塩基対の配列を付加したDNAをベクターと混合してコンピテントセルに導入すると、菌体内で相同組換え反応が起こり、発現プラスミドが自発的に形成されるという点にある。BIC法による遺伝子導入効率は80%~100% (インサートの遺伝子サイズ:0.3~3.2kbp) と非常に高いことが確認されている。BIC法の開発により、クローニング実験の手間が簡略化され、制限酵素サイトの選択に悩まされることも無くなった。また、ベクターの末端だけではなく、目的遺伝子プライマーの配列を操作することにより、内部配列にも遺伝子を導入することができる。その結果、一つのベクターで、プライマーの設定場所を変更するだけで、菌体内発現やタグ融合発現など複数の発現法が試験できるようになった。
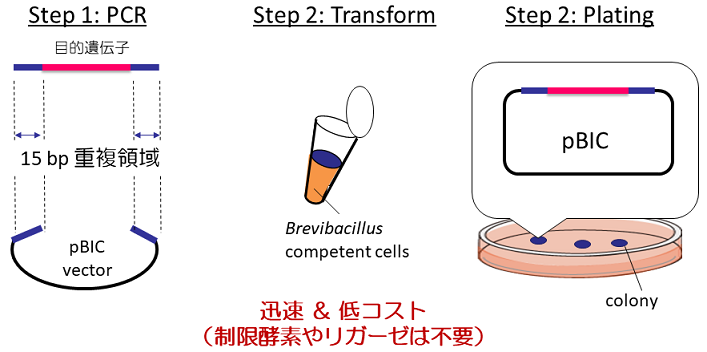
図2 BIC Systemの概要
3.安定生産株取得による細菌由来プロテアーゼBprの高生産
分泌生産効率向上には分泌シグナルの最適化が重要と考えられていたが、従来法では様々な分泌シグナルを試すことが制限酵素サイトの都合上難しかった。BIC法を応用することで、分泌シグナルの下流に遺伝子を導入することが簡単にできるようになった。そこで、細菌由来のプロテアーゼBpr遺伝子を用い、分泌シグナルとプロモーターの組合せによる高生産株の取得を試みた。プロテアーゼはその活性ゆえ、多くの場合大腸菌での生産は難しいが、ブレビバチルスを用いることで効率的生産に成功した事例がある3,4)。この試験において、分泌シグナルとしては既に実績のあるB.brevis由来MWP、R2L6 (MWPを改変) シグナルとB.choshinensis由来BprPI、P22シグナルを用いた。プロモーターにはP5 (pNOベクター)、 P22 (pNF41ベクター)、P2 (pNF21) プロモーターを用い、12通りの組合せで試験を行った (図3)。対照として、従来から知られているpNY326ベクターを用いた。各ベクターにBIC法を用いて遺伝子を導入し、2SY培地を用いて、48時間、30℃で培養を行い、生産量をSDS-PAGEによって比較した。その結果、pNY326を用いた場合、約30 mg/Lであったのに対し、組合せの異なるベクターを試すことで、生産性にバリエーションが認められた。中でもpNF41-R2L6を用いることで約4倍の120 mg/Lの生産量を得ることが出来た (図4)。さらに、3Lジャーを用いた流加培養を行った結果、3 g/Lという高生産に成功した (図5)。pNY326では約1/30の生産量しか得られず (データ省略)、培養途中から非生産菌が大勢を占めてしまっていた。pNF41-R2L6を用いることで、非生産菌の出現は無くなり、安定した生産が維持され、最終的な高生産に繋がった。
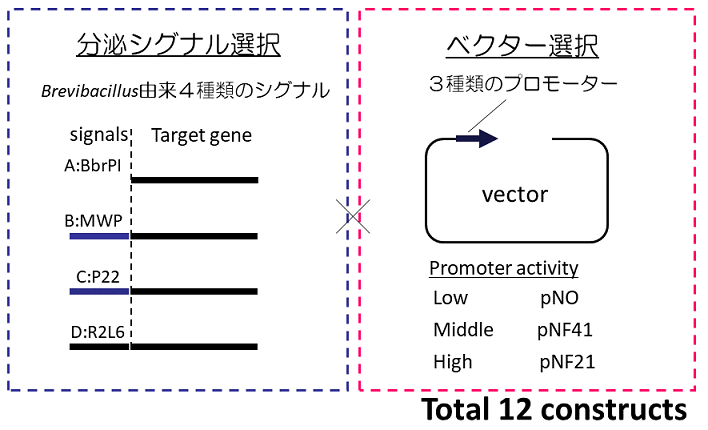
図3 シグナルとプロモーターの組合せ

図4 細菌由来プロテアーゼBprの高生産株の選抜
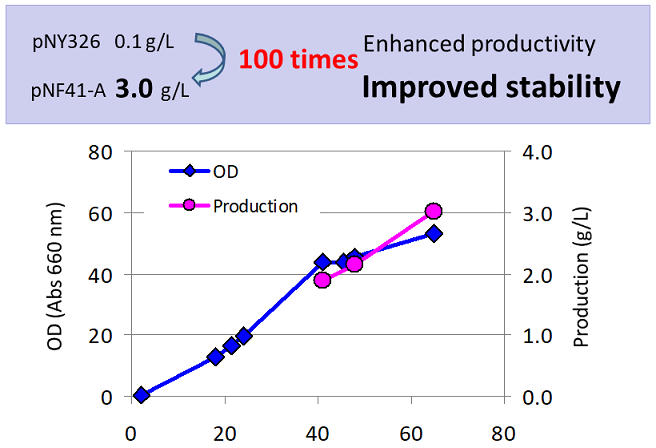
図5 安定高生産の実現
4.活性型のフラグメント抗体 (scFv) 高生産株の効率的取得5)
抗体は標的分子 (抗原) への高い特異性から様々な分野で応用されており、特に抗体医薬品は急速な市場拡大を遂げている。このような抗体は多数の-s-s-結合を含む巨大なタンパク質であるため、細胞内に導入したり、細胞内で機能させたりすることができず、生産にも膨大なコストが必要となる。そこで、抗体の可変領域を用いた低分子化抗体 (フラグメント抗体) の開発が盛んに行われている。中でも可変領域のみを繋いで一本鎖化した抗体 (scFv) は分子量が小さく、バクテリアを宿主とした生産が可能であることから、次世代の抗体医薬として注目されている。しかしながら、大腸菌による菌体内生産ではリフォールディングの工程を必要とし、分泌発現では生産性が低いという問題があった。そこで、分泌発現を特長とするブレビバチルス発現システムを用い、分泌シグナルとプロモーターの組合せの最適化による高生産菌株の選抜を試みた。
蛍光色素フルオレセインに対するscFv抗体FLU6)の遺伝子を用い、生産菌株の構築を行った。分泌シグナルは先述のBprと同様の4種類を用い、プロモーターはP2 (pNF2ベクター) およびP22 (pNF4ベクター) の2種類を用いた。検出と精製のために、N末端にHistagを導入した。BIC法を用いて遺伝子を導入し、得られた株を用いて培養生産を行った。2SY培地を用い、試験管スケールで液量3 ml、48時間、30℃で振とう培養を行った。遠心分離により、培養上清を調製し、SDS-PAGEにより生産量を比較した (図6)。その結果、やはり生産量には発現プラスミドによるバラつきが認められ、その中でpNF2-R2L6を用いた菌株で最も高い生産性が認められた。生産量は約80 mg/Lと比較的高い生産性を示した。今後、培養条件などの最適化により更なる高生産が期待される。次いで、生産されたタンパク質を精製し、結合活性の有無を確認した。Ni-sepharose FF (GEヘルスケア) およびゲルろ過クロマトグラフィーにより単一バンドまで精製し、フルオレセインとの結合性評価を行った。精製したscFvFLUとフルオレセインを混合し、25℃、1時間反応させ、蛍光強度を測定した。scFv無添加をコントロールとし、scFv添加量に対しての蛍光強度の相対値をグラフに示した (図7)。その結果、1:1で混合した際に約95%の発光抑制が認められ、Brevibacillusによって生産したscFvが結合活性を有することが証明された。
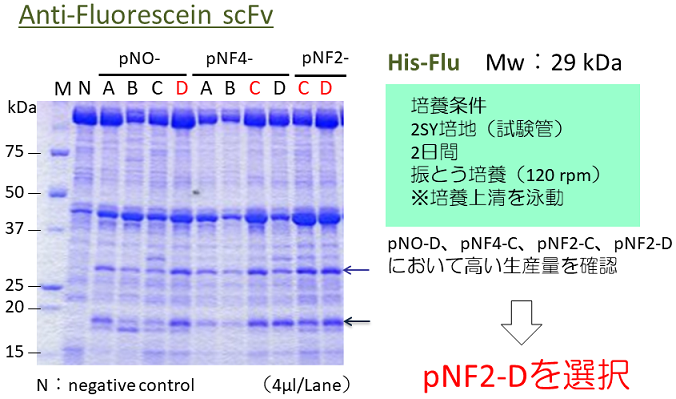
図6 フラグメント抗体scFvの高生産株の選抜
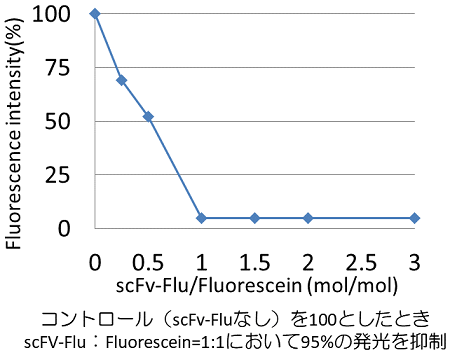
図7 抗原結合活性の評価
5.おわりに
筆者らはBIC法を応用し、最適なプロモーターと分泌シグナルの組み合わせを選択することで、効率的に高生産株を取得できることを実証した。プロテアーゼは大腸菌での生産が困難であったが、Brevibacillusによる分泌発現のメリットを生かし、ジャー培養により最終的に非常に高い生産性を達成することができた。また、scFvの活性型での効率生産にも成功し、今後、フラグメント抗体の生産宿主として広く応用されていくことが期待される。今回ターゲットとした2種類の遺伝子以外にも多数のタンパク質について複数の分泌シグナルとの組合せ最適化試験を行った。その結果、万能な分泌シグナルは存在せず、それぞれのタンパク質との相性があることが判明している。残念ながら現在タンパク質の構造に関する情報から最適分泌シグナルを予測することは不可能で、複数の分泌シグナルを同時並行に試すしかない。
Brevibacillus発現システムは、市販されている上、BIC法の開発により飛躍的に取り扱いが簡便化された。これにより、生産効率の高い発現プラスミドの構築が誰でも簡単にできるようになり、今後はタンパク質分泌生産のスタンダードシステムとして様々なタンパク質研究の場面での利用が拡大していくと期待される。
文献
1) Takagi, H., Kadowaki, K., Udaka, S.: Agric. Biol. Chem., 53, 691 (2013).
2) Mizukami, M., Hanagata, H., Miyauchi, A.: Curr. Pharm. Biotechnol., 11, 251 (2010).
3) Sugimoto, S., Iwase, T., Sato, F., Tajima, A., Shinji, H., Mizunoe, Y.: J. Appl. Microbiol., 111, 1406 (2011).
4) Mu, T., Liang, W., Ju, Y., Wang, Z., Wang, Z., Roycik, M. D., Sang, Q. X., Yu, D., Xiang, H., Fang, X.: Protein Expr. Purif., 91, 125 (2013).
5) Onishi, H., Mizukami, M., Hanagata, H., Tokunaga, M., Arakawa, T., Miyauchi, A.: Protein Expr. Purif., 91, 184 (2013).
6) Midelfort, K. S., Hernandez, H. H., Lippow, S. M., Tidor, B., Drennan, C. L., Wittrup, K. D.: J. Mol. Biol., 343, 685 (2004).