【トピックス】
核酸検出試薬 Labelling ONEの開発
林 浩之輔、神谷典穂
日立アロカメディカル株式会社、九大・未来化学創造セ/九大院・工
1.はじめに
遺伝子組換え技術を用いた基礎研究や、遺伝子検査等の臨床検査分野では、目には見えない微量核酸を配列特異的に検出する需要がある。古くは、DNAを検出するサザンブロッティングやmRNAを検出するノーザンブロッティング、最近ではマイクロアレイなど、多様なアプリケーションが存在する。
核酸検出法の多くで共通する概念は、検出対象の核酸に相補的な配列をもった核酸断片を「核酸プローブ」として用い、これに検出用の標識を施しておくことで、検出対象の核酸との「ハイブリダイゼーション」により二本鎖形成させるというものである。
歴史的には、核酸プローブに放射性同位元素 (RI) を標識し、X線フィルムを感光させて可視化することが主流だった。しかし、RIの取扱いには制限があり、廃棄物の処理などが高コストであることから、現在日本では非放射性 (non-RI) 検出手法が一般的である。non-RI法ではRI標識の代りに、蛍光色素や酵素などを直接あるいは間接的に標識して核酸を検出する。中でも酵素標識はシグナル増幅が可能で検出感度が高いことから、ナイロン膜に固定された核酸を検出するサザンブロッティング法やノーザンブロッティング法、また、薄切組織切片上に固定されたmRNAなどを検出するin situハイブリダイゼーション (ISH) 法などで頻用されている。
標識用の酵素には、アルカリホスファターゼやペルオキシダーゼなどが用いられており、それらの発色基質や発光基質の分解に伴う呈色あるいは発光により可視化を実現している。RI法に関する様々な問題点が解消されるnon-RI法ではあるが、その欠点は操作が煩雑なことである。また、non-RI法の核酸検出試薬は海外メーカーの製品が多い。
そこで、検出感度を低下させることなく操作が簡便で、ユーザーに優しい、Made in Japanの核酸検出試薬「Labelling ONE」を開発した (図1)。

図1 遺伝子検出試薬キット「Labelling ONE」
2.従来技術
現在、ナイロン膜に固定された核酸の検出や、生体組織薄切切片上の核酸を検出するnon-RI法の試薬として、以下の二つの方法が標準となっている。
ひとつは、ハプテンとの抗原抗体反応を用いた方法である。まず、ハプテンが標識された修飾ヌクレオチドをDNAあるいはRNAポリメラーゼによって核酸プローブに取り込ませ、検出対象の核酸とハイブリダイゼーションさせて二本鎖を形成する。その後、抗ハプテン抗体に可視化用酵素が標識された酵素-抗体ハイブリッド分子を用いて抗原抗体反応させ、抗体に標識された酵素の発色基質あるいは発光基質によって核酸を可視化・検出するものである (図2)。
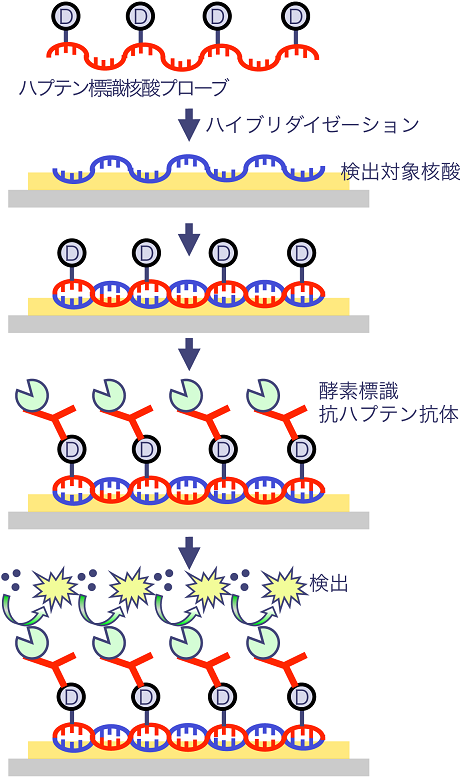
図2 ハプテン標識核酸プローブを用いた検出手順
抗ハプテン抗体に標識される酵素は、主として比活性が高い小ウシ小腸由来アルカリホスファターゼ (Calfintestine Alkaline Phosphatase, CIAP) が用いられており、発色基質や発光基質を用いて強いシグナルを得ることができる。しかし、二本鎖を形成させたのちにCIAP標識抗体を反応させる操作は抗原抗体反応を伴うために、非特異的吸着を防ぐためのブロッキング操作や複数回の洗浄操作など、実験操作が煩雑となる。
もうひとつの方法は、核酸プローブに耐熱性のアルカリホスファターゼを化学的に直接結合させ、検出対象の核酸と二本鎖を形成させて検出するものである。この方法は、抗原抗体反応が不要なため、操作工程数が減り、より簡便な核酸検出が可能である (図3)。
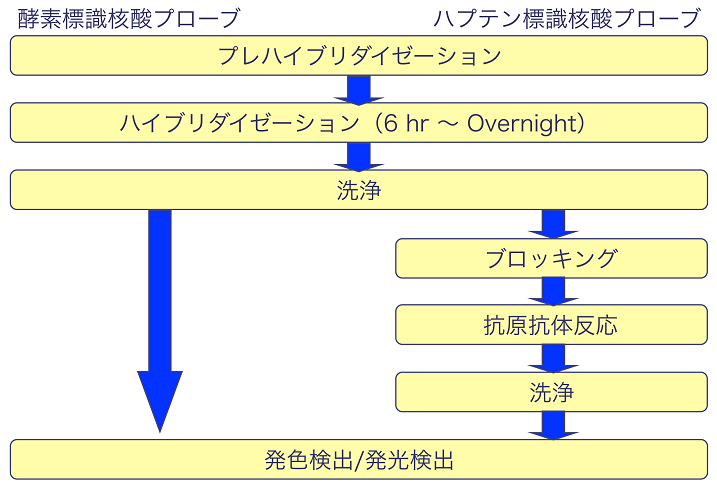
図3 酵素標識核酸プローブとハプテン標識核酸プロー ブを用いた場合の工程の比較
後者の方法では、標識酵素の選択が鍵を握る。すなわち、検出対象の核酸と核酸プローブのハイブリダイゼーション条件に十分耐えられる必要があり、そのため、耐熱性のアルカリホスファターゼが用いられる。しかしながら、その比活性はCIAPに比べると低く、既往法では安価な化学架橋試薬 (ホルムアルデヒド等) を用いてランダムに核酸プローブに対して酵素が架橋されるため、酵素機能の低下や、プローブの二本鎖形成能が低下する恐れがある。その結果、ハプテンを用いる方法に比べて操作は簡単なものの、検出感度が若干劣る。サザンブロッティングやノーザンブロッティングといった一般的な用途では、測定する検体の量を増やすことで問題を回避することも可能であるが、より高い検出感度が要求されるin situハイブリダイゼーション法で用いられることは少ない。
3.Labelling ONEの開発
以上の背景の下、我々は新たな酵素標識核酸プローブの開発に着手した。基本概念として、耐熱性アルカリホスファターゼが配向性を保ったまま部位特異的にラベルされた核酸プローブを設計することで、酵素活性と核酸プローブの二本鎖形成能の保持を同時に実現可能な核酸検出試薬を目指した。
部位特異的な修飾には、アミノ酸側鎖の架橋を触媒するトランスグルタミナーゼ (TGase) を選択した。TGaseは、グルタミンの側鎖のアミノ基とリジンの側鎖のアミノ基、または一級アミノ基との架橋結合を触媒する酵素であり、生体内では、血液凝固反応や、皮膚形成などに関与していることが知られ、生化学分野での応用研究も展開されてい1,2)。
商業的には、微生物由来のトランスグルタミナーゼ (MTG) が食品添加物として利用されている。その架橋反応は温和な条件下で進行し、生体高分子を劣化させることなく架橋できることから、バイオテクノロジー分野では、タンパク質などの生体高分子の部位特異的な修飾や固定化に応用されている。
MTGが高効率に認識する基質として、複数のペプチド配列が知られている。我々は過去の検討3,4)から、ベンジルオキシカルボニル基 (Z基) がN末端に結合したジペプチド基質 (Z-QG) をグルタミン側標識として、MKHK配列をリジン側タグとして選択し、前者を核酸プローブに、後者を超好熱菌由来アルカリホスファターゼに導入することとした。これらを組み合せ、DNAあるいはRNAプローブに耐熱性アルカリホスファターゼをその触媒活性を低下させることなく共有結合させ、検出対象となる核酸とハイブリダイゼーションさせることで、既往法よりも簡便な操作で、高感度に核酸を検出できるプロセスの実現を期待した (図4)。
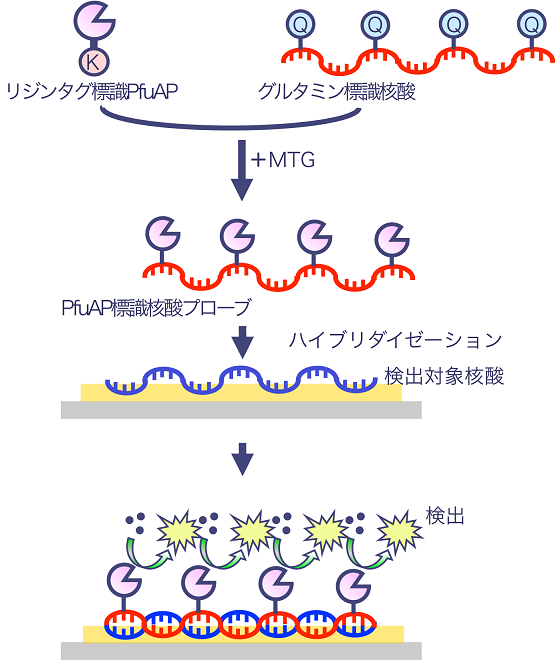
図4 Labelling ONEによる検出手順
4.標識酵素の分子設計と大量発現
標識用として用いられる酵素には、アルカリホスファターゼとペルオキシダーゼがある。遺伝子工学分野では、CIAPが主に用いられており、現在は、遺伝子組換え体が酵母等によって生産されている。また、エンザイムイムノアッセイなどではペルオキシダーゼが主に使われており、西洋ワサビ由来ペルオキシダーゼ (HRP) が用いられている。HRPは遺伝子組換え体が実用化されておらず、天然の西洋ワサビから抽出、精製されたものが販売されている。
一般に、検出対象の核酸に核酸プローブをハイブリダイゼーションさせる際は、検出対象の核酸の高次構造をゆるめて特異的に二本鎖形成を行う必要があるため、高温かつ変性剤存在下で長時間のインキュベーションが行われる。例えば、2 M尿素などの変性剤存在下、反応温度55℃、12時間かけてハイブリダイゼーション操作が行われる。
核酸検出用に市販されている標識酵素の比活性は高く、通常の使用条件下では十分な安定性を有しているが、こうした条件では容易に失活する。従って、あらかじめ核酸プローブに標識した状態で用いる核酸検出用の標識酵素は、上述のようなハイブリダイゼーション反応条件下でも活性を失わない高い耐熱性を有する必要がある。
一方、MTGを用いて酵素を核酸プローブに対して部位特異的に標識するため、酵素のN末端あるいはC末端に、MTGが認識するリジンを含むペプチドタグ (MKHK配列) を導入した遺伝子組換え体を安価に生産可能である必要があった。さらに、製品化に際して、その製造方法等が権利化されていない酵素が望まれた。
そこで我々は、超好熱菌Pyrococcus furiosus由来アルカリホスファターゼ (PfuAP) に着目した。PfuAPは、分子量約53 kDa、等電点約5.3 (計算値) のアルカリホスファターゼであり、大腸菌細胞質で生合成が可能である。その常温での比活性は、CIAPに比べておよそ1/1,000~1/10,000のレベルであるが、耐熱性に優れ、ハイブリダイゼーション条件下でその活性を維持することができる。そこで、PfuAPのN末端にMTGが認識するリジンタグを、C末端には精製を容易にするためのアフィニティタグを遺伝子工学的に導入し、大腸菌タンパク質発現系を用いて組換えPfuAPを大量調製した。
5.グルタミン基質修飾核酸の調製
核酸プローブには、PfuAPのリジンタグと対になるグルタミン残基として、Z-QG基を導入した。Z-QGが修飾されたdUTPあるいはUTPを化学合成により調製した。
DNAプローブを調製する場合は、DNAポリメラーゼを用いてZ-QG-dUTPをDNA鎖に取り込むことができる。KOD DNAポリメラーゼを用いたPCR法では、反応液中のZ-QG-dUTPと非標識dTTPを割合に応じて核酸プローブに取り込まれる (図5)5)。

図5 PCR法により合成したZ-QG標識DNA中のヌクレオシド構成比
ただしPCR法では、Z-QG-dUTPの比率を増やしすぎると、核酸プローブを増幅しにくくなることがある。また、核酸プローブに架橋されるPfuAP分子の数もZ-QG基の割合に応じて増加するため、立体障害から検出対象の核酸と特異的な二本鎖を形成しにくくなり、核酸プローブとしての性能が低下する恐れがある。そこで本製品では、Z-QG-dUTP 40%に対し非標識dTTPが60%でPCRを行うことを推奨している。
なお、Z-QG-dUTPは、PCR法だけでなく、DNAポリメラーゼを用いた様々な修飾法で用いることができる。例えば、ニックトランスレーション法や、ランダムプライミング法、ターミナルトランスフェラーゼを用いた3'端標識法などでも導入可能である。
RNAプローブを調製する場合は、RNAポリメラーゼを用いて、in vitro転写反応により、Z-QG-UTPをRNA鎖に取り込むことができる。DNAプローブ合成のときと同様に、反応液中のZ-QG-UTPと非標識UTPの比率を変えることで、RNA鎖に取り込まれるグルタミン残基の量を制御できる。また、DNAプローブと同様に、PfuAP分子の結合量に依存して核酸プローブとしての性能が低下する恐れがあるため、Z-QG-UTP 40%に対し、非標識UTP 60%でRNAプローブを調製することを推奨している。
DNAポリメラーゼやRNAポリメラーゼでZ-QGヌクレオチドを核酸プローブに取り込ませたあと、市販のスピンタイプのゲル濾過カラムを用いて、余剰のZ-QGヌクレオチドを取り除く。一般的なエタノール沈殿法では、疎水性が高いZ-QGヌクレオチドが核酸プローブとともに沈殿してしまい、十分取り除けないことがあるので注意が必要である。
6.PfuAP標識核酸プローブ
Z-QG標識核酸プローブに、リジンタグが導入されたPfuAPとMTGを混合することで、核酸プローブにPfuAPが共有結合したプローブを容易に得ることができる。このとき、PCR法などで合成したDNAプローブの場合は二本鎖を形成しており、そのままでは検出対象の核酸とハイブリダイズできないため、熱変性して一本鎖DNAにした状態で酵素を結合させる。in vitro転写反応で合成したRNAプローブは、通常、そのまま結合反応に供する。経験的に、結合反応はpH 6付近で効率よく進行する。PfuAPの等電点 (5.3) から、中性付近のpHでは核酸との静電反発によりラベル効率が低下することが考えられる。MTGは比較的広いpHで架橋反応を触媒することから、本アプリケーションに適した架橋酵素である。
7.実施例
サザンブロッティング
PfuAP標識DNAプローブを、サザンブロッティングに用いた結果を図6および図7に示す。
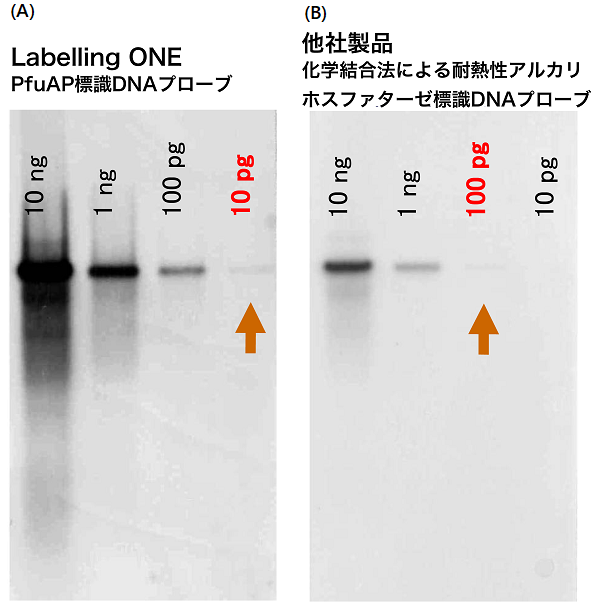
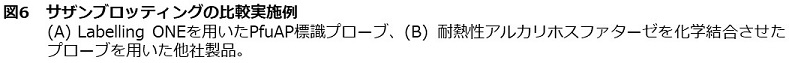
![]()
図6は、10 pgから10 ngまでの種々の量のλファージDNAをHind IIIで消化したサンプルの9416 bpの断片に対し、PCR法により調製したPfuAP標識DNAプローブを用いて検出した。図6(B) に示すように、核酸プローブに直接、耐熱性アルカリホスファターゼを化学結合させて使用する試薬キットを用いた場合の検出感度は100 pg程度であるのに対し、Labelling ONEで調製したPfuAP標識DNAプローブは10 pgのサンプルを検出できた (図6(A))。この結果は、既往の試薬キットでは耐熱性アルカリホスファターゼが化学結合法でランダムに核酸プローブに修飾されているのに対し、LabellingONEは部位特異的に酵素が結合されており、酵素機能と核酸プローブの性能が保持されたことによるものと思われる。
図7は、マウスゲノムDNA 2.5µgおよび5µgをHindIIIで消化した断片から、プロタミン遺伝子をPCR法により調製したPfuAP標識DNAプローブを用いて検出した。図左に示すように、Labelling ONEで調製したPfuAP標識DNAプローブ (図7(A)) は、CIAP標識抗ハプテン抗体を用いた試薬キットを用いた場合 (図7(B))と同等以上の検出感度を示し、より短時間で遺伝子を検出できた。
ノーザンブロッティング
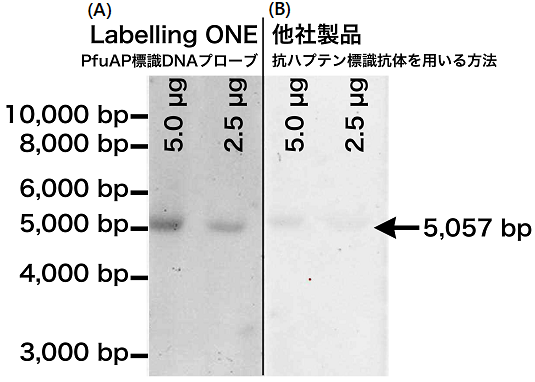
マウス肝臓由来の種々の量のmRNAに対して、内在性遺伝子として頻用されるGAPDH遺伝子を、in vitro転写反応により合成したPfuAP標識RNAプローブを用いて検出した例を示す。15 ngのmRNAを電気泳動したときにGAPDH遺伝子を検出できた (図8)。
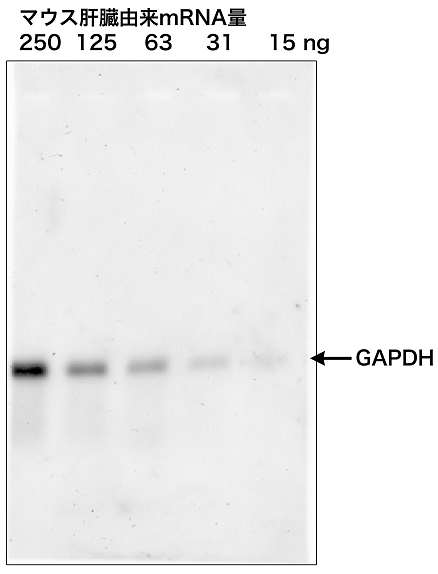
図8 マウスmRNAに対するノーザンブロッティング実 施例
in situ ハイブリダイゼーション
本製品で調製できる核酸プローブは、一細胞中に数分子しかないような少ない発現量のmRNAを検出するほどの感度はまだ得られていない。しかし、発現量がある程度多い遺伝子であれば、十分に検出可能である6)。図9には、マウス精巣の薄切切片上のプロタミン遺伝子をPfuAP標識RNAプローブで検出した例を示す。遺伝子が発現している部分が濃い色を呈している。
図9 マウス精巣中に発現しているプロタミン遺伝子に 対するin situハイブリダイゼーション法の実施例
核酸-タンパク質ハイブリッド分子調製
本製品は、核酸プローブにアルカリホスファターゼを部位特異的に標識することを目的にした製品構成になっているが、MTGの基質になるリジンタグ付きタンパク質を用意できれば、DNAやRNAとタンパク質のハイブリッド分子を簡単に調製することができる。本稿では、核酸が核酸に複数分子標識されたプローブを紹介したが、ターミナルデオキシトランスフェラーゼを用いることで核酸の3’端選択的な酵素の標識も可能である7)。
9.おわりに
微量核酸を配列特異的に可視化するための試薬キットの開発に成功した。本製品で調製される核酸プローブは、耐熱性アルカリホスファターゼが標識されているため、ハイブリダイゼーション後の検出操作が簡便であり、検出に要する時間や手間を短縮できる。また、酵素触媒による部位特異的な生体分子架橋反応の利用により、CIPAに比べて比活性が劣るPfuAPを用いても、CIAP標識抗ハプテン抗体を用いる既往法と同等以上の核酸検出感度を達成した。従来の耐熱性アルカリホスファターゼ標識核酸プローブと比較すると各段に高感度に核酸を検出できた。試薬用冷凍庫の中を海外メーカーの製品が多く占めている国内の実験室は少なくないと思われるが、本製品がそうした現状を打破する一助になれば幸いである。
謝辞
本製品開発は、平成20~22年度、JST重点地域研究開発促進プログラム (育成研究)「革新的核酸-酵素ハイブリッド化技術の開発」により実施しました。徳島大学野地澄晴先生をはじめとする全ての共同研究者の皆様に厚く御礼申し上げます。また、製品化にあたっては、㈱横浜バイオリサーチサプライ様、神戸天然物化学㈱様、㈱ジーンアクト様、㈱アワジェニック様、和光純薬工業㈱様をはじめ、多くの関係企業様に多大なご協力とご尽力を賜りました。この場を借りて厚く御礼申し上げます。
文献
1) 長谷川 豪、斉藤佑尚: 蛋白質核酸酵素, 49, 642 (2004).
2) 人見清隆: バイオサイエンスとバイオインダストリー, 70, 442 (2012).
3) Kamiya, N., Doi, S., Tominaga, J., Ichinose, H., Goto, M.: Biomacromolecules, 6, 35 (2005).
4) Tominaga, J., Kemori, Y., Tanaka, Y., Maruyama, T., Kamiya, N., Goto, M.: Chem. Commun., 4, 401 (2007).
5) Kitaoka, M., Tsuruda, Y., Tanaka, Y., Goto, M., Mitsumori, M., Hayashi, K., Hiraishi, Y., Miyawaki, K., Noji, S., Kamiya, N.: Chem. Eur. J., 17, 5387 (2011).
6) Kitaoka, M., Mitsumori, M., Hayashi, K., Yoshinaga, H., Nakano, K., Miyawaki, K., Noji, S., Kamiya, N.: Anal. Chem., 84, 5885 (2012).
7) Takahara, M., Hayashi, K., Goto, M., Kamiya, N.: J. Biosci. Bioeng., in press.
Labelling ONEは、日本における日立アロカメディカル株式会社の登録商標です。