【トピックス】
超好熱菌を用いた水素連続生産系の構築
金井 保、跡見晴幸、今中忠行
京大院・工/JST・CREST、京大院・工/JST・CREST、立命大・生命科学/JST・CREST
1.はじめに
水素 (H2) は燃焼生成物が水であること、燃料電池の動力源として高い効率で電気エネルギーへと変換可能であることなどから、次世代のエネルギー媒体として注目を集めている。しかしながら水素は天然資源として産出することはなく、現在は天然ガスの水蒸気改質 (CH4 + 2H2O → 4H2 + CO2) により生産されている。従って、水素をエネルギー媒体とするクリーンな循環型社会の実現のためには、再生可能エネルギーを用いた水素生産法の確立が求められている。
生物が代謝産物として水素を生成することは古くから知られている。一部の嫌気性微生物は、有機物分解に伴い水素を発生する (発酵水素生産)。ちなみに発酵水素生産では、有機物の酸化と二酸化炭素の放出を伴うが、その有機物は大気中の二酸化炭素が同化されてできたものであり、全体としてカーボンニュートラルである。現在、発酵水素生産の候補株として良く研究が行われている生物種として、Clostridium属細菌1)、Enterobacter属細菌2,3)、Caldicellulosiruptor属細菌4)などがある (表1)。これらの株を元に、遺伝子工学的アプローチや培養工学的アプローチにより水素生産能力の向上も試みられているが、実用化までにはさらなる研究開発が必要である。本稿では、超好熱性アーキアThermococcuskodakarensisの発酵水素生産能力に着目し、その水素発生能力を評価し、また水素発生に関係する代謝系の解析と改良を通じて、本菌の水素発生能力の増強を行った結果について紹介する。
表1 水素発生速度 (菌体あたり) の比較
2.T. kodakarensisによる発酵水素生産5)
T. kodakarensis KOD1株 (図1) は、鹿児島県トカラ列島小宝島の海岸に近い硫気孔より単離された超好熱性アーキアである (至適生育温度85℃)6,7)。我々は2005年に本菌の全ゲノム配列を報告し8)、また同時期に本菌の特異的遺伝子組換えシステムを開発した9,10)。本菌は偏性嫌気性、従属栄養性菌であり、人工海水塩・酵母エキス・トリプトンを含む天然培地に元素硫黄 (S0) を添加した培養条件で良好に生育する。この際、S0が最終電子受容体として用いられ、硫化水素が発生する。一方で、本菌はS0非存在下でも、培地中にピルビン酸や可溶性デンプン (もしくはマルトデキストリン) を加えることで、良好に生育する。この際にもガス成分の蓄積が見られることから、水中のプロトン (H+) を電子受容体として利用し、水素が生成していることが予想された。そこで我々はT. kodakarensisが生産するバイオガスの成分分析と定量を行った。
図1 Thermococcus kodakarensisの電子顕微鏡写真
ガスリフト型高温嫌気性培養装置を用いて、培養温度85℃で本菌の回分培養を行った。培養槽には窒素ガスを一定速度で導入し、排出ガスをガスクロマトグラフィー装置に導入して、ガス成分の経時的分析を行った (図2)。人工海水塩に酵母エキス、トリプトンを各0.5% (w/v) 加えた基本培地 (MA-YT培地) に0.2% (w/v) S0を加えた培地 (MA-YT-Sul培地) では、発生ガスの主成分は硫化水素と二酸化炭素であり、また少量の水素発生も確認された (水素の最大発生速度は0.30 mmol L-1h-1)。MA-YT培地に0.5% (w/v) のピルビン酸ナトリウムもしくは0.5% (w/v) の可溶性デンプンを加えた培地 (MA-YT-Pyr培地もしくはMA-YT-Sta培地) を用いた場合は、どちらも水素の発生が見られ、その発生速度の最大値はそれぞれ3.88 mmol L-1 h-1 (MA-YT-Pyr培地) と3.17 mmol L-1 h-1 (MA-YT-Sta培地) に達した。一方で、両条件での水素と二酸化炭素の発生割合は大きく異なり、MA-YT-Pyr培地では水素と二酸化炭素がほぼ同量発生したのに対し、MA-YT-Sta培地では水素は二酸化炭素の約2倍量生成した。また培養後の培地上清の成分分析を行った結果、どちらの場合も酢酸とアラニンが蓄積していることが判明した。
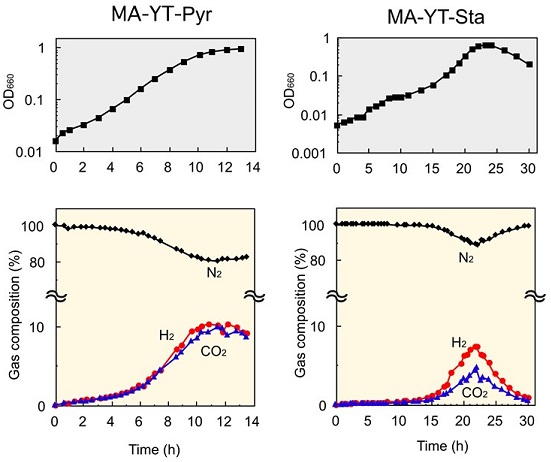
図2 回分培養における菌体増殖 (上) と水素と二酸化炭素の発生割合 (下)
回分培養における水素の発生速度は、培養経過に伴って上昇し、対数増殖後期で最大に達した後、定常期に達すると急激に低下した。つまり本菌が生産する水素は菌体増殖と密接にリンクすることが判明した。そこで本菌を用いた水素連続生産系を構築するため、連続培養実験を行った (図3)。連続培養では、槽内に常に新しい培地が添加されることから、菌体は絶えず分裂を繰り返す。希釈率D=0.2 h-1の条件で実験を行った結果、菌体濃度が一定となる定常状態が達成され、この時の単位体積あたりの水素発生速度は9.46 mmol L-1 h-1 (MA-YTPyr培地) と6.70 mmol L-1 h-1 (MA-YT-Sta培地) であった。また単位乾燥菌体重量あたりの水素発生速度は、24.9 mmol g-dcw-1 h-1 (MA-YT-Pyr培地)、14.0mmol g-dcw-1 h-1 (MA-YT-Sta培地) を記録した (表1)。さらに希釈率を0.8 h-1まで上昇させることで、MA-YT-Pyr培地で59.6 mmol g-dcw-1 h-1の水素発生速度 (単位菌体あたり) を記録した。この数値は、これまでに高い発酵水素生産能力をもつことが知られているEnterobacter cloacae IIT-BT 08における値 (29.6 mmol g-dcw-1 h-1)3)を大きく超えていることから、本菌株が非常に高い水素発生能力を持つことが明らかとなった。
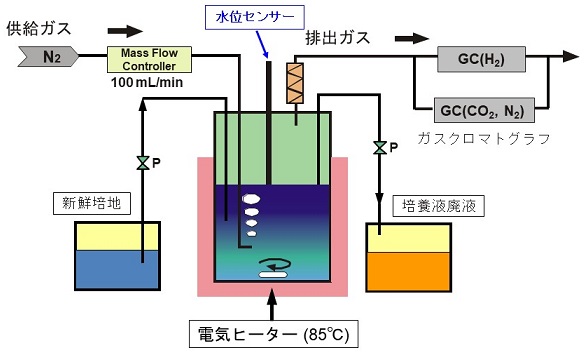
図3 連続培養実験のフロー図
3.T. kodakarensisのゲノム上の3種のヒドロゲナーゼホモログ8)
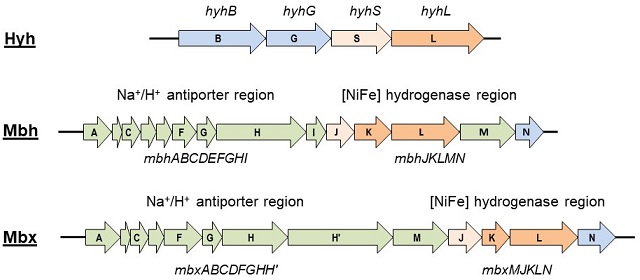
T. kodakarensisのゲノム上には3種類の[NiFe]ヒドロゲナーゼホモログ (Hyh, Mbh, Mbx) が存在する (図4)。Hyhは細胞質局在型、MbhとMbxは細胞膜局在型と予想された。[NiFe]ヒドロゲナーゼは活性中心を含む大サブユニットと小サブユニットから成るヘテロダイマー構造を基本とする。Hyhオペロンは4つのORFから構成されており、大小サブユニットの遺伝子 (hyhSL) 以外に、NAD(P) とフラビンに対する結合ドメインを共にもつ遺伝子 (hyhG) と、複数の鉄硫黄クラスターを含む遺伝子 (hyhB) を含む。一方で、MbhとMbxは互いに類似した遺伝子構造をもつパラログの関係にあり、それぞれ13個と14個のORFから構成されている。両者は共にメタン菌に存在するenergy-converting型[NiFe]ヒドロゲナーゼ (Ech)11)と相同性をもつ領域とNa+/H+ antiporterと相同性をもつ領域を含んでおり、細胞膜上におけるイオン濃度勾配の形成を介した細胞内のエネルギー産生に関与することが予想された。

4.細胞質型ヒドロゲナーゼHyhの特性解析12)
これらの3種のヒドロゲナーゼホモログの生理学的機能を明らかにすることを目的として、まずはT. kodakarensisの細胞質型ヒドロゲナーゼHyhの精製・機能解析を進めた。Hyhの組換え型大サブユニットに対するポリクローナル抗体を固定化したカラムにより、無細胞抽出液からのHyhの精製を行った。精製酵素のサブユニット構成を解析した結果、本酵素はオペロン内の各遺伝子に対応する4種類のタンパク質からなるヘテロテトラマー構造を基本とし、ヘテロテトラマーあたりNiが1個、Feが約20個、FADが1分子それぞれ含まれていた。本酵素は電子伝達体としてNADP(H) が利用可能であった。水素の酸化還元電位はNADPHよりも低いことから、本酵素は生理的には水素から電子を受け取り、NADPHの生成を伴う水素酸化 (H2 + NADP+ → NADPH + H+) に関与すると予想された。
5.[NiFe]ヒドロゲナーゼホモログの生理学的機能解明13)
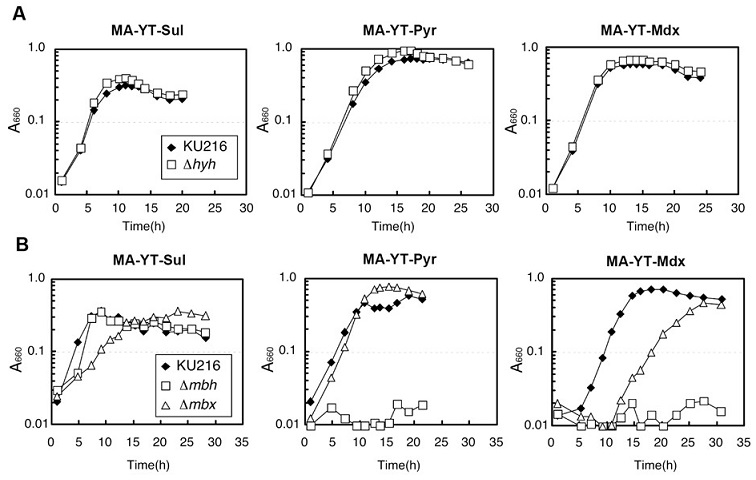
MbhとMbxの2種の膜型ヒドロゲナーゼホモログについては、活性を維持した状態で精製することは困難であったので、続いて遺伝学的アプローチによる[NiFe]ヒドロゲナーゼホモログの機能解明を進めた。各ヒドロゲナーゼオペロンの大サブユニットに相当する遺伝子を含む領域を除いた破壊株 (Hyh破壊株: PHY1株、Mbh破壊株: MHD1株、Mbx破壊株: MXD1株) をそれぞれ作製した。これらの破壊株について、MA-YT-Sul培地、MA-YT-Pyr培地、さらにMA-YT培地に0.5% (w/v) マルトデキストリンを添加した培地 (MA-YT-Mdx培地) における生育特性を検討した。なおMA-YT-Sta培地とMA-YT-Mdx培地は、実験上の設定としては同じ培地であるが、デンプンよりもより低分子であるマルトデキストリンを用いることで、実験間における再現性が向上した。培養の結果、PHY1株は全培地条件で宿主と同様に生育したが、MHD1株では硫化水素発生条件 (MA-YTSul培地) では宿主と同様に生育したものの、水素発生条件 (MA-YT-Pyr培地とMA-YT-Mdx培地) では生育しなかった。一方、MXD1株では硫化水素発生条件 (MA-YT-Sul培地) において比増殖速度の低下が観察されたが、水素発生条件 (MA-YT-Pyr培地とMA-YT-Mdx培地) では宿主株と生育に大きな差は見られなかった (図5)。次にMA-YT-Sul培地におけるこれらの破壊株の水素と硫化水素の発生量を比較したところ、PHY1株では水素発生量 (菌体あたり) が大幅に増加し、逆にMHD1株 (Mbh破壊株) では水素発生量 (菌体あたり) が大きく減少した。一方で、MXD1株では硫化水素発生量 (菌体あたり) が低下した。さらに各ヒドロゲナーゼホモログの発現条件を調べた結果、HyhとMbhは水素発生条件でタンパク質量が増加したが、Mbxは硫化水素発生条件でタンパク量の増加が見られた。以上の結果を考え合わせて、各ヒドロゲナーゼホモログの生理的機能を以下のように予想した。HyhとMbhは共に水素発生条件で機能する。Mbhが本菌の水素発生に関与する最も主要なヒドロゲナーゼであるのに対し、Hyhは水素吸収反応に関与する。一方でMbxは硫化水素発生条件で機能し、硫化水素の発生に関与する。
![]()
6.水素関連代謝経路モデル
本菌はデンプンやピルビン酸をエネルギー源として生育し、代謝産物として酢酸、アラニン、水素、二酸化炭素を菌体外に排出する。今回の実験結果と、これまでに本菌や類縁菌で判明している結果を考慮して、本菌の水素生成に関わる代謝系を推定した (図6)。デンプンやマルトデキストリンはまず細胞外で低分子化された後に細胞内に取り込まれ、さらにグルコース単位にまで分解される。グルコースは解糖系により2分子のピルビン酸へと変換される。この時にglyceraldehyde-3-phosphate:ferredoxin oxidoreductase (GAPOR) による反応で放出された電子はferredoxin (Fd) へと移り、還元型Fd (Fdred) が生成する14,15)。ピルビン酸以降の代謝は、酸化反応により酢酸を生成する経路と、還元的反応によりアラニンを生成する経路の二つが存在する。まず酸化的代謝では、pyruvate: ferredoxin oxidoreductase (POR) により、ピルビン酸がCoAとFd依存的に脱炭酸され、アセチルCoAと (二酸化炭素) とFdredが生成する16)。MbhはFdredから直接電子を受け取り水素が生成すると同時にプロトンポンプとしても機能し、これによりプロトン濃度勾配が生じる17-19)。このプロトン勾配がNa+勾配へと変換された後、Na+勾配依存的なATP synthaseによりATPが合成されると考えられている20)。一方で、POR反応で生成したアセチルCoAは、さらにacetyl-CoAsynthetase (ACS) により酢酸に変換され、その際にATPが生成する (基質レベルのリン酸化)21-23)。このように本菌の水素発生とエネルギー代謝は密接に関係しており、このために水素発生は活発にエネルギーが産生される対数増殖期でしか見られないと考えられる。一方でピルビン酸の還元的代謝では、alanin eaminotransferase (AlaAT) によるグルタミン酸からのアミノ基転移反応によりアラニンが生成する24)。この際に副生する2-オキソグルタル酸はアンモニアとNADPHにより、再度グルタミン酸へと変換される25)。この時に必要となる還元力 (NADPH) の一部は、Hyhによる水素の吸収により供給される。代謝産物としてアラニンが生成する理由として、高濃度では有害となるアンモニア濃度を低下させることが考えられるが、本菌はアラニン生成のための還元力として自らが生成する水素を再利用することで、効率的なエネルギー利用を実現していると考えられる。
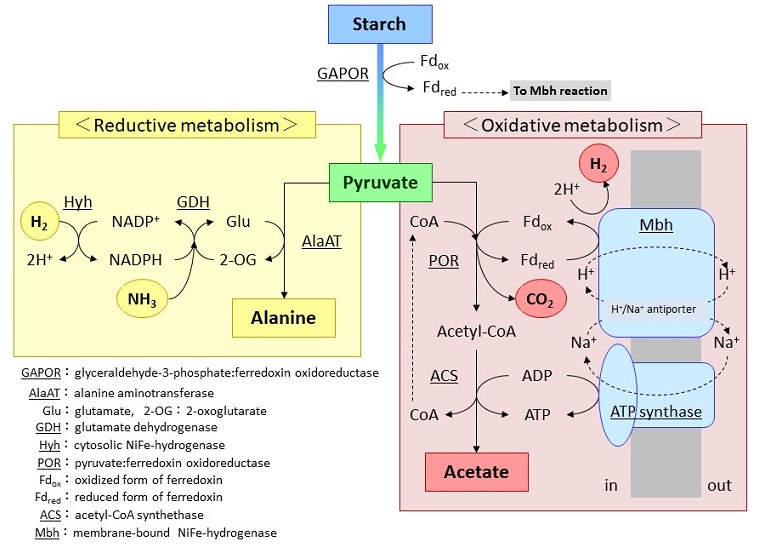
図6 T. kodakarensisの水素の生産・消費に関係する予想代謝経路
7.水素高生産株の分子育種
本菌の代謝経路モデルを基に、水素高発生株の分子育種を行った。まずはピルビン酸からアラニンへの還元的代謝の遮断を目的として、ホスト株であるKU216株より、HyhとAlaATの両遺伝子破壊株 (DPHA1株) を作製した。この株の水素発生速度をMA-YT-Pyr培地を用いた連続培養条件 (D=0.25 h-1) で測定した。その結果、DPHA1株の菌体あたりの水素発生速度 (31.0 mmolg-dcw-1 h-1) は、KU216 株 と比較して (28.1 mmolg-dcw-1 h-1)、約10%増加した (表1)。続いて、水素発生に直接関与するMbhの遺伝子高発現株として、mbhオペロンのプロモーター強化株 (MHG1株) を作製した。このMHG1株の水素発生速度を同様に測定した結果、KU216株と比較して約25%もの向上 (35.3 mmolg-dcw-1 h-1) がみられた。最後に、DPHA1株をホスト株としたmbhプロモーター強化株 (MAH1株) を作製した。その結果、これまでで最高となる菌体あたりの水素生産速度 (36.2 mmol g-dcw-1 h-1) を達成した。
8.将来展望
超好熱菌を用いた水素生産には、培養のために高温環境を維持する必要はあるものの、多くの利点が存在する。1) 高温環境では、デンプンなど多糖類の溶解度が大幅に上昇することから、基質の前処理過程が簡略化され、2) 基質濃度上昇に伴い分解反応も加速される。3) 高温環境 (特に超好熱菌の培養環境) においては、他生物種のコンタミネーションが生じたとしても、これらの菌は増殖ができないことから、目的以外の反応が生じる可能性は極めて低い。特に水素生産では、もしメタン菌が混入し増殖すると、これらが水素を消費しメタンを生成するため、水素の生産量が大きく低下する原因となる。
T. kodakarensisを含むThermococcales目に属するアーキアは、高い水素生産能力をもつことが知られている。Pyrococcus furiosusでは、連続培養実験により、T. kodakarensisと同様に高い菌体あたりの水素発生能力があることが示されている (80 mmol g-dcw-1 h-1)26)。Thermococcus onnurineusでは、ギ酸や一酸化炭素からの水素生産が報告されている27-29)。さらにT. kodakarensisにおいても、Reeveらにより、HyhおよびMbhの転写を共に制御するSurRの高発現株が、特にSoとピルビン酸を共に含む培養条件において、水素生産量を向上させることが示されている30)。
他方で、現時点でのこれらの菌による水素生産は、未だ実用レベルには達していない。現在の試算では、仮に標準家庭で求められる発電量 (310k W h) をT. kodakarensisが生産する水素により賄うとすると、約400Lもの培養液量が必要となる。現時点での菌体密度はまだまだ低い (OD>1) ことから、今後は菌体自体の改良と同時に、菌体を保持するための固定化担体の導入など、高密度培養法の検討も重要となるであろう。
文献
1) Karube, I., Matsunaga, T., Tsuru, S., Suzuki, S.: Biochim. Biophys. Acta, 444, 338 (1976).
2) Tanisho, S., Wakao, N., Kosako, Y.: J. Chem. Eng. Jpn., 16, 529 (1983).
3) Kumar, N., Das, D.: Process Biochem., 35, 1075 (2000).
4) de Vrije, T., Mars, A. E., Budde, M. A. W., Lai, M. H., Dijkema, C., de Waard, P., Claassen, P. A. M.: Appl. Microbiol. Biotechnol., 74, 1358 (2007).
5) Kanai, T., Imanaka, H., Nakajima, A., Uwamori, K., Omori, Y., Fukui, T., Atomi, H., Imanaka, T.: J. Biotechnol., 116, 271 (2005).
6) Morikawa, M., Izawa, Y., Rashid, N., Hoaki, T., Imanaka, T.: Appl. Environ. Microbiol., 60, 4559 (1994).
7) Atomi, H., Fukui, T., Kanai, T., Morikawa, M., Imanaka, T.: Archaea, 1, 263 (2004).
8) Fukui, T., Atomi, H., Kanai, T., Matsumi, R., Fujiwara, S., Imanaka, T.: Genome Res., 15, 352 (2005).
9) Sato, T., Fukui, T., Atomi, H., Imanaka, T.: J. Bacteriol., 185, 210 (2003).
10) Sato, T., Fukui, T., Atomi, H., Imanaka, T.: Appl. Environ. Microbiol., 71, 3889 (2005).
11) Meuer, J., Bartoschek, S., Koch, J., Kunkel, A., Hedderich, R.: Eur. J. Biochem., 265, 325 (1999).
12) Kanai, T., Ito, S., Imanaka, T.: J. Bacteriol., 185,1705 (2003).
13) Kanai, T., Matsuoka, R., Beppu, H., Nakajima, A., Okada, Y., Atomi, H., Imanaka, T.: J. Bacteriol., 193, 3109 (2011).
14) Mukund, S., Adams, M. W. W.: J. Biol. Chem., 270, 8389 (1995).
15) Matsubara, K., Yokooji, Y., Atomi, H., Imanaka, T.: Mol. Microbiol., 81, 1300 (2011).
16) Blamey, J. M., Adams, M. W. W.: Biochim. Biophys. Acta, 1161, 19 (1993).