【トピックス】
発酵法による芳香族ホモアミノ酸生産プロセス開発
纐纈健人、三橋 敏、田畑和彦
協和発酵バイオ株式会社、協和発酵バイオ株式会社、協和発酵バイオ株式会社
1.はじめに
ホモフェニルアラニン (Hph) は、フェニルアラニン (Phe) の側鎖が1炭素長い非天然型アミノ酸であり (図1)、エナラプリルに代表される様々なアンジオテンシン合成酵素阻害薬1)や、最近、多発性骨髄腫治療薬としてFDAに承認されたプロテアソーム阻害薬カーフィルゾミブ2)の構造に含まれている (図2)。医薬品合成のキラルビルディングブロックとして有用であることから、様々なHph生産プロセスが開発されてきた。Hph構造には不斉中心が含まれるため、酵素を用いた不斉合成プロセスが有用である3)。以下、代表的な化学−酵素プロセスを3つ挙げる。1つ目は、化石燃料から化学合成された2-オキソフェニルブタン酸 (2-OPBA) を基質とし、トランスアミナーゼを用いた立体選択的アミノ化反応によりHphに変換する方法4)。2つ目は、2-OPBA を基質とし、NAD(P)H依存性アミンデヒドロゲナーゼを用いた還元的アミノ化により合成する方法である5)。この方法ではギ酸デヒドロゲナーゼを共存させることで補因子の再利用が可能となっている。3つ目は、ヒダントイナーゼとカルバモイラーゼを用いて、ヒダントイン誘導体を光学分割し合成する方法である6)。これら化学−酵素プロセスは、実用的かつ効率的なHph製造方法であると言えるが、一方で、通常のアミノ酸製造法を見てみると、グリシンなど一部のアミノ酸を除き、多くのアミノ酸は発酵生産プロセスによって生産されている7)。グルコースなど安価な原料から微生物代謝により、直接目的物質を作り出すことができる発酵法は、最も効率的なアミノ酸類製造法と言える。このような観点から、我々は、非天然型アミノ酸であるHphの直接発酵生産の可能性を検証すべく研究を始めた。本稿では、Hph発酵生産を実現する上で最も重要であるHph生合成遺伝子の同定と、Hph及び芳香族ホモアミノ酸類の大腸菌を用いた物質生産について筆者らの研究成果を紹介したい。
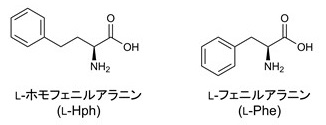
図1 L-ホモフェニルアラニン、L-フェニルアラニンの構造
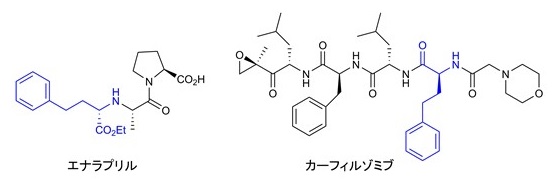
図2 ホモフェニルアラニン構造を含む医薬品の化学構造
2.ホモフェニルアラニン生合成遺伝子の発見
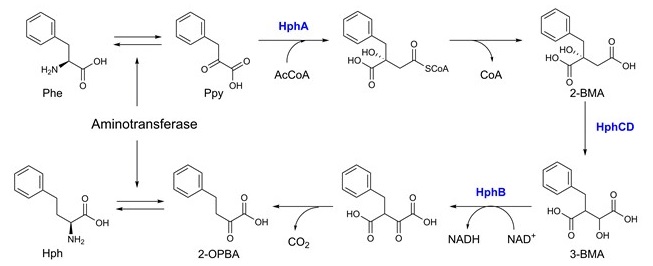
研究を開始するにあたり、まずHph生合成機構について考察した。Hphは、Pheよりも側鎖が1炭素長い構造であるが、これがロイシンとバリンの関係と同じであることに着目した。ロイシンは、バリンより次の経路により生合成される。α-ケトイソ吉草酸 (バリン前駆体のケト酸) は、isopropylmalate synthase (LeuA) の作用でアセチル-CoAが縮合し、続いてCoAが加水分解されることで、2-イソプロピルリンゴ酸に変換される。その後、3-isopropylmalate isomerase (LeuC/LeuD) による水酸基の転移、続く3-isopropylmalate dehydrogenase (LeuB) による水酸基の酸化と脱炭酸によってα-ケトイソカプロン酸に変換され、最後、トランスアミナーゼによってアミノ化されることで、ロイシンへと変換される。この一連の反応により、バリンの側鎖炭素が1炭素伸長される。Hphも同様の炭素鎖伸長反応から生合成されると考えた (図3)。次に、Hph生合成遺伝子を取得するための遺伝子ソースとして、Hph構造を含むペプチド系二次代謝産物であるanabaenopeptinを生産するシアノバクテリアに着目した。Anabaenopeptin の基本骨格は、非リボソーム依存型ペプチド合成酵素 (NRPS) によって生合成されることがすでに報告されていた
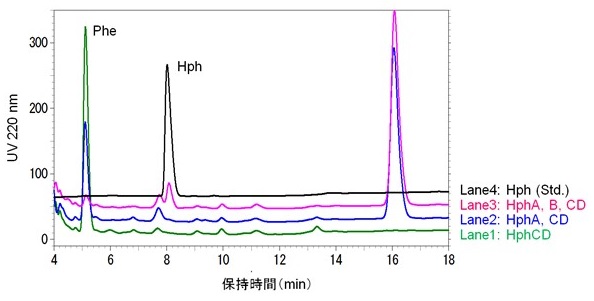
8)。しかし、文献にはNRPSに関する記述はあったものの、Hph生合成やその遺伝子に関することは記述されていなかった。そこで、我々はゲノムが解析されていたシアノバクテリウムNostoc punctiforme PCC73102のanabaenopeptin類生合成遺伝子クラスター周辺に、ロイシン生合成遺伝子と類似の酵素遺伝子が存在しないか調べた。そして、LeuA, LeuB, LeuC/LeuDに対応する3つの遺伝子 (HphA, HphB, HphCDと名付けた) を見出した。実際に、これら3つの遺伝子を組み込んだ2種の発現プラスミド (pTrc99a-hphCD-hphA及びpSTV29-hphB) を作製し、大腸菌W3110株に導入することで、HphABCD発現株を構築した。作製した菌株をPhe (1 g/L) 添加条件で培養し、Hph生成の有無をHPLC分析により調べた。結果、3つ全ての遺伝子を導入した株でのみ、標品と一致する保持時間にピークを観測した (図4)。これにより、Pheの前駆体ケト酸であるフェニルピルビン酸 (Ppy) を基質に、HphA, HphCD, HphBによる多段階反応によりHphが生成することを世界で初めて実証するができ、同時に、Hphの発酵生産の可能性を示すことにもできた (図3)9)。

![]()
次に、Hph生合成遺伝子のホモログ遺伝子の存在を調べるため、HphAアミノ酸配列をクエリとしBlast検索を行った。その結果、Hph生合成遺伝子は、Anabaena sp. 90、Nodularia spumigena CCY9414、Synechococcus sp. strain PCC 7335、Oscillatoria sp. strain PCC6506 などのシアノバクテリアのゲノムにも存在していることが判明した (図5)。また、2012年に調べた時点では、5種のホモログ遺伝子しか見られなかったが、2014年3月に再度調べたところ9種に増えていた。つまり、Hph生合成遺伝子は、様々なシアノバクテリアのゲノムに普遍的に存在しており、今後シアノバクテリアのゲノム解析が進むにつれ、さらに多くのホモログ遺伝子が明らかになってくると思われる。二次代謝産物の生産について、Anabaena やN. spumigena は、Hphやホモチロシン (Hty) 構造を含む環状ペプチドを生産することが知られているが、一方で、Synechococcus sp.やXenococcus sp.などは、そのような環状ペプチドの単離は報告されていない。芳香族ホモアミノ酸構造を含む新規なペプチド系二次代謝産物を生産していると思われるが、実際にどのような構造の物質が生産されているか興味が持たれる。
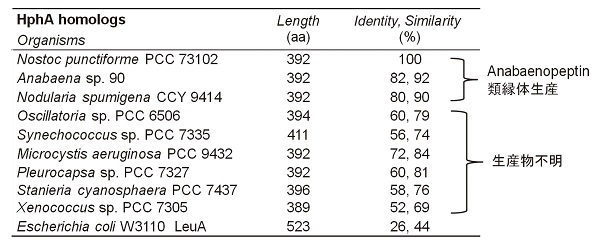
図5 HphAホモログ; Blast検索結果
3.ホモフェニルアラニン生産性向上と直接発酵検討
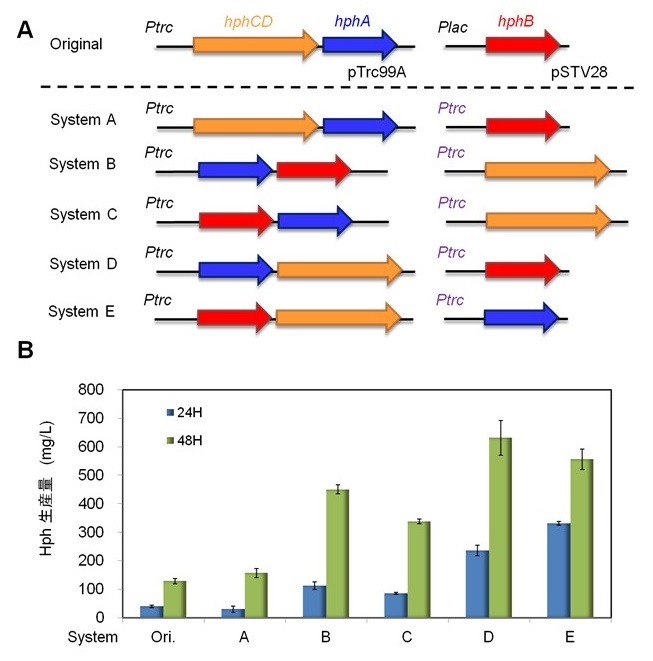
Hph生合成遺伝子の同定は出来たものの、生産量は〜154 mg/Lと低いものであった。低生産の原因として、Hphによるフィードバック阻害が考えられた。ロイシン生合成においては、最終産物であるロイシンは、LeuAのC末端ドメインに結合し、その活性を阻害することはよく知られていた10)。HphAもHphによる阻害の可能性が疑われたが、HphAとLeuAのアミノ酸配列を比較したところ、HphAにはLeuAのロイシン結合ドメインに相当する部分が欠失しており、Hph生合成系にはHphによる阻害機構がないと予想された。このことから、単純に各酵素の発現強度を変えれば、生産性が向上できるのではないかと考えた。実際に、2種類の発現ベクター上での3つの遺伝子の並び順を変えた5つの発現系を新たに構築し、Phe (1 g/L) 添加条件で培養評価を実施した (図6)。結果、4種の発現株で生産性の向上が認められ、特にSystem D (E.coli W3110/pTrc99a-hphA-hphCD, pSTV28-hphB) では、培養24時間で220 mg/L、48時間で630 mg/Lと生産性が大幅に向上し、発現最適化の有効性を示すことができた。

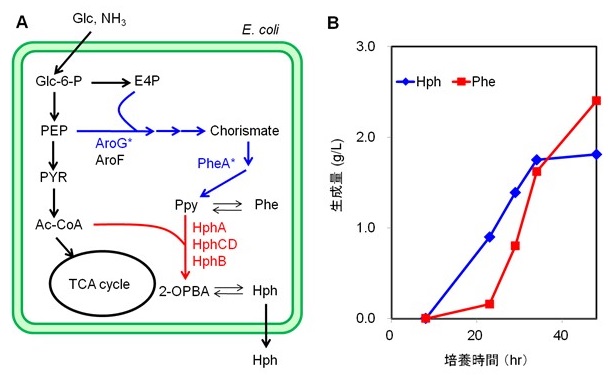
次に、これまではPhe添加条件で培養してきたが、安価な糖源であるグルコースからの直接発酵の可能性を検証することにした。宿主にPhe生産性を付与するために、Phe生合成の鍵酵素であるPheAとAroGの脱感作型変異遺伝子を低コピープラスミドpMW219に組み込んで宿主に導入し、さらに、Hph生合成遺伝子発現プラスミドを導入した菌株を作製した (図7A)。この菌株について、Phe添加条件、非添加条件でジャーファーメンターを用いて流加培養を実施した。Phe添加 (10 g/L) 条件では1.8 g/L、Phe非添加条件では1.7 g/Lと、同程度のHph生産が確認できた (図7B)。これにより安価な糖源からの直接発酵の可能性を示すことができた。

4.芳香族ホモアミノ酸発酵生産への応用
作製したHph生産株の基質特異性を調査するために、チロシン、トリプトファンやPheアナログを基質として、対応するホモアミノ酸が生成するか検討した (図8)。上記System Dの菌株を用い、チロシン、トリプトファン及びフェニルアラニンアナログ添加培地で培養し、上清をHPLC分析し、ホモアミノ酸の有無を調べた。結果、チロシンからはHtyが生成し、p-フッ素化フェニルアラニン、o-フッ素化フェニルアラニンからは、それぞれホモアミノ酸が生成することを確認した。一方、トリプトファンや嵩高い置換基を持つアナログ (p-ヨードフェニルアラニン、p-ニトロフェニルアラニン) や側鎖炭素鎖の構造が異なるアミノ酸 (β−メチルフェニルアラニン、フェニルグリシン) ではホモアミノ酸は生成しなかった。以上のことから、開発したホモアミノ酸生産システムは、様々な芳香族アミノ酸を対応するホモアミノ酸に変換させることができる有用な方法であると言える。
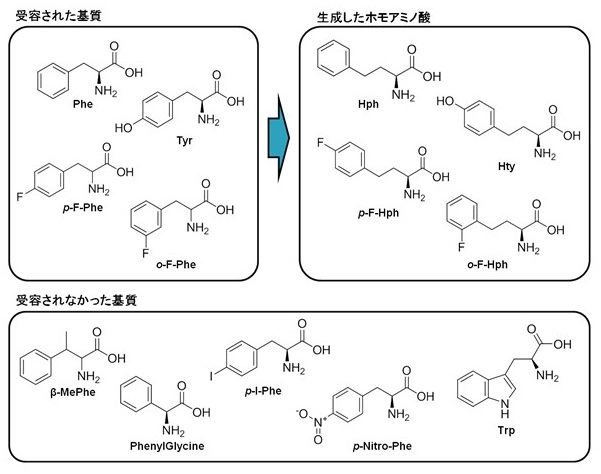
図8 Hph生合成遺伝子発現株の基質特異性
5.おわりに
従来、非天然型アミノ酸であるホモフェニルアラニンは化学−酵素法で生産されてきたが、我々は新規生産プロセスの開発を目指し、直接発酵法の開発に取り組んだ。鍵となったのはHph生合成遺伝子を取得できるかであったが、シアノバクテリア由来二次代謝産物の構造にホモアミノ酸が含まれていることに着目し、遺伝子情報を手掛かりにHph生合成遺伝子を発見することができた。当初Hph生産性は低かったが、発現最適化を行うことで劇的に生産性も改善された。さらに、本生産システムは基質特異性が比較的広く、Hph以外にもホモチロシンやフッ素化ホモフェニルアラニンといった化合物も生成可能であることを示した。直接発酵の検討では、フェニルアラニン生合成系を強化することで、グルコースなど安価な原料のみからHphを生産できることを実証できた。実生産の観点からはもの足りない生産性ではあるが、直接発酵の可能性を示すことができたのは大きな成果であったと言える。
一方、最近、カリフォルニア大のJames C. Liaoらのグループにより大腸菌由来のグルタミン酸デヒドロゲナーゼ (Gdh) の基質特異性を改変し、2-OPBAからHphを生産したという論文が報告された11)。この改変型Gdhのメリットは、NH3とNADPHを用いて還元的アミノ化反応を触媒するが、生体内ではNADPH/NADP+比率が高いので、ほぼ不可逆的にHphを生成させることができる点にある。このことは、改変型Gdhが発酵法に適した性質を備えていると言える。我々が開発したHph生産システムと酵素改変によって創出されたGdhを組み合わせることにより、Hphのより効率的な生産や様々な芳香族ホモアミノ酸の生産が可能になると期待される。
文献
1) Brown, N. J., Vaughan, D. E.: Circulation. 97, 1411 (1998).
2) Kuhn, D. J., Chen, Q., Voorhees, P. M., Strader, J. S., Shenk, K. D., Sun, C. M., Demo, S. D., Bennett, M. K., van Leeuwen, F. W. B., Chanan-Khan, A. A., Orlowski, R. Z.: Blood. 110, 3281 (2007).
3) Ahmad, A. L., Oh, P. C., Shukor, S. R. A.: Biotechnol. Adv., 27, 286 (2009).
4) Chen, S. T., Tseng, M. J., Kao, T., Sookkheo, B., Surat, T.: US Patent 6,146,859 (2000).
5) Asano, Y., Yamada, A., Kato, Y., Yamaguchi, K., Hibino, Y., Hirai, K., Kondo, K.: J. Org. Chem., 55, 5567 (1990).
6) Kao, C. H., Lo, H. H., Hsu, S. K., Hsu, W. H.: J. Biotechnol., 134, 231 (2008).
7) Mitsuhashi, S.: Curr. Opin. Biotechnol., 26, 38 (2014).
8) Rouhiainen, L., Jokela, J., Fewer, D. P., Urmann, M., Sivonen, K.: Chem. Biol., 17, 265 (2010).
9) Koketsu, K., Mitsuhashi, S., Tabata, K.: Appl. Environ. Microbiol., 79, 2201 (2013).
10) Koon, N., Squire, C. J., Baker, E. N.: Proc. Natl. Acad. Sci. USA, 100, 6992 (2003).
11) Li, H., Liao, J. C.: ACS Synth. Biol., 3, 13 (2014).