【トピックス】
細胞への一酸化炭素ガス分子放出を指向した蛋白質集合体の機能化
藤田健太、上野隆史
東工大院・生命理工
1.はじめに
細胞内では、様々な酵素によって触媒される化学反応により生成される化学物質がシグナルとなり、細胞内での種々の反応が進行することとなる。近年それらの化学反応を触媒する酵素のうち、ガス分子を産生する機能を有する酵素が注目されている。代表的な生体ガス分子としては、一酸化窒素 (NO)、一酸化炭素 (CO)、硫化水素 (H2S) が知られており、それぞれの合成には一酸化窒素合成酵素 (NOS)、ヘムオキシゲナーゼ (HO)、シスタチオニンβ合成酵素 (CBS) が関与している1)。 これらの酵素は細胞内において特定の小器官上に存在しており、局所的に低濃度のガス分子を必要量放出することによって、細胞保護作用や細胞増殖作用などの効果を産み出している。特に、HOによる反応では、細胞内の遊離ヘムが分解され、COと鉄イオン、ビリベルジンの三種類のシグナル分子を一度に産生し、それぞれが異なる作用を及ぼす可能性が示唆されているため、非常に注目を集めている (図1)。
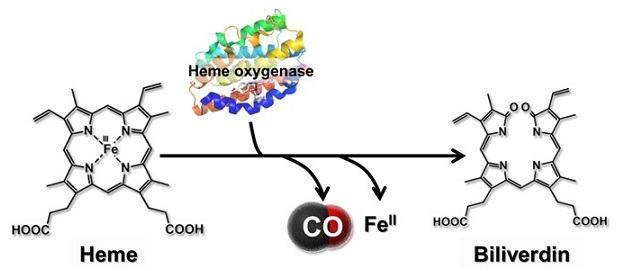
図1 ヘムオキシゲナーゼによるヘム分解反応機構
COは血中のヘモグロビンに含まれるヘム鉄への結合力が、O2のおよそ250倍も強く、その酸素運搬能を抑制し、生体に対して毒性のある分子として認識されてきた。一方で、pM程度の非常に低い濃度では、細胞内シグナル伝達分子として機能することも確認されている。ガスクロマトグラフィーやイメージングプローブを用いてCOの量や動態を明らかにする試みがなされているものの、細胞内でのそれらの情報を議論することは困難である。そのため、細胞外からCOを送り込むことによって、COの機能を解明する試みが2000年頃から進められており、ガス分子の溶液中での拡散を制御し、望みの濃度でCOを輸送するために金属カルボニル錯体が利用されてきた2,3)。金属カルボニル錯体を細胞内に導入することで、細胞内部のシステインやグルタチオンといった反応性の高い分子との配位子交換反応を介し、COを放出させることが可能である。このCO放出性のカルボニル錯体は、CO放出分子 (carbon monoxide releasing molecules: CORMs) と呼ばれ、これまでにin vitroの系だけではなく、in vivoの系でも利用されている。しかし、CORMs単体では細胞内での安定性が低く、取り込み効率も低いため、それらを改善するためのキャリア分子の開発が必要とされていた。
2.かご型蛋白質をキャリアとした細胞内CO輸送
2-1 かご型蛋白質フェリチン
そこで本研究では、キャリア分子として新たに24量体のかご型蛋白質集合体である、フェリチン (Ferritin, Fr) の利用を試みた4)。 Frは天然において細胞内の鉄貯蔵の役割を担っており、金属保持能力と細胞内での安定性が特徴的な分子である。以前我々の研究グループで報告してきたように、Frの内部空間へは種々の有機金属錯体を集積させることが可能である。また、Fr自身が細胞表面の特異的なレセプターを介してエンドサイトーシス経路で細胞内へ取り込まれることから、CORMsのキャリアとして適していると考えた5-8)。
2-2 フェリチンへのルテニウム=カルボニル錯体の結合
2-2-1 野生型アポフェリチン (apo-WT-Fr) への錯体の導入
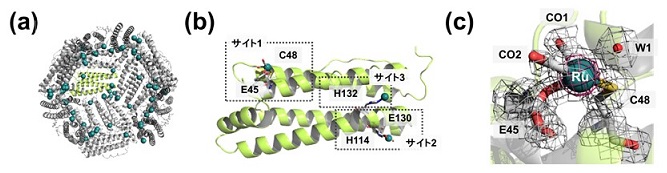
pH8のトリス緩衝溶液中で、[Ru(CO)3Cl2]2錯体とapo-WT-Frを反応させ、サイズ分離カラムを用いて精製することによって、RuCO・apo-WT-Fr (複合体1) を合成した。この複合体1をハンギングドロップ法により結晶化させ、2.00 Åの分解能でX線回折像を得た。全体構造から、Frの内部に複数のルテニウム (Ru) 原子の結合を確認した (図2a)。さらに、単量体においては、3つのRu結合サイトが確認された (図2b)。これらのうち、サイト1 (Ru1) では、他のサイトと比較して、Ru由来のより占有率の高い電子密度が観測された。Ru1はE45のカルボキシレートとC48のチオラートに結合しており、さらに他の配位サイトを埋めるように、水分子 (W1) と二つのCO配位子 (CO1、CO2) の結合も確認できた (図2c)。次に、Glu-Ru-Cysの構造を変換することによって、COの放出性を変化させることを目指し、apo-Frの変異体を作製した。

2-2-2 変異導入フェリチンの設計と錯体配位構造の変化の確認
図2に示したapo-WT-Frの構造を元に、二つのapo-Fr変異体を作製した。一つはE45をCysに、C48をAlaに置換したapo-E45C/C48A-Frであり、もう一つはR52をCysに置換したR52C変異体である。これら二種類の変異型蛋白質をWTと同様に[Ru(CO)3Cl2]2錯体と反応させ、X線結晶構造を解明した。図3にそれぞれ1.92、1.82 Åの分解能で得られたX線結晶構造を示す。これらの結果より、apo-E45C/C48A-Fr変異体との複合体2では新たにCys-Ru-His結合が、apo-R52C-Fr変異体を用いて合成した複合体3では、Cys-Ru-Cys結合が形成されていることが分かった。このように、設計した位置でアミノ酸置換を行うことによって、その配位構造を制御することが可能であり、合計で三種類のRuCO・apo-Fr複合体を作製することに成功した。
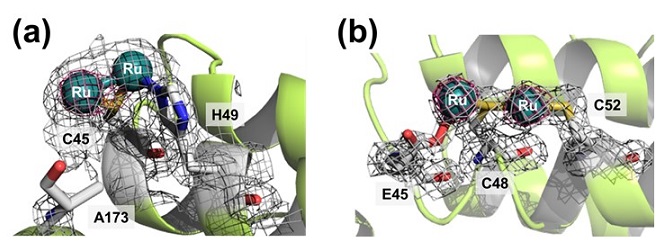
図3 複合体2及び3の結晶構造
2-3 ルテニウム=カルボニル錯体・フェリチン (RuCO・apo-Fr) 複合体の機能評価
2-3-1 CO放出特性
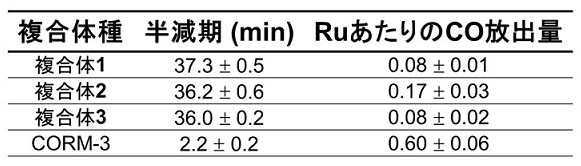
複合体からのCOガスの放出量及び半減期は、還元型ミオグロビンへのCO結合反応を紫外可視吸光測定により追跡することで算出した (表1)。この測定結果から、今回合成したRuCO・apo-Fr複合体は、代表的なCORMであるCORM-3錯体よりも18倍ゆっくりとCOを放出することが分かった。これはCO放出のためのリガンド交換反応がFrの分子かごの影響で抑制されているためと考察された。また、複合体2は複合体1、3よりも2倍多くのCOを放出しており、複合体2のCys-Ru-Hisの配位構造の違いが影響しているためと考えられた。
表1 複合体のCO放出速度半減期及び放出量
2-3-2 細胞内でのCO放出
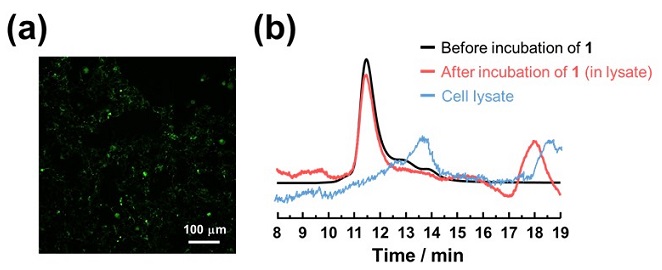
まず、細胞内へ取り込まれた複合体1から細胞内にCOが放出されているかを、CO検出蛍光プローブCO probe-1 (COP-1) を用いて確認した (図4a)。複合体1とCOP-1をHEK293細胞 (ヒト胎児腎細胞) へ導入し、共焦点顕微鏡によって観察したところ、複合体1を添加した細胞から、COP-1とCOが反応した際に発生する緑色の蛍光が確認された (図4a)。次に、細胞へ取り込まれたFrのかご型構造が細胞内で維持されているかについて高速液体クロマトグラフィー (HPLC) を用いた分析によって確認した (図4b)。複合体1を取り込ませた細胞を12時間インキュベートし、細胞を破砕後、ライセートの回収操作で細胞抽出物を調製した。HPLCで本細胞ライセートの分析を行ったところ、細胞ライセート中にapo-Frの24量体かご型構造に由来する11.5分に位置するピークを検出することができた (図4b)。細胞ライセート溶液中からも同じ位置にピークが確認できたことから、複合体1は細胞内でその構造をしっかりと保持していると推測された。
![]()
2-3-3 細胞内複合体による転写因子活性化
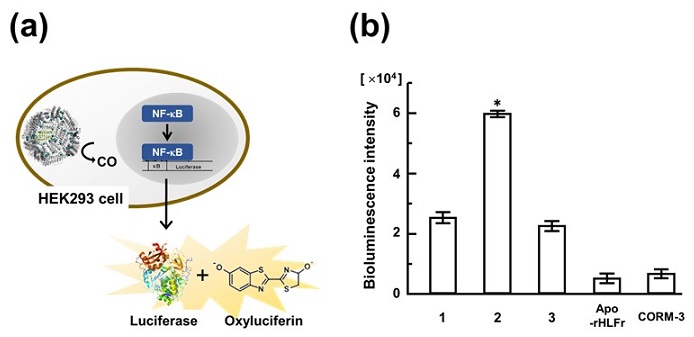
最後に、細胞内の核転写因子Nuclear factor-κB(NF-κB) の活性に与える影響の評価を行った。NF-κBは、細胞内の約500種類もの蛋白質発現に関与しており、細胞保護に大きく寄与している。NF-κBの活性評価を行うために、ルシフェラーゼ発現系を導入したHEK293細胞に、対象複合体を12時間インキュベートした後に基質となるルシフェリンを加え、各細胞からの発光を測定した (図5a)。この評価系では、NF-κBがより活性化されている場合にはより強い発光が得られる。この発光測定の結果、複合体1および3はCORM-3、apo-Frのみと比較して、2.5倍NF-κBを活性化していることが分かった。また、CO放出量の多い複合体2ではさらに複合体1或いは3の場合に比して4倍の活性化が確認された (図5b)。つまり、CO放出速度が遅く、より多くのCOを細胞内へ送り込むことでNF-κBの活性化が促進されることを、今回合成した複合体を用いることによって、はじめて明らかにすることができた。
![]()
3.おわりに
今回の研究では、COの細胞機能として、NF-κBの転写因子としての活性への影響を評価したが、その詳細なシグナル伝達機構は分かっていない。現在、我々のグループで、COを放出するタイミングや量を外部刺激によって制御可能な分子の合成を進めており、種々の生化学的な実験手法を駆使して、細胞内のCOシグナルの道筋を解き明かしたいと考えている。
我々のグループでは、上述したFrを基盤としたCO輸送法以外にも、蛋白質結晶をカルボニル錯体内包のテンプレートとして利用したCO輸送についても報告している9,10)。
また、本稿で述べたガスバイオロジーと呼ばれる分野での酵素工学的な研究対象としては、HOの機能解明が挙げられる。近年、HOのヘム分解機構が少しずつ明らかにされているが、HOには主に、HO-1、HO-2、HO-3の三種類のアイソザイムが存在し、また、生物種によってもその構造や反応性が異なるため、なぜHOによってCOが作り出されるのか、酵素の機能解明という観点からも研究が進んでいくものと期待される。
謝辞
本研究は東京工業大学大学院生命理工学研究科の近藤研究室との共同研究との成果である。また、これらの研究は、内閣府の最先端・次世代研究開発支援プログラム (課題番号LR019) からの研究助成のもと行われた。蛋白質結晶のX線回折データはSpring-8ビームラインBL38B1 (課題番号2013B1262、 2013B1382) 及び、名古屋大学超強力X線回折実験室を用いて行われた測定で取得した。共同研究者の皆様に深く御礼申し上げたい。
文献
1) Kajimura, M., Fukuda, R., Bateman, R. M., Yamamoto, T., Suematsu, M.: Antioxi. & Redox Signaling, 13, 157 (2010).
2) Motterlini, R., Otterbein, L. E.: Nat. Rev. Drug Discov., 9, 728 (2010).
3) Romao, C. C., Blattler, W. A., Seixas, J. D., Bernardes, G. J.: Chem. Soc. Rev., 41, 3571 (2012).
4) Fujita, K., Tanaka, Y., Sho, T., Ozeki, S., Abe, S., Hikage, T., Kuchimaru, T., Kizaka-Kondoh, S., Ueno, T.: J. Am. Chem. Soc., 136, 16902 (2014).
5) Maity, B., Fujita, K., Ueno, T.: Curr. Opin. Chem. Biol., 25C, 88 (2015).
6) Abe, S., Niemeyer, J., Abe, M., Takezawa, Y., Ueno, T., Hikage, T., Erker, G., Watanabe, Y.: J. Am. Chem. Soc., 130, 10512 (2008).
7) Abe, S., Hirata, K., Ueno, T., Morino, K., Shimizu, N., Yamamoto, M., Tanaka, M., Yashima, E., Watanabe, Y.: J. Am. Chem. Soc., 131, 6958 (2009).
8) Liu, X., Wei, W., Wang, C., Yue, H., Ma, D., Zhu, C., Ma, G., Du, Y.: J. Mater. Chem., 21, 7105 (2011).
9) Tabe, H., Fujita, K., Abe, S., Tsujimoto, M., Kuchimaru, T. , Kizaka-Kondoh, S., Takano, M., Kitagawa, S., Ueno, T.: Inorg. Chem., 54, 215 (2014).
10) Tabe, H., Shimoi, T., Fujita, K., Abe, S., Ijiri, H., Tsujimoto, M., Kuchimaru, T., Kizaka-Kondo, S., Mori, H., Kitagawa, S., Ueno, T.: Chem. Lett., 44, 342 (2015).