【トピックス】
Dock tag−セルロソームを利用した新しい蛋白質精製タグシステムの開発
亀崎佳子、比嘉 (石川) 友紀子、榎本知晃、鈴木健夫、粟冠和郎
1.はじめに
現在様々な組換え蛋白質生産系が利用されているが、生産した組換え蛋白質を効率よく精製するために精製タグの利用はきわめて有用であり、分子生物学や分子免疫学、構造生物学、蛋白質工学などの研究をはじめ、蛋白質性医薬品の製造など、工業的にも広く利用されるようになってきている。現在までに様々な種類のタグ精製システムが考案されているが、従来の精製タグには精製過程で目的蛋白質が失活したり、充分な精製度や回収量が得られないといった問題も少なからず存在する。そのため、蛋白質が失活しない温和な条件で精製でき、なおかつ高い精製度の蛋白質が高収率で得られるような新しい精製タグの開発が期待されている。我々は、セルロース分解性嫌気性細菌がセルロースを効率よく分解するために形成する「セルロソーム」に含まれる蛋白質ドメインを活用することによって新しい精製タグシステムを開発し、本タグ精製システムを「Dock tag精製システム」と命名した1)。本稿ではこの新しい精製システムのいくつかの優れた特徴と、モデル蛋白質を用いた精製実績について紹介したい。
2.Dock tag精製システムの概要
クロストリジウム属細菌のようないくつかの嫌気性微生物は、セルロースを効率よく分解するためにセルロソームと呼ばれる複合体を形成する。セルロソームは、複数のコヘシンドメインを含むスキャフォールディング蛋白質と、ドックリンドメインを含む触媒サブユニット (セルラーゼ等の酵素) で主に構成される2-5)。酵素のドックリンドメインとスキャフォールド蛋白質のコヘシンドメインはCa2+存在下で互いに強く結合し、セルラーゼ複合体を形成する。セルラーゼ複合体は、8M尿素による処理によっても完全には解離されないほどの安定した構造体である6)。
我々が本研究で用いたClostridium josuiのスキャフォールディング蛋白質であるCellulosome-integrating protein A (CipA) は、N末端側にセルロース結合ドメイン及び親水性ドメインを有し、C端側に6つのコヘシンドメインを有する。また、C末端にドックリンドメインを含むC.josui由来のセルラーゼCel8Aは、Ca2+存在下で各々のコヘシンドメインに10-9〜10-10オーダーの解離定数 (KD) で、きわめて強く結合する7)。我々は、このCel8A由来のドックリンドメインとCipA由来のコヘシンドメインの高い親和性を利用し、組換え蛋白質の精製タグへの応用を考えた。Dock tag精製システムの原理を図1に示す。コヘシンドメインを固定化した担体を作製し、これにドックリンドメインを融合して発現した組換え蛋白質を含む蛋白質溶液 (粗抽出物) を添加し (Step 1)、Ca2+存在下でタグ融合蛋白質を吸着する。緩衝液でカラム担体を洗浄後 (Step 2)、キレート剤を含む緩衝液で溶出する (Step 3) ことで、目的蛋白質を高純度に精製する。我々は、この精製システムの実用性の向上を図るため、目的蛋白質の溶出効率の改善に取り組んだ。
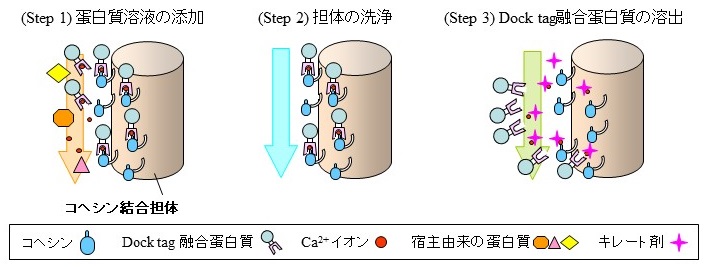
図1 Dock tag精製システム
3.Dock tag精製システムの実用化開発
最初に、C.josuiのCipAの全長 (6種類のコヘシンドメインが連結) をカイコ-バキュロウイルス生産系で発現し、これを担体に固定化した精製システムを構築して性能を評価した。しかしながら精製システムとしては機能するものの、コヘシンドメイン間の相互干渉などが原因か、充分な性能が得られなかった。そこでC.josui のCipAから6種類のコヘシンドメイン (Coh1〜Coh6) をそれぞれ個別にクローニングし、精製に最適なコヘシンドメインの探索を行った。カイコ‐バキュロウイルス発現系で各コヘシンドメインを生産し、Cel8A由来の野生型ドックリンドメインとの相互作用を解析したところ、6種類の単一コヘシンドメインは、いずれもほぼ同等の親和性を示した。そこで実際に各コヘシンドメインを担体に固相化して精製試験を行った結果、Coh2担体を用いたとき最も多くのドックリン融合蛋白質が回収されたことから、コヘシン担体作製にはCoh2を採用した (図2)。
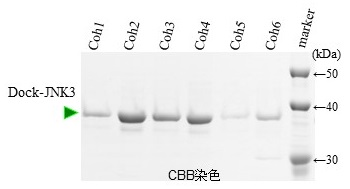
図2 コヘシンドメインの選定
一方、野生型のCel8Aのドックリンドメインを用いて作製した精製タグシステムでは、目的蛋白質をキレート剤で溶出する際に低温下では6時間以上を要することが判明し、実用上の大きな問題があった。ドックリンは2つのサブドメインで構成されるが、各サブドメインのCa2+結合サイトの近傍にある11番目と12番目のアミノ酸 (第1サブドメイン)、及び44番目と45番目のアミノ酸 (第2サブドメイン) は、同種間では保存されているが菌種間ではバラエティーがあり、この領域がドックリンドメインとコヘシンドメインの相互作用の強さに影響していると考えられている7)。そこでドックリン融合蛋白質の溶出効率を向上させるべく、ドックリンの各サブドメインの11番目と12番目、44番目と45番目のアミノ酸に様々な変異を導入した。そして、そのうち効果の高かった45位のアミノ酸変異4種類に絞り込み、コヘシンドメイン (Coh2) との相互作用解析を実施した。その結果、45位のイソロイシン (I) をグリシン (G) ,スレオニン (T)、バリン (V)、アスパラギン (N) に置換することで、結合速度 (ka) に影響することなく解離速度 (kd) が大幅に上昇するという現象を見出した。なかでもI45G変異型ドックリンでは、野生型に比べて約200倍大きい解離定数 (KD) を持つことが分かった (図3)。

図3 ドックリンドメインのアミノ酸変異と相互作用解析
すなわち、野生型のドックリンドメインを精製タグとして使用した場合、4℃の低温条件下で6時間以上かかっていた溶出時間が、I45G変異型ドックリンを精製タグとすることで、4℃で5分から1時間の溶出時間で十分に蛋白質を回収でき、溶出効率が大幅に改善された。さらに得られた目的蛋白質の純度は90%以上であった (図4)。
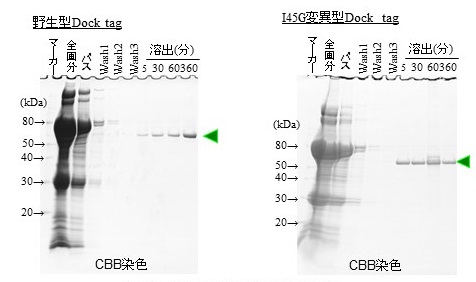
図4 溶出効率の評価試験
4.Dock tag精製システムの特徴
Dock tag精製システムでは、一度のアフィニティーカラム精製で、高純度の目的蛋白質の精製が可能である。
一般的なアフィニティータグ精製システムであるHis tagとDock tagで、2種類の精製蛋白質を比較した結果、His tag精製品よりDock tag精製品の夾雑蛋白質が少なく、高純度の目的蛋白質を得ることができた (図5)。His tag精製システムの場合、目的蛋白質に融合したHis tagだけでなく、His tagと類似した配列を持つ他の蛋白質や、結合担体に使用している金属イオンと非特異的に結合する蛋白質が混入しやすい (特に後者の例として金属プロテアーゼが混入することがあり、目的蛋白質を分解する恐れがある)。一方、Dock tagの場合、コヘシンと特異的に結合するドックリンドメインを持つ蛋白質を有するのは一部の細菌に限られているため、夾雑蛋白質の混入を抑制することができる。また、カイコ発現系だけでなく、一般的によく利用される大腸菌発現系で、Dock tagとCBP tag (ドックリンと同様にキレート剤で溶出するカルモジュリン結合蛋白質 (CBP) を精製タグとして使用するシステム) を比較したところ、溶出効率、目的蛋白質の純度のいずれもDock tagが優位であった (図6)。
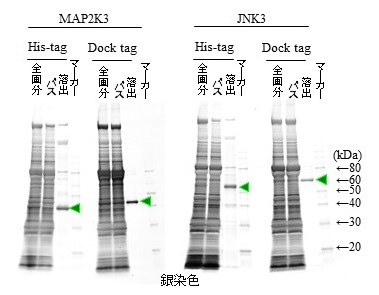
図5 カイコ発現系でのHis tagとの比較
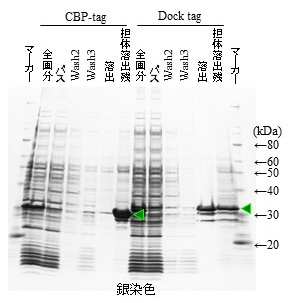
図6 大腸菌発現系でのCBP tagとの比較
また、Dock tagは、キレート剤によるマイルドな中性条件下で速やかに溶出可能であり、溶出過程での目的蛋白質の変性等を最小限に抑えられる (ただし、活性発現に金属イオンを必要とする蛋白質では注意を要する)。また、各種の界面活性剤の存在下においてもタグとして機能し、膜蛋白質などの精製においても有効であることを確認している。一方、Dock tagは約7 kDaの分子量を持つ比較的大きなタグであるため、立体障害の原因となることや結晶性への影響も危惧され、タグを切断して除去する工程を経る必要がある場合も想定される。そこでトロンビン切断サイトを利用したタグ除去について、数種のDock tag融合蛋白質を用いた検討を行った。その結果、22℃、30分間トロンビンで切断処理することで速やかにタグ切断が可能なことが示された (図7)。
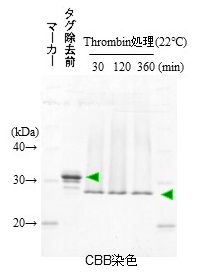
図7 トロンビン処理によるDock tag除去
さらに、Dock tag融合型のままでも目的蛋白質が活性を保持しているかを確認した。Dock tagまたはStrepII tagをC末側に融合した5種類のキナーゼを目的蛋白質として用い、反応基質としてミエリン塩基性蛋白質を、リン酸基供給源としてATPを含んだ反応液中でリン酸化反応を行った。反応後の溶液をSDS-PAGEで分離して、リン酸化したミエリン塩基性蛋白をProQ Diamond リン酸蛋白質蛍光染色 (Invitrogen) にて検出した。その結果、StrepII tag融合型では5種類中3種類のキナーゼで活性が見られ、Dock tag融合型では5種類すべてで活性が認められた (図8)。
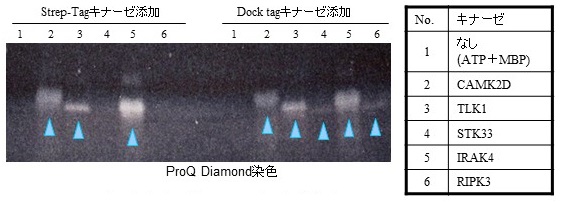
図8 タグ融合型キナーゼの活性確認
3.おわりに
このように、本研究で示した新規の精製方法は、セルロソームというユニークな蛋白質複合体の形成に関わる蛋白質ドメイン間の強固な相互作用を利用したものであり、蛋白質の変性が起きにくい4℃の低温条件で、かつ中性付近の温和なpH条件下で溶出可能であった。また、野生型ドックリンの45位のアミノ酸であるイソロイシンを他のアミノ酸に置換した変異型ドックリン (特にI45G) を精製タグとして用いることにより、溶出効率が大幅に改善された。この結合速度を維持したまま解離速度が向上するドックリン変異体を見出したことが、実用化開発の鍵となった。
またDock tag精製システムは、本稿で示したカイコや昆虫細胞系、大腸菌発現系だけでなく、酵母や動物細胞などの他の蛋白質発現系においても高純度の目的蛋白質が得られる可能性が高いと考えられる。今回我々が開発した実用的な精製タグシステム「Dock tag」は、高精製度の蛋白質をワンステップで変性させることなく容易に精製できるシステムであり、従来の精製タグで認められる多くの課題 (精製度の低さや精製過程での蛋白質の不活性化) を克服するものである。Dock tag精製システムが広く活用され、分子生物学をはじめプロテインエンジニアリング、蛋白質アレイ、医療用蛋白質の供給など様々な研究分野で貢献することを期待する。
文献
1) Kamezaki, Y., Enomoto, C., Ishikawa, Y., Koyama, T., Naya, S., Suzuki, T., Sakka, K.: Protein Expr. Purif., 70, 23 (2010).
2) Felix, C. R., Ljungdahl, L. G.: Annu. Rev. Microbiol., 47, 791 (1993).
3) Carvalho, A. L., Dias, F. M., Prates, J. A., Nagy, T., Gilbert, H. J., Davies, G. J., Ferreira, L. M., Romao, M. J., Fontes, C. M.: Proc. Natl. Acad. Sci. USA., 100, 13809 (2003).
4) Beguin, P., Lemaire, M.: Crit. Rev. Biochem. Mol. Biol., 31, 201 (1996).
5) Ohmiya, K., Sakka, K., Karita, S., Kimura, T.: Biotechnol. Genet. Eng. Rev., 14, 365 (1997).
6) Bayer, E. A., Morag, E., Lamed, R.: Trends Biotechnol., 12, 379 (1994).
7) Jindou, S., Soda, A., Karita, S., Kajino, T., Beguin, P., Wu, J. H., Inagaki, M., Kimura, T., Sakka, K., Ohmiya, K.: J. Biol. Chem., 279, 9867 (2004).