【トピックス】
油糧海洋微生物ラビリンチュラの産業利用
林 雅弘、松田綾子、松田高宜、泉 可也
宮崎大・農、宮崎大・農、株式会社bits、株式会社bits
1.はじめに
海洋性の微生物・微細藻類の中には、ドコサヘキサエン酸 (DHA) やエイコサペンタエン酸 (EPA) などのオメガ3脂肪酸を生産するものや、高度に脂質を蓄積するものがいくつも知られており、食品素材やバイオ燃料など様々な方面から産業利用が検討されている。ラビリンチュラ類は従属栄養性の真核微生物で、科のレベルで2つの分類群が認識され、ラビリンチュラ科に属するラビリンチュリッド (Labyrinthulids) と、ヤブレツボカビ科に属するスラウストキトリッド (Thraustochytrids) に大別される。このうち、スラウストキトリッドの方が増殖性や脂質蓄積性の点から産業利用には適していると考えられ、極域や深海を含む世界中の海域に生息が確認されており、その現存量は沿岸海域で103 cells/L程度のオーダーであることが報告1)されている。中でも亜熱帯から熱帯にわたるマングローブ域にはスラウストキトリッドが豊富に分布することが知られており、これまで数多くの株が分離されている。スラウストキトリッドには、これまで応用面での検討例が多いオーランチオキトリウム (Aurantiochytrium)、シゾキトリウム (Schizochytrium) などの11属が含まれることが最近の分子系統解析2,3)によって示されている。いずれの属のスラウストキトリッドもDHAやEPA、ドコサペンタエン酸 (DPA)、アラキドン酸 (ARA) などの多価不飽和脂肪酸 (PUFA) を細胞内に蓄積し、その高い増殖性や脂質蓄積性からオメガ3脂肪酸4)やカロテノイド5)をはじめとする脂質素材生産を中心に産業利用が各方面で検討されている。なお、本稿で紹介するラビリンチュラは上述のスラウストキトリッドを指す。
2.油糧海洋微生物ラビリンチュラ
筆者の研究室ではこれまでに様々なラビリンチュラを天然海から分離し、現在およそ2500株の菌株ライブラリーを保有しているが、代表的な分離株の培養特性・脂質特性を紹介する。
沖縄県波照間島の沿岸海水から分離したAurantiochytrium limacinum mh0186株 (図1) は高い増殖性と著量のDHAを細胞内に蓄積することを特徴とする分離株である6)。二分裂で増殖するとともに遊走子嚢からの遊走細胞の放出や、アメーバ状の細胞の出現も確認され、18S rRNA遺伝子の塩基配列および形態的特徴から、A. limacinumと同定されている。グルコース、フルクトース、マンノース、ガラクトースなど広い糖資化性を示すが、グリセロール、デンプンは資化しない。また、15%グルコースのような高い糖濃度でも増殖が可能で、グルコースの流加培養で100 g/L以上の高いバイオマス収量を得ることができる。さらに、培養温度については15〜35℃の広い温度帯で良好な増殖を示し、増殖速度は落ちるものの、10℃でも増殖が認められる7)。
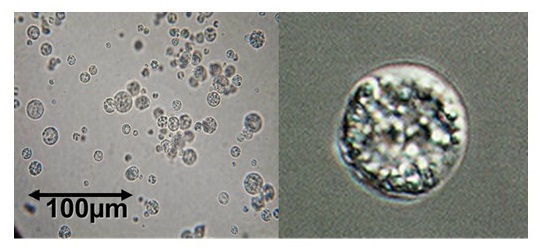
図1 Aurantiochytrium limacinum mh0186株
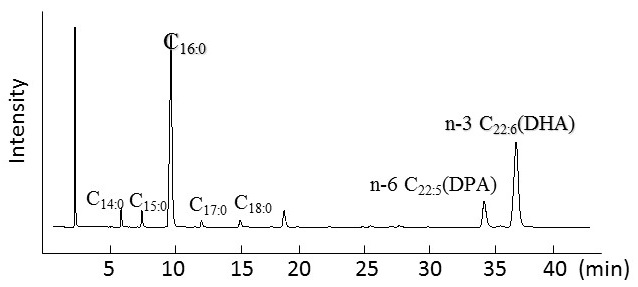
A. limacinum mh0186株の脂肪酸組成 (図2) をみると、培養条件にかかわらず細胞の主要な脂肪酸はパルミチン酸、n-6 DPA、DHAであり、EPAやARA、モノエン酸〜トリエン酸はほとんど含まれない。培養温度が低いほど総脂肪酸中のDHAの割合が高くなる傾向にあり、10℃で培養した細胞では、総脂肪酸中に占めるDHAの割合は70%近くに達する。

A. limacinum mh0186株の細胞脂質は大部分が中性脂質、特にトリグリセリド (TG) であり、培養条件等によって脂質含量が変動する場合はTG量が変動する。そのほか、少量の糖脂質とステロールやスクアレン、細胞重量の数%のグリセロリン脂質を含有し、主要なリン脂質クラスはホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトールなどである。
3.ラビリンチュラによるバイオ燃料生産
ラビリンチュラの多くの株は著量のDHAを細胞内に蓄積することから、DHAをはじめとするPUFAの生産者として注目されてきた。しかしながら最近では、その高い脂質蓄積性を生かして、PUFA以外にも様々な脂質素材に関し、生産への利用が検討されている。
ラビリンチュラがもつステロール類やその前駆体であるスクアレンについても報告があり、特に最近はスクアレンをバイオ燃料として利用する検討が進められている8)。ラビリンチュラの分離株のうち、多くの株が細胞内にスクアレンを蓄積しているがその蓄積量は脂肪酸 (あるいはTG) と比較して少なく、蓄積に比較的時間がかかる株が多いため、ラビリンチュラの高い脂質蓄積性を活かして脂質素材を生産するには、やはり脂肪酸をターゲットとする方が効率が良いように思われる。
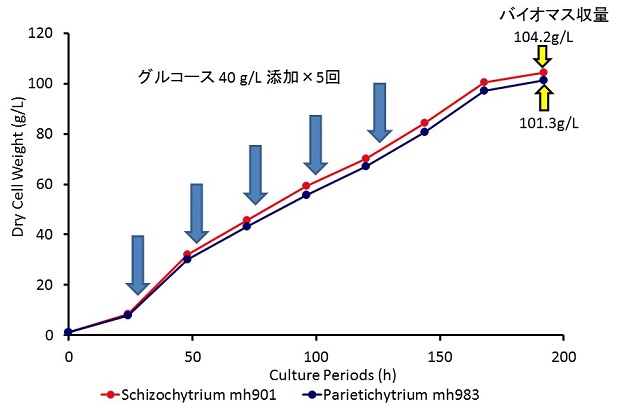
ラビリンチュラによるバイオ燃料生産を考えると、その蓄積性から脂肪酸メチルエステルを成分とするバイオディーゼル燃料 (BDF) 生産が有望であろう。しかし従来注目されてきたDHAのようなPUFAはBDFに不適な脂肪酸であるため、PUFA生産株とは異なる株を分離する必要がある。南西諸島を中心に分離した400株あまりのラビリンチュラの脂肪酸組成をガスクロマトグラフィーで分析して、18S rRNA遺伝子の塩基配列から属レベルの分類を行った結果と合わせてみると、属により脂肪酸組成がずいぶん異なることがわかる (図3)。従来注目されてきたようにAurantiochytrium属の株はDHAやn-6 DPAに富んでおりPUFAの生産には適しているが、BDF生産には適していない。しかしSchizochytrium属、Parietichytrium属の株はパルミチン酸やステアリン酸、オレイン酸などが主要な脂肪酸であり、DHAをはじめとするPUFAは少量しか含まれないためBDF生産に適した脂肪酸組成であるといえる。このような比較的不飽和度の低い脂肪酸組成を持つ分離株の中から、増殖性・脂質蓄積性に優れた株を選抜してグルコースを炭素源として流加培養を行ったところ、100 g/Lを超えるバイオマス収量を得ることができ、脂肪酸の生産性も45 g/Lを超えることができた (図4)。
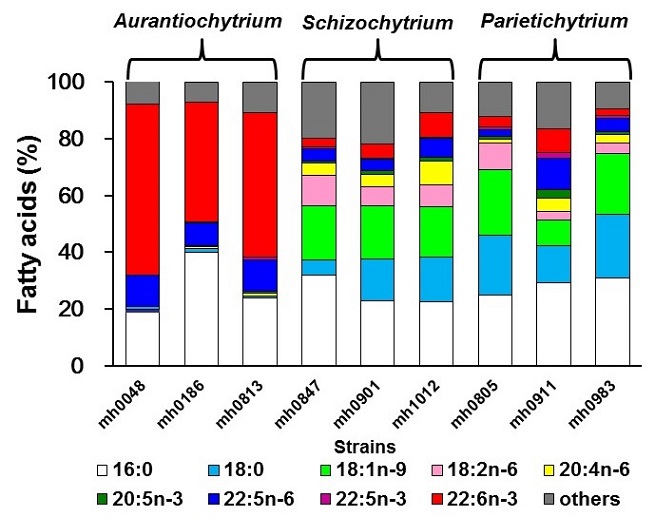
図3 Aurantiochytrium属,Schizochytrium属,Parietichytrium属の脂肪酸組成

脂肪酸組成にかかわらず、ラビリンチュラの細胞内に蓄積する脂質の大部分はTGである。ラビリンチュラの中でも脂質蓄積性の高いA. limacinum mh0186株のドラフトゲノム情報を利用して、TG生合成の最終ステップの酵素であるジアシルグリセロールアシルトランスフェラーゼの遺伝子をクローニングして、別のAurantiochytrium属ラビリンチュラ内で過剰発現させることによって脂質含量の向上が確認されている。ラビリンチュラの分離株のうち脂質蓄積性の高い株では乾燥細胞重量の60%程度の脂質含量を示す株がいるが、これらの株の分子育種によってさらに高い脂質蓄積性を示す株が得られる可能性があり、PUFA生産においても、BDF生産においても、さらなる生産性の向上が期待される。
4.ペントース資化性ラビリンチュラの分離
ラビリンチュラを利用したBDF生産における課題として、ラビリンチュラは従属栄養性であるため、その培養に炭素源として多量の糖質が必要なことがあげられる。バイオエタノールの例を見て分かるとおり、精製糖はもちろんのこと、サトウキビやコーンスターチなどに由来する糖質からのバイオ燃料生産は食糧との競合などが問題視されている。そのため、食糧と競合しないリグノセルロースバイオマス (コーンファイバー、稲わらなど) 由来の糖質 (グルコース、ガラクトース、キシロース、アラビノース) を糖源として利用することが必要である。
リグノセルロースバイオマスの糖化液にはグルコースだけでなく、多くの微生物が利用しにくいキシロースやアラビノースなどのペントース (C5糖) が少なからず含まれている。ラビリンチュラについては、アラビノースを資化できる株が数例報告9,10)されているが、キシロースを資化できる株はUSA特許11)においてキシロースを資化できるように改変した遺伝子組換え株の報告があるのみである。
そこでキシロースまたはアラビノースを唯一の炭素源とする完全合成培地を選択培地として、日本の沿岸域の海水サンプルからペントース資化性株のスクリーニングを試みた。分離源の採集は広島、福岡、長崎、大分、宮崎、鹿児島、沖縄の各県および東京都の沿岸において海水、海砂、海草片、マングローブ落葉を採集した。宮崎県および沖縄県 (石垣島) においては潜水による分離源採集も実施し、海底堆積物、海砂およびサンゴ片を採集した。採集した分離源は採集地の海水とともに50 mLポリプロピレンチューブに入れて持ち帰った。ラビリンチュラの分離には,これまでさまざまな方法が試みられてきたが、松花粉釣餌法12)がよく用いられる。ラビリンチュラの遊走細胞はペクチンなどの多糖類に対する走化性を持つことが知られており13)、この性質を利用して水面に浮かべた松花粉の周囲にラビリンチュラの遊走細胞を選択的に濃縮することができる。海水とともに持ち帰った分離源は、少量の松花粉を投入後、約1週間室温で静置し、松花粉に集まったラビリンチュラの遊走子を周辺の海水とともに寒天プレート上に塗布して、28℃で3日〜1週間程度培養した (図5)。出現したシングルコロニーを同組成の新たな寒天プレートに画線することを繰り返して株を純化し、検鏡によりラビリンチュラであることを確認したのちにスラントに保存した。得られた分離株は2%キシロース+1%酵母エキスで9日間の液体培養を行い、比較的良好な増殖を示した菌体からゲノムDNAを抽出して、18S rRNA遺伝子の配列情報に基づき分子系統解析を行った。また、増殖 (OD660)、残糖量 (4-アミノ安息香酸エチルエステル標識後にHPLC分析) により、候補株の選定を行った。
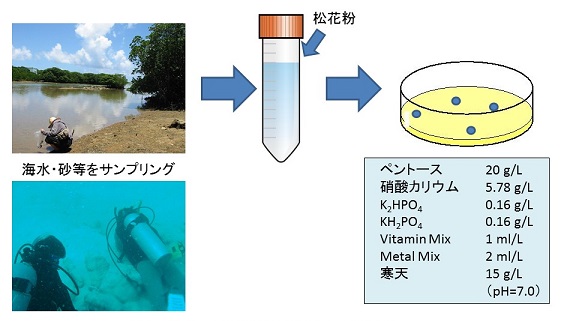
図5 ペントース資化性ラビリンチュラの分離
各地で採集した分離源からペントース資化性株を探索した結果、広島と沖縄から採集した分離源を中心に60株の分離株を得ることができた。そのうち比較的良好な増殖を示した33株について18S rRNA遺伝子の配列情報から分子系統解析を行った結果、全ての株がAurantiochytrium属の株と同定された。分離株はAurantiochytrium属の中では4つの系統群に分かれており、既報の株とはずいぶん異なる系統群も認められた。比較的良好な増殖を示した株の中から、増殖、培養後の残糖量、分子系統的位置関係を参考にして候補株を選定した。
5.スクリーニング株のバイオマス糖化液を用いた培養
候補株のうち、特にペントース資化能と脂肪酸含量が高いmh1882株、mh1912株、mh1913株について、バイオマス (広葉樹クラフトパルプ) 糖化液を用いた培養を2L-ジャーファーメンターを用いて実施した。培養条件を表1に示す。
表1 バイオマス糖液での培養条件

mh1882、mh1912、mh1913各株のバイオマス糖液での培養経過を図6に示す。いずれの株においても、バイオマス糖化液中に含まれるペントースを最終的に100%資化することが確認され、バイオマス糖液に含まれるペントースを完全に資化できるラビリンチュラ株を取得することができた。しかしながら、グルコースが資化されるまでキシロースが資化されない「カタボライトリプレッション」が確認された。また、キシロースはあまり効率的に資化されず、キシロースを完全に資化するにはグルコースの4倍近い日数を必要とした。
今後はカタボライトリプレッションの回避と、より効率的にバイオマス糖液を利用できる株の創生を目指して分離株の分子育種を行っていく。
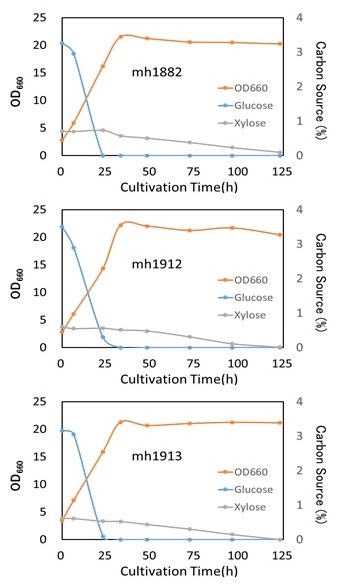
図6 バイオマス糖液での培養経過
6.おわりに
油糧海洋微生物ラビリンチュラの産業利用は、これまでオメガ3脂肪酸やアスタキサンチンなどの機能性脂質素材の生産を中心に検討されてきた。しかしその高い脂質蓄積能が注目され、最近ではバイオ燃料生産についても検討され始めている。バイオ燃料生産といえば微細藻類などの光合成生物による、環境中の二酸化炭素の直接利用技術の開発が主流であるが、培養密度など生産性の高さを考えるとラビリンチュラのような従属栄養生物による植物性バイオマス利用技術も魅力的である。もちろん植物性バイオマスの糖化技術などの課題も残されてはいるが、本稿で紹介したような特殊な能力のある株が今後まだまだ分離され、有効に活用されていくであろう。実際に我々はBDF生産時の副生物としてその利用が懸念されている、高濃度のグリセロールを炭素源として資化可能なラビリンチュラも分離している。この株を利用することで、BDF生産時の副生物を培地原料として利用してBDFに変換することができ、副生物としてグリセロールが一切発生しないBDF生産が可能である。
ラビリンチュラという生物はいずれの株も共通して著量の脂質を細胞内に蓄積するが、炭素源の資化性や生産物などは幅広い多様性が認められ、その産業利用も食品や医薬品、バイオ燃料を含めた各種脂質素材の生産から、排水処理技術や飼料原料としての利用など多様な観点から検討が進められている。今後、多様な性質のラビリンチュラが様々な分野で我々の生活に大きく寄与することを期待する。
謝辞
本研究の一部は新エネルギー・産業技術総合開発機構 (NEDO)「戦略的次世代バイオマスエネルギー利用技術開発事業 (次世代技術開発) 」による支援を受けて行った。
文献
1) Naganuma, T., Takasugi, H., Kimura, H.: Marine Ecology Progress Series, 162, 105-110 (1998).
2) Yokoyama, R., Honda, D.: Mycoscience, 48, 119 (2007).
3) Yokoyama, R., Salleh, B., Honda, D.: Mycoscience, 48, 329 (2007).
4) Yokochi, T., Honda, D., Higashihara, T., Nakahara, T.: Appl. Microbiol. Biotechnol., 49, 72 (1998).
5) Aki, T.: JAOCS, 80, 789 (2003).
6) Nagano, N., Taoka, Y., Honda, D., Hayashi, M.: J. Oleo Sci., 58, 623 (2009).
7) Taoka, Y., Nagano, N., Okita, Y., Izumida, H., Sugimoto, S., Hayashi, M.: Mar. Biotechnol., 11, 368 (2009).
8) Kaya, K., Nakazawa, A., Matsuura, H., Honda, D., Inouye, I., Watanabe, M.: Biosci. Biotechnol. Biochem., 75, 2246 (2011).
9) Harel, M., Ben-Dov, E., Rasoulouniriana, D., Siboni, N., Kramarsky-Winter, E., Loya, Y., Barak, Z., Wiesman, Z., Kushmaro, A.: FEMS Microbiology Ecology, 64, 378 (2008).
10) Hong, W-K., Rairakhwada, D., Seo, P-S., Park, S-Y., Hur, B-K., Kim, C., H., Seo, J-W.: Applied Biochemistry and Biotechnology, 164, 1468 (2011).
11) Lippmeier, J. C., Emilapt, K.: US20110195448.
12) Cloekie, J. P., Dickinson, C. H.: Veroff. Int. Meeresforsch. Bremerh., 13, 195 (1972).
13) Fan, K. W., Vrijmoed, L. L. P., Jones, E. B. G.: Mycologia, 94, 569 (2002).