【トピックス】
次世代がん治療薬を目指した低分子二重特異性抗体の開発と高機能化
浅野竜太郎、熊谷 泉
東京農工大院・工、東北大院・工
1.はじめに
抗体分子は、その高い特異性と親和性から分子標的薬としての期待も大きく、市場が拡大し続けているバイオ医薬品の中でも中心的な存在となっている。しかしながら、米国食品医薬品局 (Food and Drug Administration, FDA) での認可数は2013年末には35件を超える一方で、年ごとの認可数をみてみると最大4件に留まっていて、必ずしも急伸しているとはいえない1)。薬価の高さは以前より問題となっており、高分子量のタンパク質の製造には通常高コストの動物細胞が用いられることに起因しているが、培養技術の進歩により必ずしも深刻な状況とはいえない。むしろ特にがん治療においては、劇的な奏功がみられることもあるが、根治となると容易には達成できていないことが問題となっている。抗体医薬が高い薬効を示す新たな標的分子の探索もまた困難であり、開発リスクの軽減のため、特徴がよく分っている分子や、標的とする抗体医薬が既に上市されている分子に開発が集中しているが、この場合、新たな承認には先行薬に対する優位性を示す必要がある。このため現在、薬効の向上を目指した高機能化や組換え技術を駆使した次世代型の抗体の開発が広く進められている。本稿では、主に組換え技術によって創出される、2つの異なる特異性を有する二重特異性抗体を中心に、我々の取り組みを含めて概説する。
2.非天然型抗体
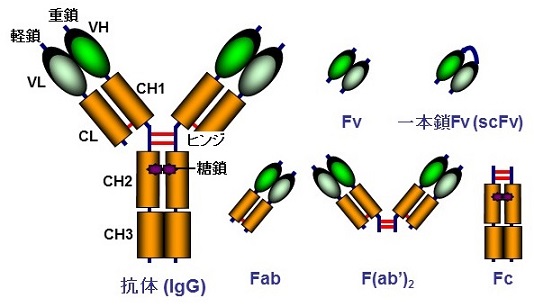
抗体分子の天然構造を維持した高機能化としては、ある種の毒素や放射性同位体の融合・結合が挙げられ、FDAで5件、内2件は比較的近年認可されている。一方、抗体をいったん断片に切り分けた後、他の機能性タンパク質や由来の異なる抗体断片同士を種々に組み合わせることで、多種多様な非天然型の高機能な組換え抗体を創出することができる。汎用的に用いられている抗体 (IgG) と、その機能性断片の模式図を図1に示すが、抗体を構成するすべてのドメインが切り分けられても原則機能することが多彩なデザインを可能としてきた。抗体の結合能は、先端のVHとVLによって構成される可変領域断片 (Fragment of variable region, Fv) が担っている。非共有結合性の会合であるVHとVL間の解離を防ぐために人工のペプチドリンカーで連結させた一本鎖Fv (single-chain Fv, scFv) や、分子量は大きくなるもののCH1とCL間のジスルフィド結合により安定化されている抗原結合性断片 (Fragment antigen binding, Fab) 、更にはFabを2つ含むため二重特異性抗体の作製も可能なF (ab’)2なども用途に応じて使われている。結合特異性はないものの結晶性断片 (Fragment crystallizable, Fc) も、特に抗がん抗体医薬の主要な作業機序である抗体依存性細胞傷害 (Antibody-Dependent Cell-mediated Cytotoxicity, ADCC) 活性などのエフェクター機能の誘導や長い血中半減期に関与するため、やはり重要な機能性断片といえる。古くは主としてマウスハイブリドーマから抗体を得ていたため、ヒトにおける抗原性の低減と微生物を用いた安価な製造を目的に低分子形態の設計が好まれたが、ヒト由来の抗体断片も容易に扱えるようになり、また発現系の違いによる製造コストの差が縮まったことから、より高機能な高分子形態の設計も積極的に行われるようになった2-4)。図2に一例を示す。様々なデザインの方向性があるが、例えば上述の天然型抗体にみられた機能性分子との融合、結合親和性の向上を目指した多価化、二重特異性抗体をはじめとする複数の特異性の付与を目指した多重特異性化、またそれぞれの組み合わせなど枚挙にいとまがない。
![]()
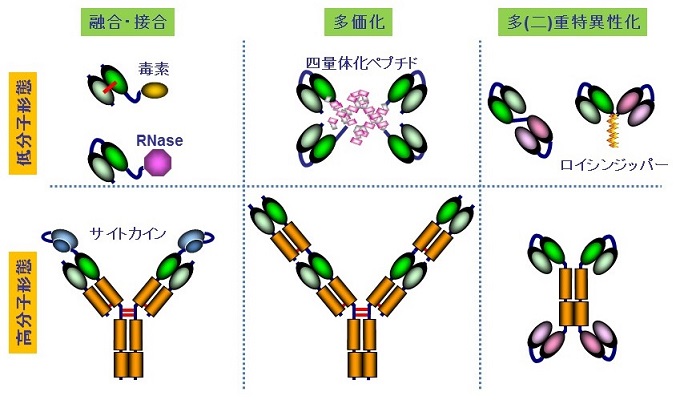
図2 非天然型組換え抗体の例
3.二重特異性抗体とがん治療
二重特異性抗体が有する2つの異なる特異性は、異分子間の架橋を可能とさせるため、バイオセンシングやマテリアルの分野での応用も進められているが、歴史的には医用、なかでもやはり根治困難ながんに対する治療薬としての開発に大きな期待が寄せられてきた。薬物等の送達を目指す場合、一方にがん細胞に特異的な抗体、もう一方に薬剤や放射性物質、あるいは細胞傷害活性を有する毒素、酵素、ウイルスなどに特異的な抗体が用いられる。間接的ではあるが、がんの増殖に伴う血管新生の阻害もひとつの治療戦略であり、二重特異性抗体を用いることで複数の血管新生因子の同時阻害が可能となる。二重特異性抗体の概念やこれらのがん治療を目指した戦略の起源は古いが、中でも、がん細胞とリンパ球間の架橋を狙ったデザインの歴史は長い。結合によりリンパ球の活性化を促す、いわゆるアゴニスト抗体を用いることで、より効果を高めることが期待され、またリンパ球を介したがん治療は,免疫記憶による永続的な拒絶、即ち根治治療の可能性も秘めている。詳細は他の総説等をご参照頂きたいが簡単にまとめれば、開発当初は天然型の二重特異性抗体を調製する際に生じる副産物をいかに低減させるかが課題であったが、組換え技術の台頭により、均一な調製はもとより、いっそう強力な抗腫瘍効果が期待できるデザインも数多く報告されるようになった。
4.低分子二重特異性抗体diabodyの開発と高機能化
我々も新規がん治療抗体の開発を目的に、非天然型の組換え抗体の開発に従事してきたが、中でもがん細胞とリンパ球を標的とした二重特異性抗体、特にその形態としてFvのみで構成され、微生物での調製も可能なdiabody型 (図3a) に着目し研究を進めてきた。様々な抗がん関連抗原抗体、および抗リンパ球表面抗原抗体とを組み合わせて各種diabodyを作製、機能評価を行った結果、ヒト上皮増殖因子受容体 (Epidermal Growth Factor Receptor, EGFR) とTリンパ球上のCD3を標的としたEx3と名付けた分子に最も強力な抗腫瘍効果がみられた (図3a)5)。Ex3は、極力ヒト由来の配列に近づけるためのヒト型化にも成功したが6)、我々はこのEx3をリード化合物と捉え、より付加価値の高い医薬品化を目指して、ヒトFc領域との融合、構造形態の改変、多量体化、高親和性化、更にはこれらの複合の観点からそれぞれ高機能化を進めた。
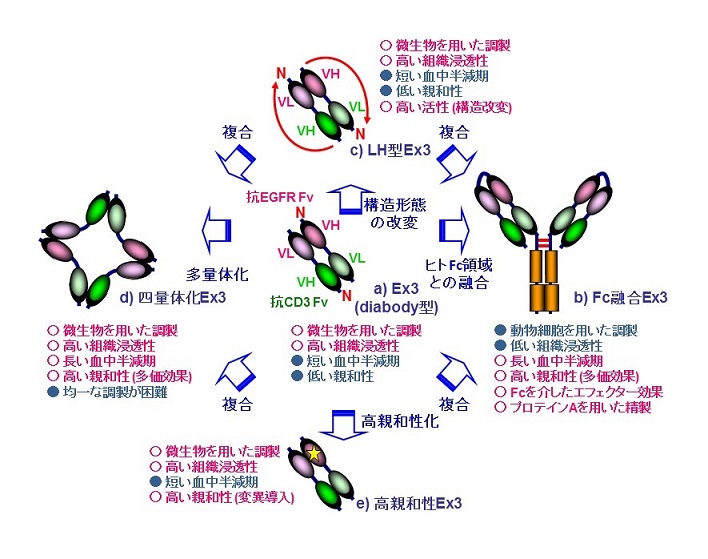
図3 diabody型二重特異性抗体の高機能化
4-1 ヒトFc領域との融合
ヒトFc領域との融合は、前述の利点に加えて、プロテインAを用いたアフィニティー精製も可能となるため、免疫原性が懸念される精製用のペプチドタグを付加させる必要がなくなる。またFc領域がホモ二量体であることから融合分子も通常2分子となるため多価化も達成される。VH-VL間が解離しないように一本鎖化させたのちFcを融合させたEx3 (図3b) は、両標的細胞に対する親和性の向上が観察され、また融合させたFc領域の機能を評価するために、末梢血リンパ球の増殖試験を行ったところ、Ex3にはみられない増殖効果を示した。Ex3を2分子含むことで、期待通り多価での結合能、およびFc領域を介したエフェクター効果が付与され、これらが寄与したと考えられるがん細胞傷害活性の増強が観察された7)。
4-2 構造形態の改変
ヒトFc領域との融合により、Ex3の活性を向上させることに成功したため、続いて、Ex3自体の構造形態の改変による機能の向上を目指した。これまでにdiabody型以外にも、様々な低分子二重特異性抗体の形態が報告されているが、diabody型に限っても、ドメインの連結順を変えることで4種類の配向性が考えられる。これらすべてを調製し、機能評価を行ったところ、いずれも活性の向上を示し、特に両VLドメインをN末端に配置したLH型 (図3c) と名付けた形態は、Fc融合Ex3と同等の効果を示した8)。この活性の違いを親和性の観点から議論するために結合活性評価を行ったが、Ex3に比べ大差はなく細胞傷害活性との相関はみられなかった。そこで、標的細胞と蛍光標識した抗原間の架橋能をフローサイトメトリーを用いて評価したところ、優位な架橋形成がLH型にみられた。まだ詳細は明らかにしていないが、細胞間を架橋する際には可溶性の抗原間の架橋能評価では外挿できない、細胞表面ならではの他の受容体等との立体障害が存在し、これらを回避できる柔軟な構造を有する形態がより強い活性を示したと考えている。
4-3 多量体化
抗体の多量体化は、分子量の増加に伴う体内半減期の延長と併せて、多価化による親和性の向上がもたらす機能の向上が見込まれる。Ex3のゲル濾過を行うと、目的のdiabody画分よりも高分子量側に少量ではあるが明確な溶出ピークが現れ、我々はこの画分の分子種がより強力な細胞傷害活性を有していることを見出した9)。そこで動的光散乱法、静的光散乱法、および等温滴定型熱量測定により、粒子径、分子量、結合の化学量論比をそれぞれ測定した結果、Ex3が環状に四量体化した構造を示唆する結果が得られた (図3d) 。またFc融合Ex3と同様に結合価数の増加に伴う、主に解離速度の低下が寄与する親和性の向上が四量体分子にもみられた。Fc領域がもたらす種々のエフェクター機能は、副作用を懸念する声もあるため、多価効果のみを示す四量体化Ex3は有望なシーズのひとつであるが、実用化に向けては如何に均一に調製できるかが鍵であり、現状では達成できていない。
4-4 高親和性化
構造形態の改変による高機能化においては、必ずしも細胞傷害活性と親和性には相関がみられなかった。しかし、いったん高機能な構造が決まれば、親和性を向上させることによる更なる高機能化が十分期待できる (図3e)。Ex3はヒト型化の際、抗EGFR抗体に親和性の低下が認められている。そこで、ヒト型化抗EGFR Fvの結晶構造を基に、変異導入ライブラリを作製し、生細胞を用いた親和性選択を行った。結果、最大数十倍親和性が向上した変異体を複数単離することに成功し、更に得られた高親和性変異をEx3に導入することでEx3自体の高親和性化と細胞傷害活性の増強が観察された10,11)。
4-5 複合
それぞれの観点から高機能化を進め、複合により更に機能を高めようと考えるのは自然な流れである。LH型Ex3にFcを融合させた後、高親和性変異を導入することで、逐次活性の上積みがみられ、同様に高親和性変異を導入したLH型Ex3の多量体に強い活性がみられた。このように機能性断片や形態の組み合わせにより、より高機能な非天然型の組換え抗体を創出することが可能であるが、すべての組み合わせが有効であるかは明言できない。実際、Fc融合Ex3の調製液中にも多量体化した分子が存在するが、単離し比較したところ有意な差はみられなかった。Fc融合により既に多価化は達成できているため、更なる多価効果は不利益な立体障害の生成などにより相殺されていることなどが考えられる。いずれにしても抗体クローンの違いも影響し得るため、引き続き検討・検証を進め、プラットフォーム化する必要がある。
5.おわりに
冒頭で抗体医薬開発の伸び悩みに触れたが、近年は少し様相が変わってきている。2014年以降にFDAで認可された抗体医薬は、優に10件を超えており、中にはFDAでは非天然型の抗体医薬としても初めての二重特異性抗体医薬が含まれている12)。diabody型ではないが、低分子型の二重特異性抗体であり、Ex3の実用化も期待したいところである。一方で、同様に冒頭で触れた薬効に関しても、強い薬効をもたらす新たな抗原がいくつかハイライトされているが、これらに対する抗体医薬が、複数同時期に上市されるなど、やはり特定の抗原に開発が集中しているようである。また非天然型抗体医薬は、第III相試験が進められている抗体医薬の中でまだ数えられる程度である。しかしながら、二重特異性抗体医薬がFDAに認可されたことは大きな前進であり、非天然型の抗体医薬全般も含めて開発機運が高まることを期待したい。
謝辞
以上の成果は、東北大学大学院工学研究科・熊谷 泉研究室で得られたものです。献身的に実験を行って頂いた補佐員ならびに学生の皆様に、この場を借りて心より御礼申し上げます。
文献
1) Volkin, D. B., Hershenson, S., Ho, R. J., Uchiyama, S., Winter, G., Carpenter, J. F.: J. Pharm. Sci., 104, 290 (2015).
2) Kontermann, R. E.: Arch. Biochem. Biophys., 526, 194 (2012).
3) Cuesta, A. M., Sainz-Pastor, N., Bonet, J., Oliva, B., Alvarez-Vallina, L.: Trends Biotechnol., 28, 355 (2010).
4) Kontermann, R. E.: MAbs, 4, 182 (2012).
5) Hayashi, H., Asano, R., Tsumoto, K., Katayose, Y., Suzuki, M., Unno, M., Kodama, H., Takemura, S., Yoshida, H., Makabe, K., Imai, K., Matsuno, S., Kumagai, I., Kudo, T.: Cancer Immunol. Immunother., 53, 497 (2004).
6) Asano, R., Sone, Y., Makabe, K., Tsumoto, K., Hayashi, H., Katayose, Y., Unno, M., Kudo, T., Kumagai, I.: Clin. Cancer Res., 12, 4036 (2006).
7) Asano, R., Kawaguchi, H., Watanabe, Y., Nakanishi, T., Umetsu, M., Hayashi, H., Katayose, Y., Unno, M., Kudo, T., Kumagai, I.: J. Immunother., 31, 752 (2008).
8) Asano, R., Kumagai, T., Nagai, K., Taki, S., Shimomura, I., Arai, K., Ogata, H., Okada, M., Hayasaka, F., Sanada, H., Nakanishi, T., Karvonen, T., Hayashi, H., Katayose, Y., Unno, M., Kudo, T., Umetsu, M., Kumagai, I.: Protein Eng. Des. Sel., 26, 359 (2013).
9) Asano, R., Ikoma, K., Sone, Y., Kawaguchi, H., Taki, S., Hayashi, H., Nakanishi, T., Umetsu, M., Katayose, Y., Unno, M., Kudo, T., Kumagai, I.: J. Biol. Chem., 285, 20844 (2010).
10) Makabe, K., Nakanishi, T., Tsumoto, K., Tanaka, Y., Kondo, H., Umetsu, M., Sone, Y., Asano, R., Kumagai, I.: J. Biol. Chem., 283, 1156 (2008).
11) Nakanishi, T., Maru, T., Tahara, K., Sanada, H., Umetsu, M., Asano, R., Kumagai, I.: Protein Eng. Des. Sel., 26, 113 (2013).
12) Reichert, J. M.: MAbs, 8, 197 (2016).