【トピックス】
1細胞内酸素濃度イメージング
蒲池利章
東工大院・生命理工
1.はじめに
好気呼吸を行う生物にとって酸素は非常に重要な分子である。これらの生物では、解糖系、クエン酸サイクルなどによって有機化合物が二酸化炭素と水に分解される。この過程で得られた電子を用いてミトコンドリア内膜で電子伝達が行われ、最終的にシトクロムcオキシダーゼの働きにより酸素が還元され、水が生成する。この電子伝達に伴い、ミトコンドリア内膜の内外で電気化学ポテンシャルが生じ、これを利用しATPが合成される。すなわち、好気呼吸を行う生物は酸素を消費しながら生命活動に必要なエネルギー変換を行い、生体内でのエネルギーであるATPを生産しているといえる (酸化的リン酸化)1,2)。疾病や傷害により組織内で低酸素状態が生じると、酸化的リン酸化によるATP産生能は低下する。生体内では低酸素状態に対する適応応答として、Hypoxia inducible factor (HIF) を発現する3)。また、癌組織は正常組織に比べ定常的に低酸素状態であり、HIFが癌細胞の解糖系亢進、血管新生や転移誘導を介して、低酸素に対する適応に寄与しているといわれている4,5)。さらに、HIFは薬剤の細胞外への排出に関わるタンパク質を発現することで、抗癌剤への抵抗性も示すことが報告されており、癌治療のターゲットとして検討されている。これらのことから、疾病のメカニズムや治療において、組織や細胞内の酸素濃度は重要な因子であり、種々の組織、血管中や細胞内の酸素濃度測定法が研究・開発されている。本トピックスでは、リン光が酸素によって消光される現象を利用した、細胞内の酸素濃度イメージングに関し概説する。
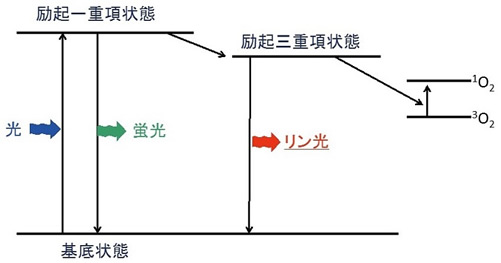
図1 色素のエネルギー準位
1-1 リン光を利用した酸素測定6)
図1に色素分子のエネルギー準位を示す。基底状態にある色素分子に励起光を照射すると、光エネルギーを吸収し励起一重項状態に遷移する。励起一重項状態の色素分子は、無放射遷移、あるいは蛍光を発して基底状態に戻る。ポルフィリン、ルテニウムやイリジウム化合物といった金属錯体では、励起一重項状態から励起三重項状態への禁制遷移が一部解け、励起三重項状態に遷移する。励起三重項状態からの発光現象がリン光である。励起三重項状態から基底状態への遷移は禁制遷移であるため、その寿命は10-5–10 sと励起一重項状態に比べ、長寿命であることが知られている。このため、励起三重項状態は、他の分子との間で電子移動やエネルギー移動などが進行する。例えば、励起三重項状態の色素分子と酸素分子との間でエネルギー移動が進行すると、一重項酸素が生成し、励起状態にある色素は基底状態へと戻る。このように励起分子と他の分子との間の反応により励起分子が基底状態に遷移する過程を消光とよぶ。リン光性色素が酸素により消光されるとリン光強度の減少あるいはリン光寿命の短寿命化がおきる。このような分子間の消光過程の速度論はStern-Volmer式 (1) に従う。
![]()
ここで、τ0は消光剤非存在下、τは消光剤存在下のリン光寿命。kqは消光速度定数、[Q]は消光剤 (酸素) 濃度、KSVはStern-Volmer定数を示している。また、発光強度Iと発光寿命は色素分子が基底状態での相互作用がないと仮定すると、式 (2) の関係が成り立つ。
![]()
すなわち、リン光強度あるいはリン光寿命を測定することで、酸素濃度が計測可能となる。また、この消光は可逆反応であるため、連続的な酸素濃度計測が可能である。
2.リン光測定による圧力分布計測
このようなリン光測定による酸素濃度計測を用いると、風洞実験におけるモデル表面の圧力分布の計測が可能となる。試験モデルとしてH2ロケットと、自動車のドアミラーの圧力分布計測の例を示す。これらの模型の表面にリン光性色素としてPtTFPP (図2) を均一に塗布後、風洞内で可視光照射をおこない、リン光強度を測定した結果を図3に示す。図ではリン光強度を疑似カラーで示しており、リン光強度の低い部分を赤色、強度の高い部分を青色で示している。リン光強度の低い部分は酸素による消光が強く起きている部分、すなわち圧力の高いことを示している。例えばH2ロケットの先頭部分は赤色で示されており、圧力が高いことがわかる。また、青色で示される流れの剥離による低圧部分も可視化できている。ドアミラーのモデルでも同様に、圧力分布が可視化できている。このような光による圧力分布の可視化は、比較的容易に3次元モデル表面の圧力分布が可視化できるため、非常に有効な方法であるといえる。
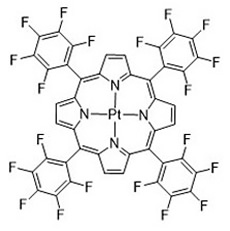
図2 PtTFPPの構造

図3 風洞実験における圧力分布の可視化
左:H2ロケットモデル(マッハ0.9) 右:ドアミラーモデル(時速137 km)
3.細胞内の酸素濃度分布
上述のリン光を利用した酸素濃度の計測を生物の分野に応用すると、細胞あるいは組織内の酸素濃度のイメージングが可能となる。我々の研究室では、特に1細胞内の酸素濃度のイメージングに興味を持ち、研究を行っている7)。リン光強度の測定は、通常の蛍光顕微鏡下で測定でき、酸素濃度のイメージングが可能である。しかし、リン光強度はリン光性色素の濃度に依存するため、細胞にリン光性色素を均一に分布させる必要がある。よく知られている通り、色素を細胞内に均一に分布させることは困難であり、濃度分布が存在する場合、酸素濃度のみに依存した計測は難しい。2項で述べたモデル表面の圧力分布計測では、試験モデルの表面に均一にリン光性色素を塗布することが比較的容易であるため、リン光強度を用いた測定法により酸素濃度分布 (圧力分布) が可視化できた。一方、リン光寿命を用いた測定法は、励起状態の減衰が一次反応であるため、色素分子の濃度や励起光の強度の影響を受けないという利点を有する。このため、色素分子の濃度分布が存在する細胞内や組織内の酸素濃度イメージングに適しているといえる。
そこで、我々の研究室では、リン光性色素を取り込ませた1細胞内からのリン光寿命を共焦点顕微鏡下で測定することで、酸素濃度分布のイメージングを行っている。リン光性色素として図4に示すPt-meso-tetrakis (4-carboxyphenyl) porphyrin (PtTCPP) を用いた。PtTCPPは常温、常圧でリン光を発するポルフィリン化合物である。また、末端にカルボキシル基を有するため、比較的水溶性が高いという特徴を有する。PtTCPPを溶解させた培地中で細胞を静置し、細胞内にPtTCPPを取り込ませ、その後、酸素濃度イメージングを行った。典型的な結果を図5に示す。
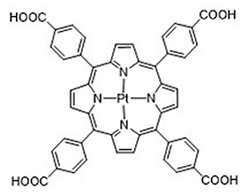
図4 PtTCPPの構造
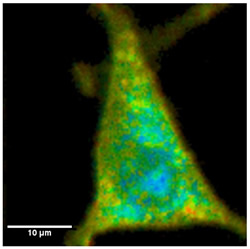
図5 Colon26の細胞内酵素濃度イメージング
図3と同様に、高酸素濃度部分を赤色、低酸素濃度部分を青色とした疑似カラーで表示している。細胞のサイズはおよそ20 × 30µmで、細胞周辺が赤~黄色で、また、細胞質、核が緑~青色で示されている。これは培地中に溶存している酸素分子が細胞外から細胞内に拡散により取り込まれ、細胞内で消費されているため、細胞の周辺部分で酸素濃度が高く、細胞内部で酸素濃度が低いことを示している。また、細胞内にも色の分布があることがわかる。すなわち、1細胞内にも酸素濃度分布が存在している。つまり、細胞内での酸素消費は均一ではないことを示している。
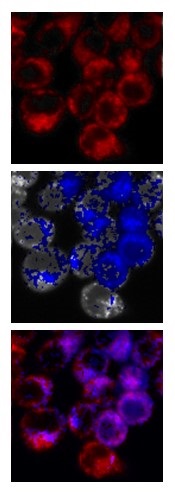
1細胞内という非常に小さい領域であっても、酸素濃度分布が存在することがわかった。1項でも述べたように、細胞内のミトコンドリアでは、ATPを産生するために電子伝達を行い、電子伝達の終末電子受容体として酸素を用いていることから、ミトコンドリアは細胞内小器官の中でも特に酸素消費量が高いと考えられている。そこで、細胞内の低酸素領域の由来を明らかにするため、ミトコンドリア染色色素とリン光性色素PtTCPPの二重染色をMKN45細胞で行った (図6)。上から順にミトコンドリアの局在を示すMitoTrackerの蛍光像、酸素濃度イメージングの結果、これら2つの映像をマージした結果である。低酸素領域は細胞内の平均の酸素濃度より低い部分を青色で示した。マージした図を見ると、細胞内で観測された低酸素領域にはミトコンドリアが存在していることがわかる。このような2重染色の結果を散布図にプロットすることで、より詳細に細胞内の酸素濃度分布に関する知見を得ることができる (図7)。散布図のX軸はリン光寿命であり、酸素濃度に対応する。長寿命ほど酸素濃度が低いことを示す。Y軸はMitoTrackerの蛍光強度である。仮にリン光寿命25µsとMitoTrackerの蛍光強度50で図を4分割し、蛍光強度50以上の領域はミトコンドリアの存在を示しているとする。このようなプロットをすると、ミトコンドリアの存在する領域のおよそ2/3はリン光寿命が長い (酸素濃度が低い) ことがわかる。さらにミトコンドリア電子伝達系の複合体Ⅲの阻害剤として知られているAntimycin Aを添加すると、60分後には添加前に存在した低酸素部分が消失し、すべて高酸素領域となった。これらのことから細胞内に観測される酸素濃度分布の主な原因は、ミトコンドリアによる酸素消費によることがわかった。
![]()
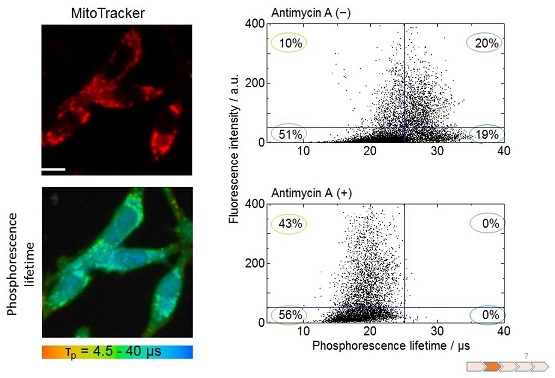
図7 Colon26細胞のMito TrackerとPtTCPPの2重染色の結果およびAntimycin Aの添加前後の散布図
4.外部刺激に応答した酸素濃度ダイナミクス
上述のように、本測定法は外部からの薬剤添加に応じた、細胞内の酸素濃度の経時変化 (酸素濃度ダイナミクス) が測定可能である。以下に、褐色脂肪細胞および膵細胞を用いた酸素濃度ダイナミクスについて紹介する。
4-1 褐色脂肪細胞
動物は、脂肪をエネルギー源として蓄積する機能があり、脂肪細胞はその役割の一端を担っている。褐色脂肪細胞は、熱生産を主な役割とする細胞である。褐色脂肪細胞は、ミトコンドリアを多く含み、他の細胞と比べより多くの酸素を消費することが知られている。また、褐色脂肪細胞の熱生産機構については未だ不明な点が多いが、ミトコンドリアの脱共役剤の添加によるエネルギー消費の増大や熱生産の亢進が報告されている。褐色脂肪細胞内のミトコンドリア内膜上のタンパク質には、脱共役タンパク質が大量に存在する。糖や脂肪などの代謝の過程で取り出された電子は、ミトコンドリア内膜の電子伝達系へと渡される。ミトコンドリア内膜では電子伝達系の複合体Ⅰ,Ⅲを経て最終的に複合体Ⅳで酸素が還元され、水分子が生成する。この電子伝達の過程で、ミトコンドリア内膜にプロトン濃度勾配が形成する。通常、このプロトン濃度勾配はF1F0-ATPaseにより解消され、そのエネルギー勾配を駆動力としてATPが合成される。脱共役タンパク質はプロトンチャンネルであり、短絡的にプロトン濃度勾配を解消する。その結果、ATP合成が共役されずにプロトン濃度勾配が消失し、熱生産が行われる。プロトン濃度勾配が解消すると、ミトコンドリア内膜でのプロトン濃度勾配形成が促進される。このプロトン濃度勾配の生成は酸素の消費を伴っているため、プロトン濃度勾配の解消は酸素消費速度の増加につながるといえる。Carbonyl cyanide m-chlorophenylhydrazone (CCCP) はミトコンドリアの脱共役剤として知られている物質である。CCCP添加により、ミトコンドリア膜に形成されているプロトンの濃度勾配が解消する。このため、脱共役タンパク質と同様、脱共役が促進され、エネルギー消費が増大し、酸素消費の増加が予想される。そこで、脱共役剤の添加による細胞内酸素濃度変化を測定した。
ラット褐色脂肪細胞前駆細胞を分化誘導し、その後、PtTCPPを取り込ませ、CCCP添加後の細胞内酸素濃度の経時変化を測定した。結果を図8に示す。添加30 s後では黄緑色を示したのに対し、CCCP添加480 s後では細胞内は水色を示している。赤線で示す部位のリン光寿命のラインプロファイルを図中に示す。CCCP添加30 s後では、リン光寿命はおよそ15 µsであったのに対し、添加480 s後では、およそ20µsとなり、寿命が長寿命化していることがわかる。すなわち、CCCP添加によるミトコンドリア内膜の膜電位消失、これに伴う電子伝達系の亢進の結果、細胞内酸素消費が増加し、細胞内部が低酸素濃度化することが数分以内に進行することがわかった。
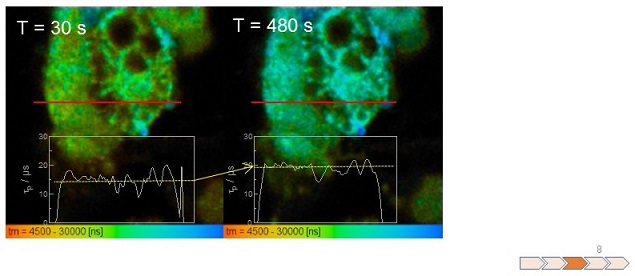
図8 褐色脂肪細胞内の酸素濃度に対するCCCPの添加効果
4-2 膵細胞
マウス膵β細胞株MIN6はグルコース濃度の上昇に伴い、酸素を消費してATPを産生する。これにより、KATPチャネルが閉鎖するため細胞膜が脱分極し、Ca2+が細胞内へ流入することでインスリンが分泌されることが知られている。実際、培養液中の酸素濃度を酸素電極で測定することで、細胞内の酸素消費速度の増加が報告されている。そこで、グルコース刺激による細胞内の酸素濃度変化を直接可視化することにより、グルコース添加により引き起こされる酸素濃度の経時変化のイメージングを試みた。結果を図9に示す。グルコース刺激前の細胞内は黄緑色で示されていたが、高グルコース刺激後は細胞内が緑色から青色へと変化することが分かった。この細胞内酸素濃度の変化は、30分程度で徐々に進行した。一方、グルコース未添加の場合、細胞内のリン光寿命は変化しなかったことから、グルコース刺激によりMIN6内は30分程度かけて徐々に低酸素濃度になることが明らかとなった。

図9 膵β細胞株MIN6の細胞内酸素濃度に対するグルコースの添加効果
5.おわりに
本トピックスでは、酸素によるリン光の可逆的な消光を利用した、酸素センシング法による1細胞内酸素濃度イメージングを概説した。細胞内の正確な酸素濃度イメージを得るために、リン光寿命を顕微鏡下で測定するシステムを用いた。本システムを用いれば、二次元および三次元培養した細胞内の酸素濃度イメージングが可能である。また、細胞内小器官特異的な染色法と細胞内酸素濃度イメージングの二重染色による低酸素領域の推定、外部刺激に応じた細胞内酸素濃度の動的変化などが観察可能である。このように1細胞内の酸素濃度の経時変化がイメージングできるようになったことから、今後、様々な生理現象に伴う細胞内の酸素濃度ダイナミクスの解明が期待される。
文献
1) Bertout, J. A., Patel, S. A., Simon, M. C.: Nat Rev Cancer, 8, 967 (2008).
2) Murdoch, C., Muthana, M., Lewis, C. E.: J Immunol, 175, 6257 (2005).
3) Majmundar, A. J., Wong, W. J., Simon, M. C.: Mol Cell, 40, 294 (2010).
4) Semenza, G. L.: Trends Mol Med, 18, 534 (2012).
5) Keith, B., Simon, M. C.: Cell, 129, 465 (2007).
6) Okura, I., Kamachi, T.: in Handbook of Porphyrin Science: with Applications to Chemistry, Physics, Materials Science, Engineering, Biology and Medicine (volumes 12), ed. by K. M. Kadish, K. M. Smith, R. Guilard, World Scientific, 2011, Vol. 12, 297.
7) Kurokawa, H., Ito, H., Inoue, M., Tabata, K., Sato, Y., Yamagata, K., Kizaka-Kondoh, S., Kadonosono, T., Yano, S., Inoue, M., Kamachi, T.: Sci Rep, 5, 10657 (2015).