【トピックス】
邊見 久
1.はじめに
アーキアは真核生物、バクテリアと並び、最上位の生物分類群である3つのドメインの1つを形成する生物群である。他のドメインの生物とアーキアを分ける性質の1つに、膜脂質の構造が挙げられる。その特徴的な構造は、アーキア (古くはアーキバクテリア) という分類群が提唱される以前から見出されており、当然生合成研究の興味の対象とされてきた。しかしながら、未だにその生合成には未解明な部分が多い。その原因としては、酵素反応の基質が入手しづらい、アーキアの遺伝子操作が一般的に難しい、といった研究上の諸問題が挙げられるだろう。しかし最近、これらの問題を大腸菌細胞の利用という新たな手段で解決した研究成果が、筆者らをはじめとする複数のグループにより報告されている。本稿ではそれらの生合成研究の主要な成果を紹介する。
2.アーキア膜脂質の特徴
まずはアーキア膜脂質について簡単に説明しておきたい。生体膜を形成するそれらの機能はバクテリアや真核生物の膜脂質と何ら変わらない。アーキア膜脂質は極性頭部基に対して2本の疎水性炭化水素鎖を有する基本的な構造を持ち、その点では他生物のグリセロ脂質やスフィンゴ脂質のアナログと言って良い (図1)。しかしアーキア膜脂質はそれらの脂質とは全く異なる生合成経路で合成され、したがって異なる分類の生体化合物群に属している。直鎖アルキル基、すなわち脂肪酸によって構成される他生物の膜脂質に対し、アーキア膜脂質は複数のメチル基による分岐が等間隔に存在するイソプレノイドアルコールを炭化水素鎖としている。つまりアーキア膜脂質はC5単位の繰り返し構造を持つ化合物群であるイソプレノイドに分類され、他生物の膜に少量成分として含まれるステロールやその類縁化合物の同族と言える。しかしながら剛直な多環構造を持つステロールとは異なり、アーキア膜脂質のイソプレノイド鎖は比較的柔軟である。やはりアーキア膜脂質の分子としての機能は、同じく生体膜の主成分である他生物のグリセロ脂質やスフィンゴ脂質に近いと考えて良いだろう。実際にアーキア膜脂質中には他生物のグリセロ脂質同様にグリセロール構造が含まれており、そこに極性頭部基と2つの炭化水素鎖が連結されている。ただし面白いのは、その生合成前駆体がsn-グリセロール1-リン酸 (G1P、図2) であることで、同化合物は他生物のグリセロ脂質の前駆体であるsn-グリセロール3-リン酸の鏡像異性体にあたる。したがってアーキア膜脂質は、炭化水素鎖が脂肪酸からイソプレノイドアルコールに置き換わっただけの、他生物のグリセロ脂質の単純なアナログではない。なお、グリセロールとイソプレノイドアルコールの結合様式はエーテル結合であり、これもまた、通常のグリセロ脂質に見られるエステル結合に対比される、アーキア膜脂質の特徴の一つである。後述するようにアーキア膜脂質はしばしばジエーテル脂質やテトラエーテル脂質などと呼称されるが、この結合様式がその理由となっている。
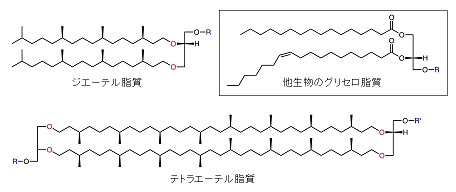
![]()
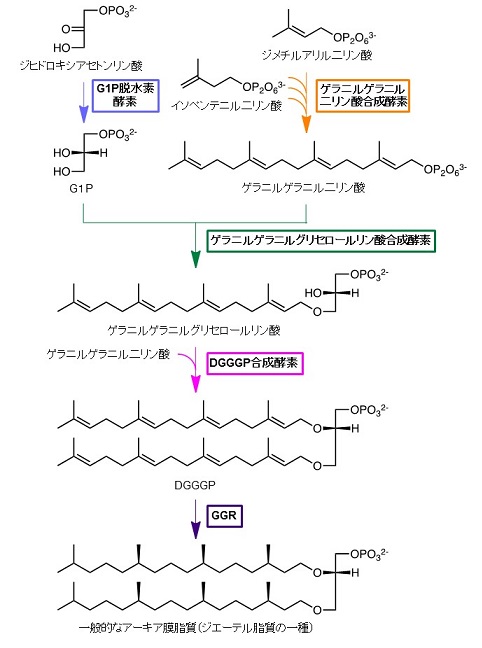
図2 アーキア膜脂質生合成経路の主要部分
アーキア膜脂質の生合成に目を向けると、ほぼ全てのアーキアが共有する主要部分に関する理解はこれまでにある程度進んでおり、研究者の興味は膜脂質の構造的多様性を生み出す機構へと移りつつある。ここで言う主要部分とは、ゲラニルゲラニル二リン酸とG1Pが合成され、それらの間の縮合によってアーキア膜脂質の共通の前駆体とされるジゲラニルゲラニルグリセロールリン酸 (DGGGP) が生じ、さらにDGGGPが持つ不飽和イソプレノイド鎖がゲラニルゲラニル基還元酵素 (GGR) によって完全に還元されるまでを指す (図2)。なお、この過程で生じるアーキア膜脂質は、構造中にエーテル結合を2つもつため、ジエーテル脂質と呼ばれる。アーキア膜脂質の構造的多様性は、真核生物やバクテリアに比較的似た機構による極性頭部の修飾と、未知な点の多い炭化水素鎖の構造変化に起因している。それらはしばしばアーキアの系統分類にリンクしており、特に後者は環境中におけるある種のアーキアの存在を示すバイオマーカーとして利用されることが多い。おそらく最も知られた炭化水素鎖の構造変化の例は、2分子のジエーテル脂質が互いのイソプレノイド鎖の末端炭素同士を縮合させることで生じる最大72員環の大環状構造である (図1)。これに類する構造を有する双頭型の脂質は、エーテル結合の数からテトラエーテル脂質と呼ばれる。他にも、分子内で炭素鎖末端が縮合したジエーテル脂質、5員環や6員環といった小環構造を有する脂質、イソプレノイド鎖の途中に水酸基を有する脂質などの存在が知られている。これらの修飾反応を触媒する酵素は、いずれもDGGGPのような未還元の前駆体を基質とすると考えられている。
3.大腸菌におけるアーキア膜脂質の生産
アーキア膜脂質の炭化水素鎖に起きる構造変化は興味深い研究対象であるが、DGGGPのような生合成中間体の有機合成を達成できる限られた研究者のみが取り組めるテーマであった。しかし、2004年にDGGGP合成酵素の遺伝子が単離されたことで、DGGGPまでの生合成経路の全ての酵素を組換え発現し、それらを用いてin vitroでDGGGPが合成できるようになった1)。もしそれらの遺伝子を同時に他生物の細胞中に導入して生合成経路を再構成できれば、DGGGPの生物生産も可能なはずである。このアイディアは、2009年にMonbouquetteらのグループ2)、次いで2011年に我々によって実現された3)。Monbouquetteらは好熱性アーキアArchaeoglobus fulgidus、我々はメタン生成アーキアMethanosarcina acetivoransの遺伝子を大腸菌に導入した。導入されたのは、G1P脱水素酵素、ゲラニルゲラニル二リン酸合成酵素、ゲラニルゲラニルグリセロールリン酸合成酵素、DGGGP合成酵素の計4つのアーキア酵素の遺伝子であり、それらのアーキア酵素は大腸菌内在の前駆物質からDGGGPを合成するのに十分である。興味深いことに、Monbouquetteらの系では予想通りDGGGPが合成されたのに対し、我々の系ではDGGGPの頭部リン酸基がグリセロール修飾を受けたDGGGP-グリセロールの合成が観察された。大腸菌に発現させたアーキア由来酵素は少なくともin vitroではグリセロール修飾活性を示さなかったため、この修飾反応は大腸菌内在の酵素群によって触媒されたものと考えられた (図3)。つまり、この結果はアーキア膜脂質の前駆体であるDGGGPが大腸菌内在の膜脂質と同様の代謝を受けたことを意味し、DGGGPが正しい配向で大腸菌の細胞膜に挿入され、その成分として機能していることを示唆するものであった。
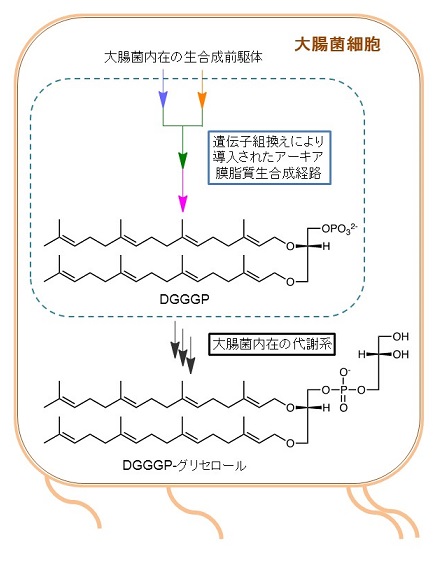
図3 大腸菌中でのアーキア膜脂質生合成前駆体の生産
さらに我々は、この系にイソプレノイド鎖の還元を触媒するGGRの遺伝子を追加導入し、実際のアーキア菌体に存在するような完全飽和型の膜脂質の合成を目指した4)。しかしながら、以前に我々が単離した好熱性アーキアSulfolobus acidocaldarius由来のGGR遺伝子5)を導入した場合には還元反応の進行が観察されたのに対し、M. acetivorans由来のGGR遺伝子を導入してもDGGGP-グリセロールは還元されなかった。一方で、M. acetivoransのGGR遺伝子とともに、そのすぐ上流に存在するフェレドキシン様タンパク質の遺伝子を導入した場合には、DGGGP-グリセロールが還元され、完全飽和型膜脂質の合成が観察された。この結果は、過去の研究において未解明のままにされていたGGRの電子供与体について、少なくとも一部の解答を与えるものであった。つまり、M. acetivoransのGGRはそれに対し特異的なフェレドキシンから電子を受け取り、膜脂質のイソプレノイド鎖の連続的な還元を触媒している。なお、そのフェレドキシンの還元は、大腸菌内在のフェレドキシン還元酵素が行っていると予想される。S. acidocaldariusのGGRについても、NAD (P) Hから効率よく電子を受け取れないことがわかっているため、同様にタンパク質性の電子供与体を要求すると考えられる。おそらく我々の系では大腸菌内在のフェレドキシン、もしくはそれに類する電子伝達タンパク質がその役割を担っていたのであろう。
Driessenらのグループは2015年、Monbouquetteらや我々と同じく、大腸菌におけるアーキア膜脂質前駆体合成系を構築し、さらにそれを極性頭部修飾酵素の研究に利用した6)。彼らが大腸菌にDGGGP合成に至る生合成遺伝子を導入したところ、合成された主要なアーキア膜脂質は我々の報告3)と同じくDGGGP-グリセロールであった。彼らはその系に、彼ら自身が2014年に同定した7)A. fulgidus由来のシチジル酸転移酵素遺伝子を追加導入した。その結果、大腸菌が合成するDGGGP-グリセロールの量は倍増した。この結果は、DGGGPがシチジリル化によって活性化された後にグリセロール修飾が施され、DGGGP-グリセロールへと変換されていることを示唆するものであった。もしもシチジリル化中間体が生じているのであれば、多量のDGGGP-グリセロールが合成される一方でDGGGP-エタノールアミンなど他の極性頭部修飾を持った膜脂質がほとんど生じない理由は、大腸菌内在の修飾酵素の基質特異性に帰することができる。そこで彼らは、この系に対してBacillus subtilis由来のホスファチジルセリン合成酵素遺伝子を導入した。その結果、DGGGP-グリセロールと同程度の量のDGGGP-エタノールアミンの合成が大腸菌中で観察された。
上述の研究例は、いずれも既知のアーキア膜脂質生合成酵素の組み合わせにより実施されたもので、いわば予想された結果の検証である。M. acetivoransからのGGR特異的フェレドキシンの発見には新規性があるものの、遺伝子の隣接から十分に予測が可能であった。また、B. subtilisのホスファチジルセリン合成酵素が、大腸菌の同酵素とは対照的にシチジリル化されたDGGGPに対して活性を有することも、森井ら8)が過去に報告している。しかし、大腸菌内に再構成されたアーキア膜脂質生合成系は、これまでに全く報告のない新奇酵素の探索にこそその力を発揮するはずである。例えばDGGGP-グリセロールを合成する大腸菌に対して機能未知遺伝子を導入し、それによって生産されるアーキア膜脂質の構造に変化が起きれば、新奇酵素を同定することができる。次項では、そのような生合成研究のプラットフォームとしての大腸菌の利用により、アーキア膜脂質生合成に関わると予想される新奇酵素を発見した例を紹介する。
4.アーキア膜脂質の生合成に関与する新奇酵素の探索
4-1 ω特異的新奇GGR
我々は、M. acetivoransを新奇酵素探索のターゲットとした。その理由は、同菌が5.75 Mbpと他のアーキアに比べて大きなサイズのゲノムを持ち、そのためか既知イソプレノイド代謝酵素のホモログを数多くゲノム上にコードしているからである。その中にフィトエン脱水素酵素のホモログがある。フィトエン脱水素酵素はカロテノイド生合成に関与する酸化還元酵素であるが、M. acetivoransには他のカロテノイド生合成酵素遺伝子は存在せず、したがってそれらのホモログの機能は不明である。そのようなホモログの遺伝子が、なぜかM. acetivoransには複数存在する。そこでその1つ、MA1492の遺伝子をDGGGP-グリセロール生産大腸菌に追加導入した9)。その結果、逆相HPLC解析においてDGGGP-グリセロールより保持時間の大きな脂質が新たに得られ、DGGGP-グリセロールのイソプレノイド鎖が部分的に還元されたものと推定された。質量分析の結果、還元は2本のイソプレノイド鎖にそれぞれ4つずつ、合計8つある二重結合のうちの2箇所で起きていることがわかった。さらにLC-MSn (液体クロマトグラフィータンデム質量分析法) 解析により還元部位を大まかに推定したところ、それぞれのイソプレノイド鎖の二重結合が1つずつ還元されていた。また、基質特異性解析の結果、炭素数20のイソプレノイド鎖であるゲラニルゲラニル基を持つ化合物のみが特異的に還元を受け、それよりも長い、もしくは短いイソプレノイド鎖は反応性が低いことが示された。さらに、ゲラニルゲラニル二リン酸を基質とし、GC-MS (ガスクロマトグラフィー質量分析法) により二重結合の還元位置を特定したところ、ゲラニルゲラニル基のω末端の二重結合が特異的に還元を受けることが分かった。これらの結果から、我々はMA1492をω特異的な新奇GGRであると結論した (図4)。同酵素は既知のGGRに相同性を持たない。実際、近縁なアーキアであるMethanosarcina mazei由来の相同タンパク質についてすでに結晶構造が解かれているが、補酵素であるFADを結合する他は、立体構造的にも既知のGGRとは大きく異なっている。今のところMA1492がアーキア膜脂質生合成に関わっている確証は無く、それ以外のイソプレノイドの生合成に関与している可能性も否定できない。しかし、in vitroの反応でDGGGP-グリセロールが良い基質となり、膜脂質以外のイソプレノイドの生合成前駆体に対する強い活性が検出できていないことを考えると、MA1492は膜脂質生合成において何らかの機能を果たしているように思える。
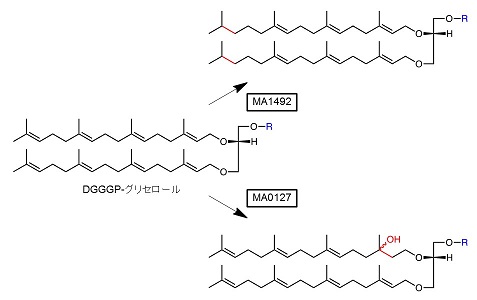

4-2 ヒドロキシアーキオール生合成に関わる推定水和酵素
同じく機能未知のフィトエン脱水素酵素ホモログの1つ、MA0127の遺伝子をDGGGP-グリセロール生産大腸菌に導入した結果は、先に述べたMA1492の結果とは全く違っていた10)。DGGGP-グリセロールの合成量低下に伴って新たに検出された脂質は、DGGGP-グリセロールに比べて逆相カラムからの溶出が速く、18だけ大きな分子量を有していた。LC-MSn解析の結果から、その分子量の増大はDGGGP-グリセロールの二重結合1つの水和によって生じたことが示された。2本のイソプレノイド鎖のどちらが修飾を受けたのかは特定できなかったが、水和されたのはゲラニルゲラニル基の2位の二重結合であり、3位の炭素に水酸基が位置していた (図4)。以上の結果から、MA0127はヒドロキシアーキオール型の膜脂質の生合成に関わる水和酵素だと推定された。ヒドロキシアーキオールとは、イソプレノイド鎖の途中に水酸基を持つアーキア膜脂質から極性頭部を除いた構造を意味し、それらの総称として使われている。M. acetivoransをはじめとするMethanosarcinales目のアーキアはヒドロキシアーキオール型脂質を有する分類群として知られており、今回の発見はきわめて合理的なものである。興味深いことに、MA0127のホモログ遺伝子は、同じくMethanosarcinales目に分類される複数の嫌気的メタン酸化アーキア (ANME) のゲノムにも含まれていた。ANMEは難培養性であり、それらのゲノム配列はメタゲノム解析の結果得られたものである。アーキア膜脂質は化学的に安定性の高い構造をもち、しばしば海底などの堆積物中から、その極性頭部を失った状態で抽出される。それらは、生物が地球規模での炭素循環に果たす役割を調べるといった、生物地球化学分野の研究における貴重な資料である。そのうちヒドロキシアーキオールはANMEの代謝を調べる手がかりとして使われているが、ANMEの純粋培養ができないため、それらを結びつける証拠は絶対的なものではなかった。今後ANME由来のホモログに水和酵素活性が見出されれば、ANMEとヒドロキシアーキオールを結ぶより確実な証拠となるだろう。
5.おわりに
上述したようにアーキア膜脂質には幅広い構造的多様性が存在する。大腸菌での生合成経路再構成系を利用すれば、そのような多様性を生み出す生合成機構の研究を容易に進めることが可能かもしれない。中でも特に研究者の興味を引いているのはテトラエーテル脂質が生じるメカニズムである。DGGGPのような、不飽和イソプレノイド鎖を持ったジエーテル型の前駆体間に炭素−炭素結合が形成され、大環状構造が生じると予想されてはいるものの、その縮合反応のメカニズムは全く解明されていない。もしテトラエーテル脂質の生合成が単一、もしくは少数の酵素によって触媒されるのであれば、大腸菌での生合成経路の再構成は、その証明のきわめて有効な手段になるだろう。
生合成研究のプラットフォームとしての役割以外にも、大腸菌におけるアーキア膜脂質の合成には様々な意義がある。合成生物学的な視点からは、ドメインを超えた異なる種類の脂質が共存した膜を持つ生物の創生と見なすことができる。このような、いわばキメラ生体膜は、アーキアとバクテリアが分岐する以前の共通祖先に存在していたと考えられており、その物性は生物進化を再現するという意味でもきわめて興味深い。残念ながら現在大腸菌におけるアーキア膜脂質の合成量はわずかで、宿主に明らかな表現系の変化をもたらすまでには至っていない。しかし我々の目標はアーキア膜脂質の合成量を増やし、究極的にはそれらでバクテリア膜脂質を置き換えることである。その過程で脂質の分子構造が生体膜や宿主細胞にもたらす影響、およびそれらが生物進化の過程で果たした役割についても見えてくるのではないかと期待している。
謝辞
本稿で紹介した我々の研究の一部は、科学研究費補助金 (23108531および25108712)、旭硝子財団ステップアップ助成、および武田科学振興財団ライフサイエンス研究奨励助成による支援のもとで行われました。吉村 徹教授をはじめとする名古屋大学大学院生命農学研究科 生体高分子学研究分野のスタッフ、および共同研究者の皆様のご協力に厚く御礼申し上げます。特に、日々の努力の積み重ねにより研究を進めてくれた学生諸氏に敬意を表すると共に、心より感謝いたします。また、メタン生成アーキアの培養をご指導いただいた名古屋大学大学院生命農学研究科 浅川 晋教授と、しばしば貴重なアドバイスをいただいた産業医科大学 古賀洋介名誉教授に厚く御礼申し上げます。
文献
1) Hemmi, H., Shibuya, K., Takahashi, Y., Nakayama, T., Nishino, T.: J. Biol. Chem., 279, 50197 (2004).
2) Lai, D., Lluncor, B., Schröder, I., Gunsalus, R. P., Liao, J. C., Monbouquette, H. G.: Metab. Eng., 11, 184 (2009).
3) Yokoi, T., Isobe, K., Yoshimura, T., Hemmi, H.: Archaea, 2012, 438931 (2012).
4) Isobe, K., Ogawa, T., Hirose, K., Yokoi, T., Yoshimura, T., Hemmi, H.: J. Bacteriol., 196, 417 (2014).
5) Sato, S., Murakami, M., Yoshimura, T., Hemmi, H.: J. Bacteriol., 190, 3923 (2008).
6) Caforio, A., Jain, S., Fodran, P., Siliakus, M., Minnaard, A. J., van der Oost, J., Driessen, A. J. M.: Biochem. J., 470, 343 (2015).
7) Jain, S., Caforio, A., Fodran, P., Lolkema, J. S., Minnaard, A. J., Driessen, A. J. M.: Chem. Biol., 21, 1392 (2014).
8) Morii, H., Koga, Y.: J. Bacteriol., 185, 1181 (2003).
9) Ogawa, T., Isobe, K., Mori, T., Asakawa, S., Yoshimura, T., Hemmi, H.: FEBS J., 281, 3165 (2014).
10) Mori, T., Isobe, K., Ogawa, T., Yoshimura, T., Hemmi, H.: Biochem. Biophys. Res. Commun., 466, 186 (2015).