【トピックス】
ピロロキノリンキノンの結合による哺乳類乳酸脱水素酵素LDHの活性制御
赤川 貢、内田浩二
大阪府大院・生命環境、東大院・農学生命
1.はじめに
ピロロキノリンキノン (PQQ) はニコチンアミドピリジンヌクレオチドとフラビンに次ぐ第3の酸化還元補酵素として細菌から発見された化合物である (図1)。哺乳類はPQQ生合成能を持たず、PQQ欠乏飼料で飼育したマウスが成長遅延等の欠乏症状を呈することから、PQQがビタミンである可能性が示唆されている。しかしながら、現在まで哺乳類からPQQ依存性酵素が同定されていないため、ビタミンとして認定されていない。PQQが栄養学的に重要であることは明らかであり、細胞増殖促進作用、抗インスリン抵抗性作用、および神経保護作用など多様な生理機能も報告されている。一方でその根底にある作用機序は、ほとんど解明されていない。このような背景から、著者らはPQQをリガンドとしたアフィニティービーズを作製し、PQQを補酵素として要求する哺乳類由来の酵素の探索を行ってきた。本トピックスでは、PQQの栄養学的な重要性を解説するとともに、著者らが同定したPQQ結合タンパク質の中で特に乳酸脱水素酵素について、PQQによる新たな酵素反応の調節機構を紹介する1)。
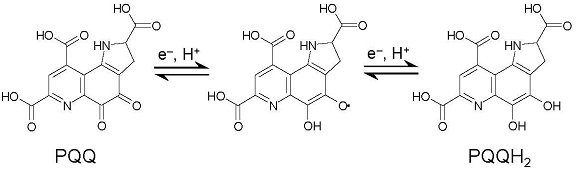
図1 PQQの構造と酸化還元サイクル
2.PQQの化学的性質と栄養学的重要性
PQQは、1979年にメタノール資化性細菌の産生するアルコール脱水素酵素から初めて同定され2)、後に図1に示す2段階の2電子酸化還元を介して酸化還元補酵素として機能することが明らかにされた。その後、次々に原核生物においてPQQ依存性脱水素酵素が発見され、最近になって真核生物からもPQQ依存性糖質酸化酵素が見出されている3,4)。PQQは限られたグラム陰性細菌によって前駆体ペプチド中のチロシンとグルタミン酸残基の酸化縮合によって生合成されると考えられており5)、野菜や肉類などの食品中にも広く含有されている6)。哺乳類はPQQを生合成することが出来ず、腸内細菌もほとんどPQQを産生しないにも関わらず、ヒトの組織中からPQQが検出されるため、ヒトはPQQを食事から摂取していると考えられている7,8)。1989年にRuckerらのグループがPQQ欠乏餌で飼育したマウスが成長遅延、皮膚の脆弱化、ミトコンドリア機能の低下、および繁殖能力の低下等の異常を呈することを発見し、哺乳類におけるPQQの栄養学的重要性を初めて報告した9)。これらの症状は、微量のPQQを投与することによって回復したことから、PQQは哺乳類においても補酵素として機能するビタミンの一種ではないかと推測された。2003年になって、笠原らがラットの脳におけるリジン代謝酵素の一つであるアミノアジピン酸セミアルデヒド脱水素酵素 (AASDH) のC末端側に、PQQ依存性酵素で保存されているPQQ結合配列が7つ連続して存在していることを発見した10)。この発見から、彼らはAASDHが哺乳類におけるPQQ依存性酵素ではないかと考え、リジン代謝に及ぼすPQQの影響を調べた。その結果、PQQ欠乏餌で飼育したマウスではPQQ欠乏症状が確認されたことに加え、PQQ含有餌を与えたマウスと比較してAASDHの代謝産物である2-アミノアジピン酸が有意に減少していることを明らかにした。これらの結果から、PQQがAASDHの補酵素であると断定し、PQQは14番目のビタミンであると結論付けた。しかしながら、PQQがAASDHに結合して補酵素として機能するという直接的な実証はされておらず、翌年にはPQQのビタミン説を証拠不十分として否定する論文が相次いで報告された11,12)。そのため現在もPQQがビタミンであるかどうかは議論の対象となっており、結論は得られていない。
3.PQQ結合タンパク質の探索と同定
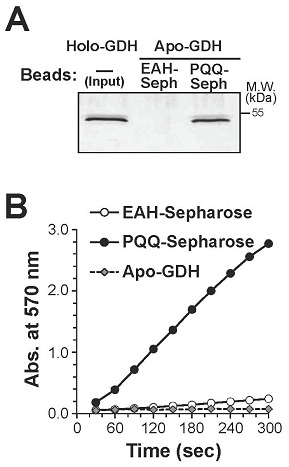
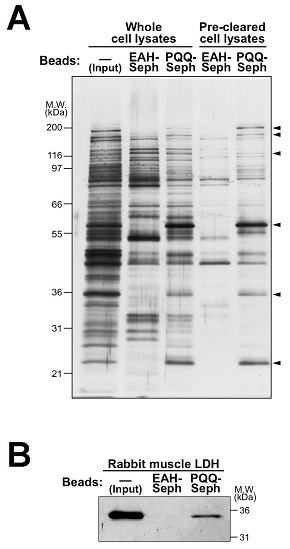
著者らは、哺乳細胞中のPQQ依存性酵素を同定するためにPQQをリガンドとしたアフィニティービーズを作製し、プルダウンアッセイによるアフィニティー精製法を確立した。アフィニティービーズは、EAH-セファロースのアミノ基にPQQのカルボキシル基をカルボジイミドカップリングさせて作製し、Acinetobacter calcoacetics由来のPQQ依存性グルコースデヒドロゲナーゼ (GDH) のアポ体を調製してその結合と補酵素活性を評価した。EAH-セファロースおよびPQQ-セファロースをapo-GDHとインキュベートし,洗浄後にPQQ溶液で溶出を行ったところ、apo-GDHは、PQQ-セファロースにだけ選択的に結合することが確認された (図2A)。また、apo-GDHにEAH-セファロースを添加してもGDH活性は認められず、PQQ-セファロースの添加によって活性が回復したことから、PQQ-セファロースはPQQ依存性酵素に対して親和性を持ち、さらに酸化還元補酵素活性を保持していることが判明した (図2B)。そこで、PQQ-セファロースを使用して、マウス線維芽細胞株NIH/3T3の細胞溶解液からPQQ結合タンパク質のアフィニティー精製を実施した。NIH/3T3細胞溶解液をEAH-セファロースでプレクリアして非特異的に結合する細胞タンパク質を除去した後に、PQQ-セファロースおよびEAH-セファロースとインキュベートしてPQQ溶液で溶出し、それぞれのビーズと結合したタンパク質をSDS-PAGEによって解析した。その結果、図3Aに示すように21、36、55、および116~200kDa付近にPQQ-セファロースと特異的に結合するタンパク質バンドが観察された。そこで、それぞれのビーズに結合し、PQQ溶液で溶出されるタンパク質画分を還元アルキル化後にトリプシン消化し、nano LC-MS/MSによる解析を実施した。その結果、pyruvate kinase、nucleoside diphosphate kinase B、peroxiredoxin、elongation factor、およびL-lactate dehydrogenase A (LDH-A) をPQQ-セファロースに特異的に結合するタンパク質として同定することができた。PQQは細菌において主に脱水素酵素の酸化還元補酵素として機能していることから、本研究では乳酸とピルビン酸の相互変換を触媒する乳酸脱水素酵素 (L-lactate dehydrogenase; LDH) に焦点を当て解析を進めた。


4.PQQによるLDH反応の平衡移動
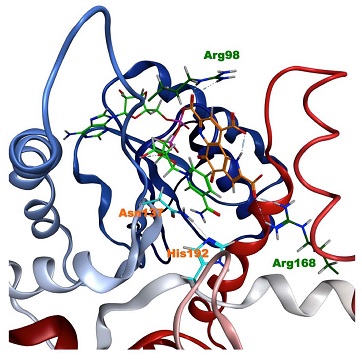
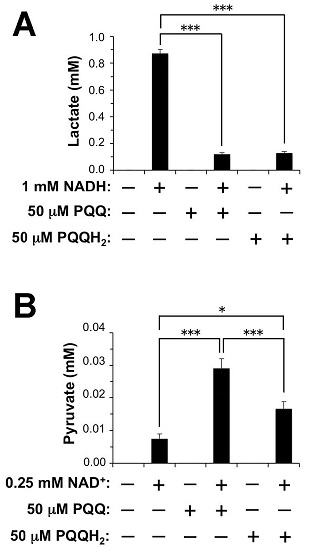
動物組織に普遍的に存在しているLDHは、解糖系の最終段階においてピルビン酸とNADHからL-乳酸とNAD+への変換を両方向に触媒する脱水素酵素である。すなわち、LDHにより「L-乳酸 + NAD+ ![]() ピルビン酸 + NADH」の可逆反応が触媒される。骨格筋型のLDH-Aと心筋型のLDH-Bの2種類のサブユニットが四量体を構成しており、それぞれの組み合わせによってLDH-1~5の5種類のアイソザイムが存在する。筋肉由来のLDH-5はLDH-Aのホモ四量体であり、その活性は乳酸生成の方向 (正反応) に大きく傾いている。本研究では、PQQのLDH-Aへの結合が酵素反応に及ぼす影響を解析するため、ヒトおよびマウス由来LDHと94%の相同性を有するウサギ筋肉由来のLDHを使用した。ウサギ筋肉由来LDHを用いたプルダウンアッセイによってPQQ-セファロースとLDHの結合を再検証した結果、特異的なPQQ-セファロースへの結合が確認された (図3B)。また、MOEを使用したPQQとヒトLDH-Aのドッキングシュミレーションの結果、PQQの両端のカルボン酸がNADH結合ポケット内のArg98、およびArg168と静電的相互作用し、NADHのニコチンアミド部位とPQQが平行に積み重なった配置が推測された (図4)。そこで、それぞれピルビン酸と乳酸を基質とした酵素反応溶液に、PQQまたは還元型PQQであるpyrroloquinoline quinol (PQQH2) を添加してインキュベートし、基質、生成物、および補酵素の濃度変化を解析した。その結果、PQQとPQQH2はLDHの補酵素として機能しないことが判明したが、NADHまたはNAD+との共存下においてPQQとPQQH2は、顕著に乳酸生成を阻害し、ピルビン酸生成を促進することが明らかになった (図5)。また、ピルビン酸を基質とした反応系 (正反応) においてNADH消費とNAD+生成が促進され (図6)、乳酸を基質とした反応系 (逆反応) ではNADH生成の抑制が観察された (図7)。これらの結果から、PQQがLDH反応の平衡を逆反応の方向に傾ける作用を持ち、この調節作用にはPQQによるNADHの酸化反応が関与していることが推察された。
ピルビン酸 + NADH」の可逆反応が触媒される。骨格筋型のLDH-Aと心筋型のLDH-Bの2種類のサブユニットが四量体を構成しており、それぞれの組み合わせによってLDH-1~5の5種類のアイソザイムが存在する。筋肉由来のLDH-5はLDH-Aのホモ四量体であり、その活性は乳酸生成の方向 (正反応) に大きく傾いている。本研究では、PQQのLDH-Aへの結合が酵素反応に及ぼす影響を解析するため、ヒトおよびマウス由来LDHと94%の相同性を有するウサギ筋肉由来のLDHを使用した。ウサギ筋肉由来LDHを用いたプルダウンアッセイによってPQQ-セファロースとLDHの結合を再検証した結果、特異的なPQQ-セファロースへの結合が確認された (図3B)。また、MOEを使用したPQQとヒトLDH-Aのドッキングシュミレーションの結果、PQQの両端のカルボン酸がNADH結合ポケット内のArg98、およびArg168と静電的相互作用し、NADHのニコチンアミド部位とPQQが平行に積み重なった配置が推測された (図4)。そこで、それぞれピルビン酸と乳酸を基質とした酵素反応溶液に、PQQまたは還元型PQQであるpyrroloquinoline quinol (PQQH2) を添加してインキュベートし、基質、生成物、および補酵素の濃度変化を解析した。その結果、PQQとPQQH2はLDHの補酵素として機能しないことが判明したが、NADHまたはNAD+との共存下においてPQQとPQQH2は、顕著に乳酸生成を阻害し、ピルビン酸生成を促進することが明らかになった (図5)。また、ピルビン酸を基質とした反応系 (正反応) においてNADH消費とNAD+生成が促進され (図6)、乳酸を基質とした反応系 (逆反応) ではNADH生成の抑制が観察された (図7)。これらの結果から、PQQがLDH反応の平衡を逆反応の方向に傾ける作用を持ち、この調節作用にはPQQによるNADHの酸化反応が関与していることが推察された。




5.PQQの酸化還元サイクルを介したLDH反応の制御機構
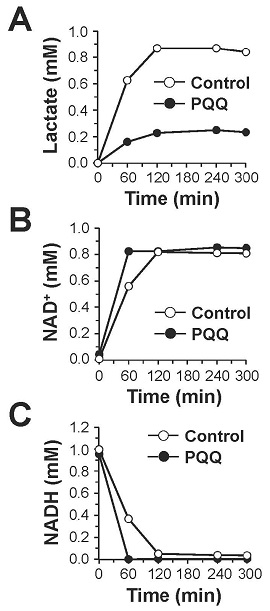
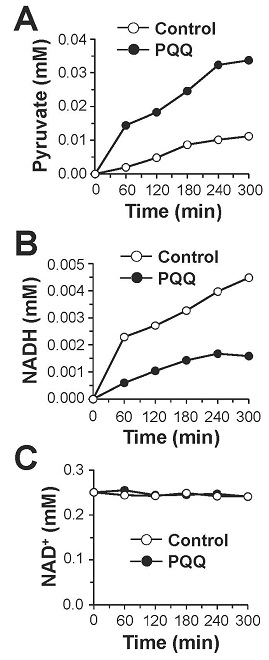
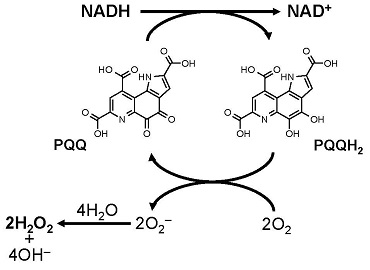
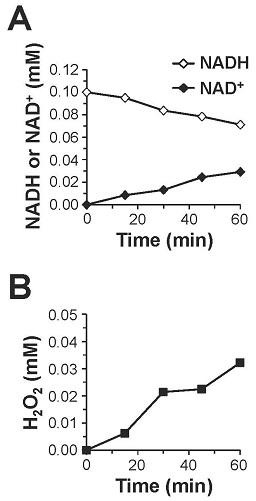
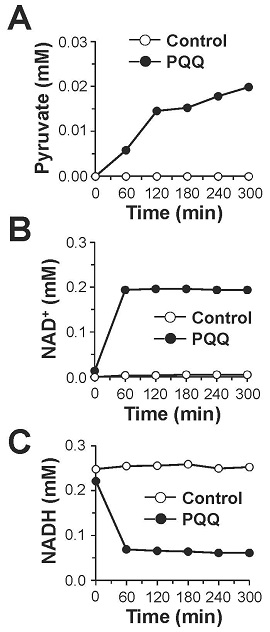
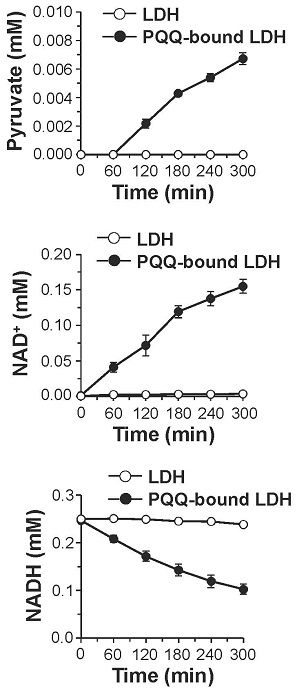
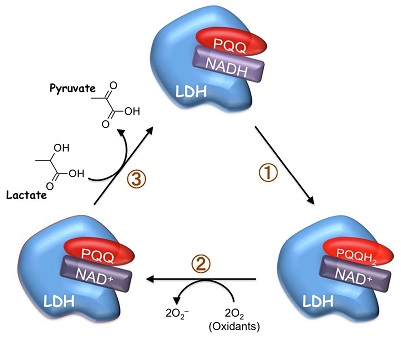
PQQは、そのo-キノン構造に起因する強い酸化力によってNADHをNAD+に酸化し、自身はPQQH2に還元されることが知られている (図8)13)。そこで、生理的条件下 (pH 7.4, 37℃) においてPQQがNADHをNAD+へ酸化するかどうかを検証した。その結果,図9に示すようにPQQ濃度依存的なNADHの減少とそれに対応したNAD+の生成が認められ、酸化還元サイクルの副産物である過酸化水素の生成も観察された。さらに、PQQ量の約5倍量のNADHの減少とNAD+の生成が認められたため、PQQが電子伝達触媒として機能することが判明した。これらの結果から、図8に示すPQQの酸化還元サイクルを介したNADHのNAD+への酸化反応がPQQによるLDH酵素反応の制御に関与している可能性が強く示唆された。この機構をより明確に検証するために、理論的には反応が進まない乳酸を基質としNADHを補酵素とする酵素反応をPQQの存在下で行った。その結果、経時的なピルビン酸の産生が認められるとともに、付随的に生成するはずのNADHが減少し、相対的にNAD+が増加する現象が確認された (図10)。さらに、PQQとLDHをインキュベートした後に透析によって遊離のPQQを除去することでPQQ-LDH複合体を調製し、同様の酵素反応を行ったところ、経時的なピルビン酸の生成とNAD+の生成が認められた (図11)。これらの結果から図12に示すように、①LDHに結合したPQQがNADHをNAD+に酸化して自身はPQQH2に還元される、②PQQH2が酸素や酸化剤の存在下でPQQに酸化されて再生する、③LDHが乳酸を基質としNAD+を補酵素とした反応を触媒してピルビン酸とNADHが生成し、①~③の反応サイクルが繰り返されることでLDHによる乳酸のピルビン酸への酸化反応 (逆反応) が促進されるという新規の分子機構が明らかになった。





6.結論
本研究では、PQQが培養線維芽細胞中のLDHを主標的として結合することを明らかにした。また、LDHと結合したPQQが酸化還元サイクルを介してNADHを酸化することによってピルビン酸の生成を促進し、乳酸の生成を抑制する新規の反応制御機構を解明した。ピルビン酸はアセチルCoAに変換された後に、TCA回路・電子伝達系で代謝されATPを産生させるため、PQQが細胞内のエネルギー生産を亢進し、ビタミン様の作用を発揮している可能性が考えられる。
文献
1) Akagawa, M., Minematsu, K., Shibata, T., Kondo, T., Ishii, T., Uchida, K.: Sci. Rep., 6, 26723 (2016).
2) Salisbury, S. A., Forrest, H. S., Cruse, W. B., Kennard, O.: Nature, 280, 843 (1979).
3) Yamada, M., Elias, M. D., Matsushita, K., Migita, C. T., Adachi, O.: Biochim. Biophys. Acta, 1647, 185 (2003).
4) Matsumura, H., Umezawa, K., Takeda, K., Sugimoto, N., Ishida, T., Samejima, M., Ohno, H., Yoshida, M., Igarashi, K., Nakamura, N.: PLoS One, 9, e104851 (2014).
5) Kleef, M. A. G., Duine, J. A.: FEBS Lett., 237, 91 (1988).
6) Kumazawa, T., Sato, K., Seno, H., Ishii, A., Suzuki, O.: Biochem. J., 307, 331 (1995).
7) Kumazawa, T., Seno, H., Urakami, T., Matsumoto, T., Suzuki, O.: Biochim. Biophys. Acta, 1156, 62 (1992).
8) Smidt, C., Bean-Knudsen, D., Kirsch, D. G., Rucker, R. B.: Biofactors, 3, 53 (1991).
9) Killgore, J., Smidt, C., Duich, L., Romero-Chapman, N., Tinker, D., Reiser, K., Melko, M., Hyde, D., Rucker, R. B.: Science, 245, 850 (1989).
10) Kasahara, T., Kato, T.: Nature, 422, 832 (2003).
11) Felton, L. M., Anthony, C.: Nature, 433, E10 (2005).
12) Rucker, R. B., Storms, D. H., Sheets, A., Tchaparian, E., Fascetti, A.: Nature, 433, E11 (2005).
13) Itoh, S., Kinugawa, M., Mita, N., Ohshiro, Y.: J. Chem. Soc., Chem. Commun., 11, 694 (1989).