【トピックス】
パスウェイエンジニアリングによる新規カロテノイドの創成
三沢典彦
石川県大・生資研
1.はじめに
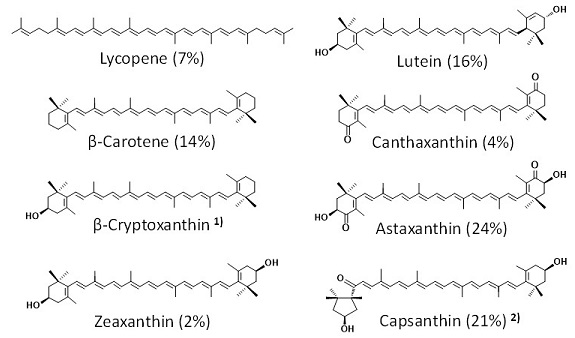
近年、カロテノイド (carotenoid) がヒトや動物の健康に有益な効果を発揮することは広く知られるようになった。さらに、その健康への有用性がカロテノイドごとに異なっていることも、次第に明らかになってきた。しかしながら、750種類以上のカロテノイドの中で、商業化されているカロテノイド (純品または純品に近いもの) は 高々10種類程度に過ぎない。これらのカロテノイドとしては、高等植物や藻類 (緑藻) 等の生物から十分な供給が可能なリコペン (lycopene)、β-クリプトキサンチン (β-cryptoxanthin)、ゼアキサンチン (zeaxanthin)、ルテイン (lutein)、アスタキサンチン (astaxanthin)、及びカプサンチン (capsanthin) が、または、安価な化学合成技術が開発されているβ-カロテン (β-carotene)、カンタキサンチン (canthaxanthin)、及びastaxanthin (ただしラセミ体) 等が挙げられる (図1)。これらを中心に一部のカロテノイドのみが、様々な機能性試験に用いられ、種々の効果が明らかにされてきた。一方、試験管レベルでの予備的な機能性試験、またはその化学構造から、健康に有用な効果が期待できるカロテノイドは数多く存在すると思われる。しかしながら、これらのカロテノイドは通常、自然界に微量にしか存在しないため、機能性試験の実施が困難である。バイオテクノロジー技術のうち、代謝工学 (metabolic engineering)、合成生物学 (synthetic biology)、またはパスウェイエンジニアリング (pathway engineering) と呼ばれる技術分野は、これらの希少カロテノイドを多量に生産する道を開くだけでなく、その化学構造から有用な機能性が期待できる新規カロテノイドの創成を行うことができる。このような研究の中で検討される生産用宿主としては、大腸菌 (Escherichia coli) が最も実績を積んでいる。様々な生物の中で大腸菌には、分子生物学的知見が最も集積しており、遺伝子組換えの技術や材料が最も豊富に存在しているのがその主たる理由であると考えられる。また、1990年以降、大腸菌内で機能発現するカロテノイド生合成酵素遺伝子が数多く見出されてきたのも、その主たる理由の1つであろう。本稿では、健康に有用な機能性が期待される新規または希少カロテノイドを、大腸菌等で生産させる研究を、筆者らの研究を中心に紹介したい。

2.パスウェイエンジニアリングとカロテノイドの生合成
2-1 イソプレノイドのパスウェイエンジニアリングと大腸菌
パスウェイエンジニアリングは、微生物や植物などの異種宿主において、遺伝子組換え等により目的化合物の生合成経路を構築する技術であり、代謝工学や合成生物学における最重要分野の一つである1)。カロテノイドは、イソプレノイド (isoprenoid;テルペン、テルペノイドとも呼ばれる) に属する色素であり、通常、炭素数が40 (C40) の基本骨格からなるので、テトラテルペン (tetraterpene) とも呼ばれる。カロテノイドを生合成 (de novo合成) する生物は、植物・藻類やシアノバクテリア・光合成細菌といったすべての光合成生物、及び一部の糸状菌・酵母や一部の細菌 (真正細菌) ・アーキア (古細菌) である。なお、細菌が作るカロテノイドの中には炭素数が30の基本骨格からなるものもある。
パスウェイエンジニアリングによるイソプレノイドの生産研究において多用されてきた2大宿主は大腸菌と出芽酵母 (Saccharomyces cerevisiae) であるが、カロテノイド生産研究においては大腸菌が圧倒的に多く用いられてきた2,3)。大腸菌は、イソプレノイドとしてユビキノンやメナキノン及びドリコールを生合成し、これらの共通の基質としてFPP (farnesyl diphosphate; C15) を有している。大腸菌はメバロン酸 (mevalonate) 経路ではなく、MEP経路 (2-C-methyl-D-erythritol 4-phosphate経路;非メバロン酸経路) により、IPP (isopentenyl diphosphate; C5) とDMAPP (dimethylallyl diphosphate; C5) を作り、FPP synthase (ispA遺伝子によりコードされる)4)によりGPP (geranyl diphosphate; C10) を経てFPPが合成される (図2)。なお、大腸菌 (野生株) は、一般的なイソプレノイドであるモノテルペン (monoterpene)、セスキテルペン (sesquiterpene)、ジテルペン (diterpene)、トリテルペン (triterpene)、カロテノイドのうち、どの生合成系も有していない。したがって、パスウェイエンジニアリングによりこれらのイソプレノイドを大腸菌に合成させるためには、GPP (モノテルペンの場合) またはFPP (残りのイソプレノイドの場合) からその化合物までの生合成を担う一連の代謝酵素遺伝子群を大腸菌に導入し、発現させる必要がある。なお、セスキテルペン、トリテルペン、C30-カロテノイドの場合、共通の最終基質はFPPであるが、ジテルペンやカロテノイドの場合、それはGGPP (geranylgeranyl diphosphate; C20) であるので、ジテルペンまたはカロテノイドを大腸菌に生合成させるためには、FPPからGGPPを作る酵素 (GGPP synthase) 遺伝子 (crtE) も同時に導入する必要がある (図2)。また、IPPとDMAPP間の異性化酵素 (IPP isomerase) をコードする外来の遺伝子[1型; idi (IDI) ]を大腸菌に導入して発現させると、イソプレノイド含量が2〜3倍上がることが知られている5)。なお、IPP isomeraseには互いに構造が異なる1型と2型6)があるが、どちらの遺伝子を大腸菌に導入しても、さらには両遺伝子を同時に導入しても増量効果がある7)。以後、特に言及しないが、本稿で紹介する筆者らが用いた組換え大腸菌にはすべて、IDI遺伝子が導入されている。
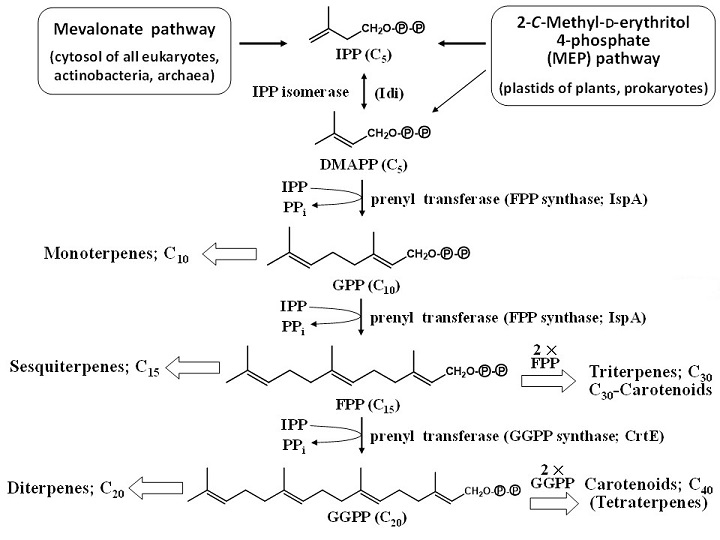
図2 代表的イソプレノイドの生合成系、及び各種プレニル二リン酸 (prenyl diphosphate) の代謝経路
2-2 カロテノイドの生合成研究の歴史
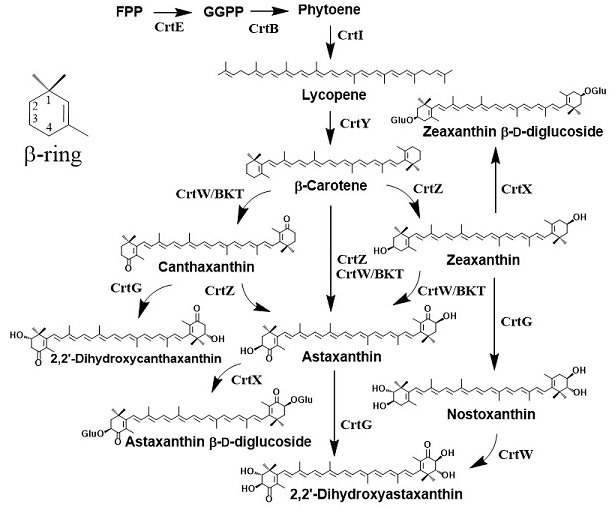
筆者がカロテノイドの生合成研究を始めた1988年当時、β-caroteneやastaxanthinの化学構造が1930年代に解明されていたことからもわかるように、カロテノイドの化学構造の解析はかなり進んでいた8)。一方、1988年当時、カロテノイドの生合成を担う酵素や遺伝子の知見はほとんど存在していなかった。未知の生合成酵素遺伝子を単離・同定するための当時の一般的手法としては、まず、活性等を指標としたクロマトグラフィー等により生合成酵素を精製し、その酵素のアミノ酸配列の一部を読み、その情報をもとにDNAプローブを設計し、コロニーハイブリダイゼーション法などにより目的の酵素遺伝子 (クローン) を吊り上げるといったものであった。ところが、カロテノイド生合成酵素の場合、すべてが膜内または膜表面に存在した形で触媒反応が可能な「膜酵素」であるため、活性を指標にした酵素の精製は実質上不可能であることが、カロテノイド生合成研究の低迷の原因であったと思われる。1989年になってようやく、最初のカロテノイド生合成酵素遺伝子の塩基配列が、光合成細菌Rhodobacter属において報告されたが、酵素 (遺伝子) の機能は未知のままであった9)。1990〜1992年に、大腸菌と同じγ-Proteobacteria綱 (class) に属するPantoea属 (当時はErwinia属に分類) 細菌が持つカロテノイド生合成酵素遺伝子群の塩基配列、及び各遺伝子 (crtE、crtB、crtI、crtY、crtZ、crtXと命名) がコードする生合成酵素の機能が解明された10,11)。これら6遺伝子がコードする各酵素 (CrtE、CrtB、CrtI、CrtY、CrtZ、CrtX) の機能は図3に示されている。すなわち、6つの酵素群はFPPを初発基質として最終産物としてzeaxanthin β-D-diglucosideを生合成する。なお、CrtY (lycopene β-cyclase) によって、最も平凡なエンドグループであるβ環を持つカロテノイド (β-carotenoidとも呼ばれる) が合成される。なお、CrtZの酵素名はβ-carotene (β-carotenoid) 3,3’-hydroxylase である。さらにこの研究は、外来遺伝子を導入することで、組換え大腸菌がGGPP (crtEの導入株)、フィトエン (phytoene; crtEとcrtBの導入株)、lycopene (crtE、crtBとcrtIの導入株)、β-carotene (crtE、crtB、crtIとcrtYの導入株)、及びzeaxanthin (crtE、crtB、crtI、crtYとcrtZの導入株) を合成可能となることを示した。このことは、これらの化合物を基質とする種々の生物由来のイソプレノイドの生合成酵素 (遺伝子) の機能解析を組換え大腸菌を用いて行うことができること (大腸菌機能解析系の構築) を意味した。実際に1992年以降、高等植物やカロテノイド産生細菌をはじめ種々のカロテノイドを生合成する生物から、カロテノイド生合成酵素遺伝子が単離され、多くの場合、単離した遺伝子の機能解析は大腸菌を用いて行われた1,12-15)。

3.大腸菌による新規または希少カロテノイド生産
3-1 β環を持つカロテノイドの生合成
1995年に、astaxanthin生合成の鍵となるβ-carotenoid 4,4’-ketolase (oxygenase) 遺伝子 (crtWと命名) が海洋性のParacoccus属細菌より単離され、大腸菌機能解析系によりCrtWの機能が同定された12)。すなわち、CrtWはβ-carotene及びzeaxanthinを基質として、それぞれ、canthaxanthin及びastaxanthinを合成した (図3)。なお、BKTは、Haematococcus pluvialis等のastaxanthin生産性の緑藻から単離されたCrtWのホモログ (オルソログ; ortholog) の名称である。crtE、crtB、crtI、crtY、crtZ及びcrtW遺伝子の導入によりastaxanthinを合成している大腸菌に、さらにcrtX遺伝子を導入すると、新規化合物であるastaxanthin β-D-diglucosideが生合成された (図3)13)。この新規カロテノイドはastaxanthinと比較して大きく水溶性が向上していた。
2005年に、β-carotenoid 2,2’-hydroxylase遺伝子 (crtGと命名) が海洋性のBrevundimonas属細菌より単離され、大腸菌機能解析系によりCrtGの機能が同定された14)。CrtGはzeaxanthin、canthaxanthin、及びastaxanthinを基質として、それぞれ、ノストキサンチン (nostoxanthin; 希少カロテノイド)、2,2’-dihydroxycanthaxanthin (新規化合物)、及び2,2’-dihydroxyastaxanthin (希少カロテノイド) を合成した (図3)。なお、nostoxanthinは食用のカモガワノリの微量成分である。本色素は、luteinと並んで、眼の黄斑に存在できるカロテノイドであるzeaxanthinの類縁体であるので、動物における生体内での動態や機能の解析に興味が持たれる。また、2,2’-dihydroxycanthaxanthinや2,2’-dihydroxyastaxanthinは、抗疲労や抗老化作用をはじめとして種々の健康に有益な機能を持つastaxanthin16)の類縁体であるので、生理機能の解析に興味が持たれる。
3-2 ε環を持つカロテノイドの生合成
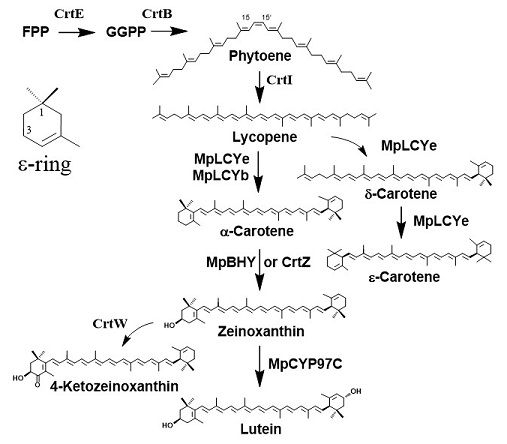
植物は、β-caroteneやzeaxanthin等のβ環のみを持つカロテノイド以外に、α-カロテン (α-carotene) やluteinといった分子内にβ環とε環を持つカロテノイドを生合成する (図4)。竹村らはゼニゴケ (Marchantia polymorpha) から、lycopene β-cyclase (CrtYのオルソログ; MpLCYb) とlycopene ε-cyclase (MpLCYe)、及びβ-carotenoid 3,3’-hydroxylase (CrtZのオルソログ; MpBHY) とε-carotenoid 3(3’)-hydroxylase (MpCYP97C) をコードする遺伝子を単離し、これらの機能を同定した (図4)15)。crtE、crtB、crtI、MpLCYe、MpLCYb、及びMpBHY (またはcrtZ) 遺伝子の導入によりゼイノキサンチン (zeinoxanthin; 希少カロテノイド) を合成している大腸菌に、さらにcrtW遺伝子を導入すると、新規化合物である4-ケトゼイノキサンチン (4-ketozeinoxanthin; 希少カロテノイド) が生合成された (図4)15)。zeinoxanthinや4-ketozeinoxanthinは、β-cryptoxanthinとよく似た構造をしており、特に後者については、その半分の構造がastaxanthin と同一であるため、動物における生理機能の解析に興味が持たれる。なお、β-cryptoxanthinは骨粗鬆症の予防作用など種々の健康に有益な効果を持つカロテノイドである17)。

4.レタスによる新規または希少カロテノイド生産
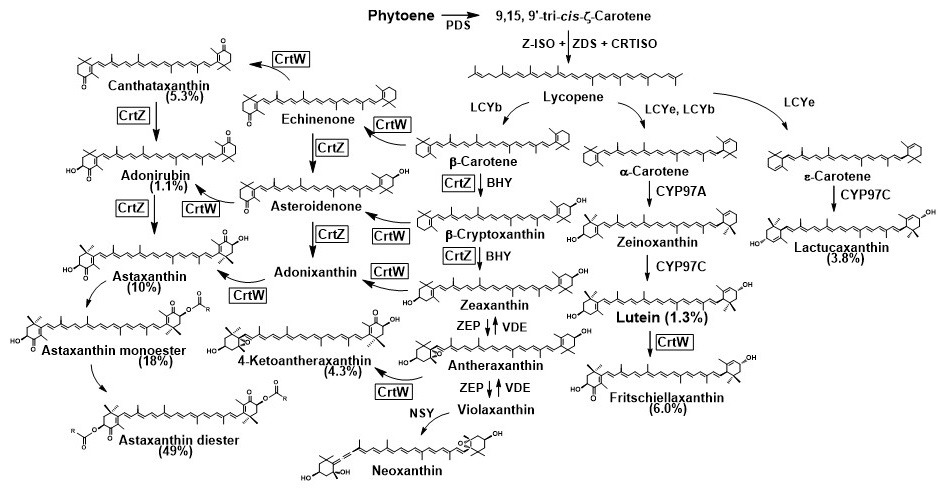
筆者らは、crtWとcrtZ遺伝子をIDI遺伝子と共に、キク科植物のレタス (Lactuca sativa) の葉緑体ゲノムに直接導入し、タバコ葉緑体由来のrrnプロモーターの下で発現させた18)。得られた葉緑体形質転換レタスは、アスタキサンチン[178μg/g湿重量 (フリー体換算; 含水率90%とすると1.78 mg/g乾重量) ; 全カロテノイドの77%]を筆頭に、フリチエラキサンチン (fritschiellaxanthin; 6%)、canthaxanthin (5.3%)、4-ケトアンテラキサンチン (4-ketoantheraxanthin; 4.3%) 等が生産されていた (図5) 18)。なお、fritschiellaxanthinはハナサキガニやアカテガニに微量含まれる希少カロテノイドであり、4-ketoantheraxanthinは新規化合物であった。fritschiellaxanthinについては、その半分の構造がastaxanthinと同一であり、さらにカルボニル基の形成によりluteinより共役二重結合が1つ増えたlutein誘導体という有望な構造をしているので、動物における生体内での動態や機能の解析に興味が持たれる。

5.おわりに
健康に有用な機能性が期待される新規または希少カロテノイドを、パスウェイエンジニアリングにより大腸菌またはレタスで生産させる研究を、筆者らの研究を中心に紹介した。これらのカロテノイドの大腸菌での生産量は特に言及しなかったが、多いものでも、数 mg/g乾重量程度であった。現在、国内外の多くの研究者が、機能性イソプレノイドを大腸菌で効率的に生産するための研究に従事している。有望な新規または希少カロテノイドについては、機能性試験用に十分に供給できるレベルまで、さらには、すでに市販されているカロテノイドの一部についても、価格競争力を発揮できるレベルまで大腸菌での生産性を上げることが、本技術の実用化・商業化に必要なことと思われる。
謝辞
ここで紹介した研究の一部は、国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)委託事業費からの支援により実施されました。
文献
1) Misawa, N.: Curr. Opin. Biotechnol., 22, 627 (2011).
2) Jiang, M., Stephanopoulos, G., Pfeifer, B. A.: Appl. Environ. Microbiol., 78, 2497 (2012).
3) Immethun, C. M., Hoynes-O’Connor, A. G., Balassy, A., Moon, T. S.: Frontiers in Microbiol., 4, 75 (2013).
4) Fujisaki, S., Hara, H., Nishimura, Y., Horiuchi, K., Nishino, T.: J. Biochem., 108, 995 (1990).
5) Kajiwara, S., Fraser, P. D., Kondo, K., Misawa, N.: Biochem. J., 324, 421 (1997).
6) Kaneda, K., Kuzuyama, T., Takagi, M., Hayakawa, Y., Seto, H.: PNAS, 98, 932 (2001).
7) Harada, H., Misawa, N.: Appl. Microbiol. Biotechnol., 84, 1021 (2009).
8) 眞岡孝至: ENEOS Technical Rev., 56, 88 (2014).
9) Armstrong, G. A., Alberti, M., Leach, F., Hearst, J. E.: Mol. Gen. Genet., 216, 254 (1989).
10) Misawa, N., Nakagawa, M., Kobayashi, K., Yamano, S., Izawa, Y., Nakamura, K., Harashima, K.: J. Bacteriol., 172, 6704 (1990).
11) Sandmann, G., Misawa, N.: FEMS Microbiol. Lett., 90, 253 (1992).
12) Misawa, N., Satomi, Y., Kondo, K., Yokoyama, A., Kajiwara, S., Saito, T., Ohtani, T., Miki, W.: J. Bacteriol., 177, 6575 (1995).
13) Yokoyama, A., Shizuri, Y., Misawa, N.: Tetrahedron Lett., 39, 3709 (1998).
14) Nishida, Y., Adachi, K., Kasai, H., Shizuri, Y., Shindo, K., Sawabe, A., Komemushi, S., Miki, W., Misawa, N.: Appl. Environ. Microbiol., 71, 4286 (2005).
15) Takemura, M., Maoka, T., Misawa, N.: Planta, 241, 699 (2015).
16) 吉川敏一, 内藤裕二 (監修): アスタキサンチンの機能と応用, シーエムシー出版 (2012).
17) Sugiura, M., Nakamura, M., Ogawa, K., Ikoma, Y., Yano, M.: PLoS ONE, 7(12), e52643 (2012).
18) Harada, H., Maoka, T., Osawa, A., Hattan, J., Kanamoto, H., Shindo, K., Otomatsu, T., Misawa, N.: Transgenic Res., 23, 303 (2014).