【トピックス】
タンパク質温度センサーによる細胞内温度分布の可視化
清中茂樹、坂口怜子
京大院・工、京大iCeMS
1.はじめに
内温動物 (恒温動物) には、外界の温度に応じて体内の温度を調節する機構が備わっている。哺乳動物においては、低温環境に対する適応メカニズムとしての熱産生が挙げられ、主に骨格筋あるいは褐色脂肪組織など特定の生体組織で起こると考えられている。しかし、詳細な熱産生機構や実際の熱産生における寄与は不明瞭な状態である。その主な原因の1つとして、生体深部あるいは細胞内の温度を計測可能な温度センサーの欠如が挙げられる。そのような背景のもと、近年、細胞内の温度計測が可能な細胞内温度計の開発が進められている。特に、光 (蛍光) を用いて細胞内温度を計測するという試みが活発に進められており、実際に細胞内の温度変化を計測可能な複数の蛍光性温度センサーが報告されている。また、細胞内温度センサーにより、これまで観察されたことのなかった細胞内温度の不均一性が確認されつつある。本小論では、非侵襲的なセンサー導入および細胞内小器官への局在化が可能なタンパク質温度センサーを中心に、細胞内温度分布の可視化に関する最近の研究動向を紹介する。
2.細胞内温度センサー
生体の温度分布可視方法として、最も広く普及している技術が赤外線サーモグラフィーである。汎用性の高い方法であるが、表面温度しか測定できず、また空間分解能が低いため、生体深部や細胞内の温度計測には不向きである。そのような背景のもと、近年、温度変化に依存した蛍光変化を示す蛍光性温度センサーが注目を集めている1)。合成小分子、無機分子、合成高分子およびタンパク質を用いた方法論が報告されている。本節では、3. (次節) で詳細に述べるタンパク質温度センサー以外の蛍光性温度センサーについて紹介する。
温度変化に伴い蛍光変化を示す金属錯体、蛍光性高分子、量子ドットを用いた温度センサーが開発されている。その代表例として、鈴木および石渡らによる金属錯体の温度依存性を利用した温度センサー2)、量子ドットの蛍光特性を利用した温度センサーが挙げられる。岡部、内山および船津らは、アクリルアミド系高分子の温度に依存した凝集特性と蛍光色素の環境依存性を利用した温度センサーを報告している3)。彼らは、蛍光性高分子の温度に依存した蛍光寿命特性を利用することで細胞質に比べて核内の温度が高いことを明らかにし、細胞内局所の温度値の算出にも成功した。温度分解能という観点では、ナノダイヤモンドを用いた温度センサーが、非常に高い温度分解能を示すことが示されている4)。しかし、上記のセンサーの多くは細胞内への透過性という面で問題を抱えており、マイクロインジェクションなど侵襲的な方法で標的細胞にセンサー分子を導入する必要があった。
高分子型温度センサーに関しては、ごく最近、カチオン性の付与などにより細胞内輸送を改善した温度センサーが開発され、非侵襲的な細胞内導入も可能になっている5)。しかし、細胞内小器官への選択的な輸送は困難である。細胞内の熱産生は特定の細胞内小器官で行われると考えられており、熱産生を計測するためには標的細胞内小器官にセンサーを選択的に集積させる必要がある。その点に関しては、蛍光性有機小分子の細胞内小器官集積性および温度感受性を利用することで、細胞内小器官の温度計測も可能となりつつある6,7)。しかし、小分子の細胞内小器官への集積は固有の化学・物理的特性 (ミトコンドリアで言えば膜電位など) を利用したものであるため、温度変化を計測するための細胞外刺激を加えた際に、センサー分子の局在が変わっていないことを慎重に確認する必要がある。また、小分子型蛍光色素の細胞内輸送効率等は細胞種や生物種により異なるという欠点もある。
3.タンパク質温度センサー
非侵襲かつ細胞内小器官の温度変化を観測する手法として、遺伝子でコードされるタンパク質温度センサーが有用と考えられる。遺伝子導入技術は様々な生物種に対して開発されているため、それらの生物種における非侵襲的な温度計測が可能となる。また、各々の細胞内小器官に対する移行シグナルも同定されており、標的とする細胞内小器官へのセンサータンパク質の局在化も可能である。このような観点から、筆者らはタンパク質ベースの温度センサーの開発に着手した8)。
著者らは、タンパク質温度センサーの構築にあたり、温度感知部位としてサルモネラ菌が有する温度依存的な転写抑制因子であるTlpAタンパク質に着目した。TlpAはN末端のDNA結合領域に加えて長いcoiled-coil領域を有しており、37℃付近で可逆的な単量体および二量体の構造変化を起こすことが知られる9)。そこで、TlpAのcoiled-coil領域を蛍光タンパク質GFPのN末端およびC末端に融合させることで、温度センサータンパク質tsGFP1を設計した。GFPは、400 nmおよび480 nmに蛍光励起極大を有し、その蛍光パターンはGFPのタンパク質構造に大きく依存することが知られる。そこで、TlpA coiled-coil領域の二量体および単量体の構造変化に伴い、tsGFP1の蛍光パターンが大きく変わることを期待した (図1a,b)。実際に、精製tsGFP1はcoiled-coilの遷移温度と同じ温度領域 (37.6℃) で大きな蛍光変化を示し、生体温度付近を厳密に検出可能な温度センサーであると言える (図1c)。
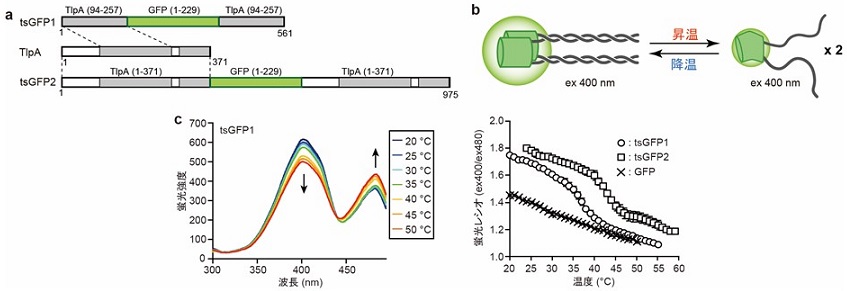

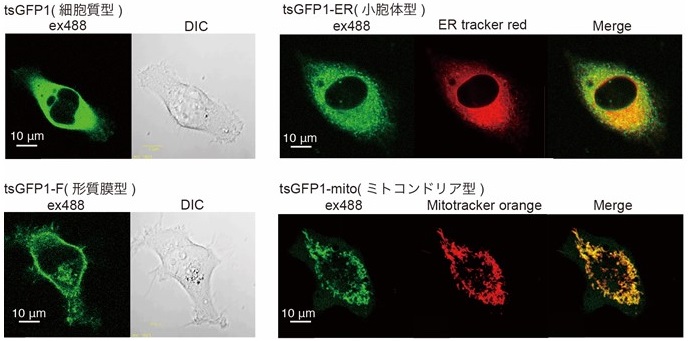
tsGFP1は哺乳動物 (HeLa) 細胞に発現させることが可能であり、細胞外液の温度を変化させた際の蛍光ライブイメージングにより、温度に依存した蛍光レシオ変化を示した。その遷移温度 (37.8℃) は精製タンパク質で得られた値とほぼ同等であり、細胞内でもcoiled-coilの解消に伴う蛍光変化を確認できることがわかった。また、細胞内小器官への局在化配列を融合することにより、形質膜、ミトコンドリア、小胞体、核に温度センサータンパク質を局在制御でき (図2)、それぞれの局在型tsGPF1が温度に依存した蛍光変化を示した8,10,11)。すなわち、それぞれの細胞内小器官に対するタンパク質温度センサーを得ることに成功した。
![]()
tsGFP型温度センサーの温度感知部位にcoiled-coilを用いる利点として、温度感知領域を変えられる点が挙げられる。TlpAは長いcoiled-coil領域に加えて短いcoiled-coil領域も存在する。そこで、長いcoiled-coil領域ではなくTlpA全長を融合させたtsGFP2を作製したところ、遷移温度が高温側 (42.3℃) にシフトし、生体温度よりも少し高温側の温度を鋭敏に感知できるセンサーを得ることに成功した (図1)。また、coiled-coil領域を短くするあるいは変異を加えることにより、低温型の温度センサーも作製できる。生物種や生命現象により観測したい温度領域が異なることが想定されるが、このようなcoiled-coilの改変により、感知温度を変更することができるのもtsGFPの利点と言える10,11)。
蛍光タンパク質を用いる他のアプローチとして、GFP単体の温度変化に依存した微弱な蛍光変化 (蛍光異方性) を利用した温度センサーが報告された12)。しかし、GFP単体の温度感受性のみを利用しており、感度という面において問題点を抱えていた。この問題点を解決すべく、中野および永井らは様々な種類の蛍光タンパク質の温度に対する蛍光特性を評価し、温度による蛍光特性および蛍光波長の異なる2つの蛍光タンパク質を組み合わせて用いて、蛍光レシオ値で温度分布を可視化する方法を開発している13)。
4.タンパク質温度センサーによる温度分布の可視化
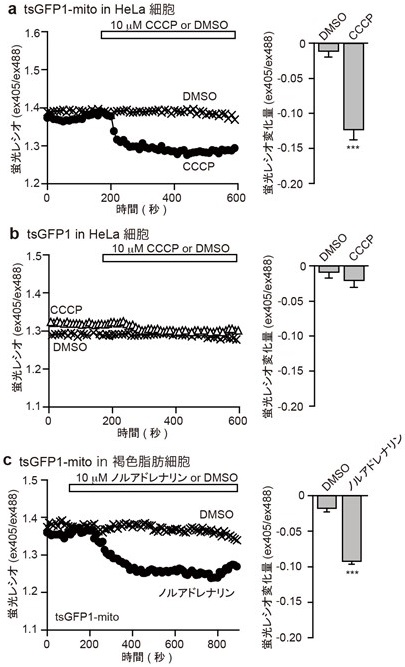
前節で述べたように、著者らはそれぞれの細胞内小器官に局在化可能なタンパク質温度センサーtsGFPを開発した。そこで、tsGFP温度センサーを用いて、細胞内の熱産生の蛍光可視化を行った。まず、ミトコンドリアにおける熱産生に着目した。哺乳動物の熱産生組織として知られる褐色脂肪組織 (細胞) においては、ミトコンドリアの膜電位をuncoupling protein1 (UCP1) が解消することで熱産生が起こることが知られる14)。また、他の培養細胞株においても、プロトンを透過させてミトコンドリア膜電位を解消する作用を有する脱共役剤 (CCCP) の添加により熱産生が起こることが知られている15)。そこで、ミトコンドリア局在型の温度センサー (tsGFP1-mito) を哺乳動物細胞 (HeLa細胞) に発現させ、脱共役剤CCCPを投与したところ、温度上昇に相当する蛍光レシオが変化した (図3a)。一方、電子伝達系阻害剤であるロテノン処置によりミトコンドリア膜電位形成を阻害した場合には、CCCP投与による蛍光変化は起こらなかった。このことから、ミトコンドリア膜電位解消に伴う熱産生を可視化できたことが示唆される。次に、褐色脂肪細胞にtsGFP1-mitoを発現させて、UCP1を活性化させるための生理的な刺激であるノルアドレナリンを投与したところ、褐色脂肪細胞からの熱産生を計測すること成功した (図3c)。
骨格筋においては、小胞体のCa2+ポンプ (Ca2+ ATPase, SERCA1) のATP分解活性が熱産生に関わることが報告されている16)。そこで、マウスC2C12細胞を分化させることで得られる筋菅の小胞体に小胞体局在型の温度センサー (tsGFP1-ER) を発現させたところ、Ca2+ポンプを介した熱産生を蛍光で可視化することに成功した。非常に興味深いことに、ミトコンドリアからの熱産生および小胞体からの熱産生のいずれにおいても、細胞質に局在化するtsGFP1を用いた際には確認できなかった (図3b)。この結果は、拡散の速い熱産生を蛍光変化として捉えるためには、熱産生が起こるその場にセンサー分子を局在化させることが必須であることを意味する。

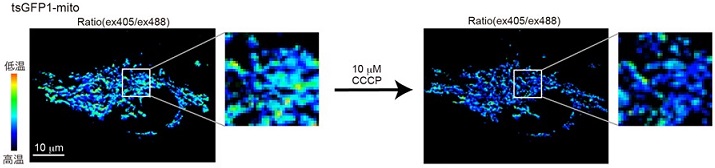
tsGFP1-mitoのHeLa細胞内における蛍光レシオ (温度) 分布を、共焦点レーザー顕微鏡を用いて詳細に解析したところ、通常の培養条件においてもミトコンドリア内に温度分布が存在することがわかった (図4)。その温度分布は、ミトコンドリア膜電位やミトコンドリアATP濃度と相関があり、ミトコンドリア温度分布がATP合成と関連していることが示唆された。ミドコンドリア膜電位蛍光プローブ (JC-1) を用いた実験結果からミトコンドリア膜電位の不均一性が報告され、ミトコンドリア機能の不均一性が提唱されている17)が、その要因あるいは生理的意義等に関しては未解明である。著者らの発見から、ミトコンドリアATP合成および熱産生も不均一であることが確認でき、tsGFP1-mitoはミトコンドリア温度分布の生理的意義解明にも今後役立つことが期待される。
![]()
5.細胞内温度変化の妥当性について
蛍光性温度センサーによって細胞内温度の不均一や熱産生の可視化が複数報告されている現状において、Baffouらは、粗視化したモデルを用いて、細胞内温度変化の不均一性や熱産生は微弱すぎて検出できないという独自の議論を展開した18)。彼らは、熱伝導度が均一の長さLで定義できる熱源に基づく巨視的な熱拡散式を用いて、細胞内の温度変化を算出した。その結果、熱産生の元になる細胞内グルコースの消費量から見積もった温度上昇は10-5℃程度であった。この値は、蛍光性温度センサーの検出限界以下であり、細胞内温度変化の計測結果を根本から否定するものであった。
しかし、著者らは上記の理論的な計算において、幾つかの致命的な問題点があると報告した19)。まず、Baffouらは、熱源のサイズLにおいて細胞の大きさに相当する10μmを用いている。均一系の巨視的熱拡散式においては、そのサイズにおいて均一な熱源であることが大前提となる。しかし、実際の細胞における熱源はタンパク質あるいはタンパク質複合体である。そのタンパク質複合体のサイズLを10 nm程度と考えると、温度上昇はサイズLに反比例するため、実際に観測されうる温度変化は、Baffouらの計算値より103℃大きくなる。更に、熱伝導率においても、計算上の問題点を抱えている。Baffouらは水の値に近い熱伝導率を算出に用いているが、細胞あるいは細胞内小器官は二分子膜で隔てられ、タンパク質濃度等が極めて高く、水の運動性も著しく失われている。このような細胞内という環境を考えると、細胞内の熱伝導率は水中より低下していると考えられる。その他にも、Baffouらの計算では1時間に一様に熱産生が起こることが前提となっている。しかし、細胞内の熱産生が1時間恒常的に起こるとは考えにくく、生体では外部刺激に応じて、秒スケールの一過的な熱産生が起こることを考慮すると、彼らの計算ではエネルギー消費量をかなり大きく見積もっていることが懸念される。
以上の結果から、Baffouらの粗視化したモデルを細胞内の温度変化に適用するのは複数の観点から問題があるというのが、著者らの結論である。これを裏付けるように、化学的な特性が異なる複数の蛍光性温度センサーを用いて、複数の研究グループによって独立に細胞内熱産生が確認されている1)。また、蛍光検出ではなく、マイクロカンチレバーを用いて細胞内の温度変化計測にも成功している例があること20)なども踏まえると、細胞内温度は不均一性であると考えるのが妥当と言えよう。今後は、それを物理化学的に証明するために、均一系で適用できる巨視的な熱拡散式ではなく、細胞内環境も反映したシミュレーション研究が必要とされる。
6.おわりに
本小論では、主にタンパク質温度センサーに関して最近の研究展開を概観した。特に、著者らが示したように、タンパク質温度センサーを用いることで、細胞内局所で発生する熱量変化を可視化できる。温度生物学に関しては主に内温 (恒温) 細胞を用いた研究が主流であるが、外温 (変温) 動物における熱制御機構なども非常に興味深く、今後は様々な生物種に対する温度分布およびその生理的意義が明らかになることが期待される。
生物種全般において、温度という物理パラメーターは、酵素反応を含む様々な生化学反応からタンパク質の構造変化まで大きな影響を及ぼす。最近見出されつつある細胞内温度分布の不均一性は、細胞生物学に対して新たな価値観をもたらす可能性を秘めている。
謝辞
本研究は、京都大学工学研究科 合成・生物化学専攻 森研究室にて行われた研究成果であり、森泰生教授および研究室メンバーに心から感謝いたします。また、本研究を行うにあたり、サルモネラ菌由来のプラスミドをご分与いただきました北里大学 岡田先生、褐色脂肪細胞の単離・培養をご教授いただきました滋賀医科大学 尾松先生、熱拡散に関する物理化学的な解釈に関してご教授いただきました京都大学 吉崎先生をはじめとした共同研究者の皆様にもこの場を借りて深くお礼を申し上げます。
文献
1) Sakaguchi, R., Kiyonaka, S., Mori, Y.: Curr. Opin. Biotechnol., 31, 57 (2015).
2) Suzuki, M., Tseeb, V., Oyama, K., Ishiwata, S.: Biophys J., 92, L46 (2007).
3) Okabe, K., Inada, N., Gota, C., Harada, Y., Funatsu, T., Uchiyama, S.: Nat. Commun., 3, 705 (2012).
4) Kucsko, G., Maurer, P. C., Yao, N. Y., Kubo, M., Noh, H. J., Lo, P. K., Park, H., Lukin M. D.: Nature, 500, 54 (2013).
5) Hayashi, T., Fukuda, N., Uchiyama, S., Inada, N.: PLoS ONE, 10, e0117677 (2015).
6) Arai, S., Suzuki, M., Park, S. J., Yoo, J. S., Wang, L., Kang, N. Y., Ha, H. H., Chang, Y. T.: Chem. Commun., 51, 8044 (2015).
7) Arai, S., Lee, S. C., Zhai, D., Suzuki, M., Chang, Y. T.: Sci. Rep., 4, 6701 (2014).
8) 森 泰生, 清中茂樹, 新見大輔: 特願2006-156099号、国際公開WO2007/142208
9) Hurme, R., Berndt, K. D., Normark, S. J., Rhen, M.: Cell, 90, 55 (1997).
10) Kiyonaka, S., Kajimoto, T., Sakaguchi, R., Shinmi, D., Omatsu-Kanbe, M., Matsuura, H., Imamura, H., Yoshizaki, T., Hamachi, I., Morii, T., Mori, Y.: Nat. Methods, 10, 1232 (2013).
11) 坂口怜子, 森 泰生, 未発表データ
12) Donner, J. S., Thompson, S. A., Kreuzer, M. P., Baffou, G., Quidant, R.: Nano Lett., 12, 2107 (2012).
13) Nakano, M., Arai, Y., Kotera, I., Okabe, K., Kamei, Y., Nagai, T.: PLoS One, 17, e0172344 (2017).
14) Cannon, B., Nedergaard, J.: Physiol. Rev., 84, 277 (2004).
15) Paulik, M. A., Buckholz, R. G., Lancaster, M. E., Dallas, W. S., Hull-Ryde, E. A., Weiel, J. E., Lenhard, J. M.: Pharm Res., 15, 944 (1998).
16) Meis, L., Arruda, A. P., Carvalho, D. P.: Biosci. Rep., 25, 181 (2005).
17) Kuznetsov, A. V., Margreiter, R.: Int. J. Mol. Sci., 10, 1911 (2009).
18) Baffou, G., Rigneault, H., Marguet, D., Jullien, L.: Nat. Methods, 11, 899 (2014).
19) Kiyonaka, S., Sakaguchi, R., Hamachi, I., Morii, T., Yoshizaki, T., Mori, Y.: Nat. Methods, 12, 801 (2015).
20) Sato, M. K., Toda, M., Inomata, N., Maruyama, H., Okamatsu-Ogura, Y., Arai, F., Ono, T., Ishijima, A., Inoue, Y.: Biophys. J., 106, 2458 (2014).