【トピックス】
果実様香気成分を高含有する清酒の開発
高橋俊成
菊正宗酒造株式会社
1.はじめに
清酒の消費は低迷を続けているが、大吟醸酒や純米酒の人気の高まりとともに、日本酒に関心を持つ人が増えてきた。特に大吟醸酒に対する関心度は高い。大吟醸酒は、玄米を50%以下まで磨き、低温でじっくり発酵させることにより、雑味の少ない綺麗な酒質となる。また香りの面では、酵母がつくりだす果実様の香気、いわゆる吟醸香を特徴とする。吟醸香の主要成分は、酵母によって生合成されるバナナ様の香りを呈する酢酸イソアミルと、リンゴ様の香りを呈するカプロン酸エチルであり、これら吟醸香成分の生合成は原料米の外層部に由来する不飽和脂肪酸によって阻害されることが知られている1,2)。したがって、吟醸香の多い清酒を醸造するためには、高精白米の利用が欠かせない。さらに低温で長期間の発酵が必要なため、手間とコストがかかり、高価格な商品となる。一方、高精白すると、原料米に由来する米の旨み成分は減少することになる。もし、低精白米を用いて吟醸香を高生産する酵母変異株を育種できれば、米本来の旨みと果実様の吟醸香を併せ持ち、かつ懐にやさしい清酒醸造が可能となるであろう。本稿では、低精白米を用いた清酒醸造において、吟醸香成分を高生産する酵母変異株の育種に成功し、商品化に至った取り組みを紹介したい。
なお、本文に入る前に誤解を招かないように米の精白度について触れておく。米を磨く度合いに「精米歩合」という表現があるが、精米歩合とは、玄米が白米になる割合であるため、高精白米の精米歩合は低くなり、あまり精米をしていない低精白米は逆に精米歩合は高くなる。
2.酢酸イソアミル高生産性酵母変異株の育種とその特性解析
酢酸イソアミルは、イソアミルアルコールとアセチル-CoAを基質とし、アルコールアセチルトランスフェラーゼ (AATase) によって酵母菌体内で生合成される。AATaseをコードする主要な遺伝子はATF1であり、ATF1およびΔ-9脂肪酸不飽和化酵素をコードするOLE1の発現は、Mga2pを介して協調的に活性化される (図1) が、この転写活性化機構は不飽和脂肪酸によって抑制を受ける。そこで、酢酸イソアミルを高含有する清酒の効率的な醸造方法の確立を目指して、不飽和脂肪酸によるATF1の発現抑制が解除された変異株を育種した。
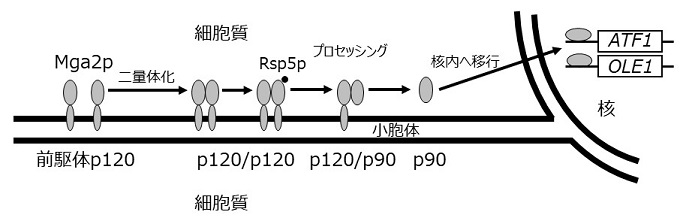
図1 ATF1、OLE1発現制御機構
2-1 酢酸イソアミル高生産酵母変異株の育種
フィトセラミドからグリセロリン脂質への代謝に関与する長鎖脂肪酸アシル-CoA合成酵素をコードするFAA1、FAA4の二重破壊株では、不飽和脂肪酸によるOLE1の発現抑制が緩和されることが知られている3)。このことは、スフィンゴ脂質代謝経路とOLE1発現が関連することを示唆しており、スフィンゴ脂質代謝経路に異常をきたす変異株の中に不飽和脂肪酸によるATF1の発現抑制が解除される変異株が存在すると考えた。そこで、イノシトールホスホリルセラミド合成酵素の阻害剤であるオーレオバシジンA (AbA) に耐性を示す変異株の中から、酢酸イソアミル高生産株を選抜した。
清酒酵母Km97株 (きょうかい9号酵母泡なし株由来アルギナーゼ欠損株) に突然変異を誘発し、得られたAbA耐性株428株について発酵試験および精米歩合70%の清酒小仕込み試験を行い、製成酒の酢酸イソアミル濃度が親株の2.6倍以上となるhia (high isoamyl acetate) 株を4株 (hia1, 2, 4, 6株) 取得した。そこで4株の中で製成酒の官能評価が最も高かったhia1株についてさらに詳細な解析を行った。
2-2 hia1株におけるAATase活性およびATF1の発現制御
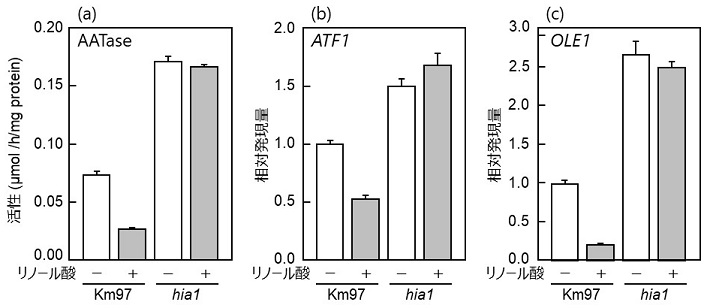
hia株の酢酸イソアミル高生産能はAATaseの活性化に起因すると考えられる。そこで、リノール酸添加または無添加の最小培地で培養した菌体を用いて、無細胞抽出液のAATase活性測定およびRT-qPCRによるATF1の発現解析を行ったところ、リノール酸無添加の場合、hia1株のAATase活性はKm97株に比べ2倍以上高い値を示した (図2a )。さらにリノール酸の添加によりKm97株ではAATase活性が顕著に低下するのに対して、hia1株では活性の低下は認められず (図2a)、恒常的にAtf1pが生合成されることが明らかとなった。またATF1の発現量についても同様の傾向を示した (図2b)。これらの結果は、hia1株では不飽和脂肪酸によるATF1の発現抑制が解除され、恒常的に発現する結果、酢酸イソアミル生合成能が向上したことを示唆している。さらにOLE1の発現についてもATF1と同様の挙動を示した (図2c) ことから、hia1株においてATF1とOLE1に共通するMga2pを介した転写機構に変異が生じていると考えられた。

2-3 hia1株の全ゲノムDNA解析
hia1株のATF1のORFおよびプロモーター領域の塩基配列を調べたところ、親株と同じ配列であり、またFAA1、FAA4にも変異点は存在していなかった。そこで、酢酸イソアミル高生産のメカニズム解明のためhia1株の全ゲノムDNA解析を行うことにした。DNAシーケンサーIllumina HiSeq 2000を用いて、親株であるKm97株およびhia1株の塩基配列を解析し、hia1株における一塩基多型を抽出したところ、MGA2のORF領域に変異箇所が存在することを見いだした。すなわち、Km97株ではMGA2の2,117番目の塩基がヘテロ接合型 (C/A) であるが、hia1株ではホモ接合型変異 (A/A) に変化することにより、アミノ酸配列706番目のセリンが終止コドンにホモ接合型で変異 (Ser706*) していることが明らかになった (図3)。
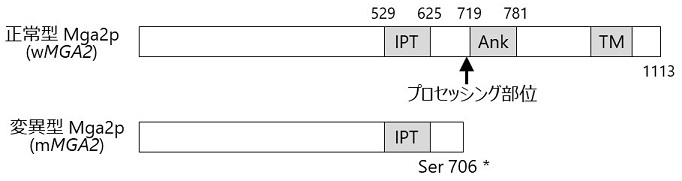
![]()
なお、独立したスクリーニングにより得られたhia1, 2, 4, 6株のMGA2のORF領域にも、hia1株と同様の変異が存在するか調べた。その結果、いずれの株においてもホモ接合型ナンセンス変異 (Ser706*) が生じていた。
2-4 MGA2ナンセンス変異がATF1発現に及ぼす影響
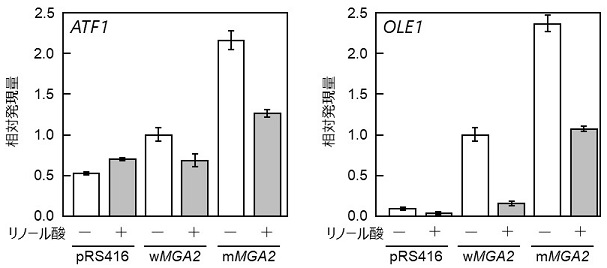
MGA2ナンセンス変異 (Ser706*) がATF1の発現量を増加させるか、さらに不飽和脂肪酸によるATF1の発現抑制を解除できるか検討することにした。実験室酵母BY4743株のMGA2破壊株に図3に示すKm97株由来正常型MGA2 (wMGA2) またはhia1株由来ナンセンス変異型MGA2 (mMGA2) をプラスミドを用いて1コピー導入し、RT-qPCRによるATF1およびOLE1の発現解析を行ったところ、mMGA2の導入により両遺伝子の発現量の増加が認められた (図4)。一方、hia1株では両遺伝子の発現量は不飽和脂肪酸による抑制を受けなかったが、mMGA2導入株では部分的に抑制された (図4)。このような部分的な抑制が起こる原因としては、清酒酵母と実験室酵母の遺伝学的背景の違いやMga2pとは別の要因が関与している可能性が考えられる。

3.カプロン酸エチル高生産性酵母変異株の育種とその特性解析
カプロン酸エチルの生合成経路は、アセチル-CoAとマロニル-CoAを出発物質とする脂肪酸合成経路上の中間体であるカプロン酸とエタノールを基質としてエステラーゼにより生合成される経路と、カプロイル-CoAとエタノールを基質としてアシル-CoA:エタノール O-アシルトランスフェラーゼ (AEATase) により生合成される経路が知られている (図5)。これまでに、脂肪酸合成酵素阻害剤セルレニンに耐性を示す酵母変異株では、脂肪酸合成酵素のαサブユニットをコードするFAS2に変異が生じることにより、菌体内のカプロン酸量が増加するとともにカプロン酸エチルの生産量も増加することが知られている4)。また、カプロン酸の高生産に関しては、FAS1 (脂肪酸合成酵素のβサブユニット) およびFAS2を高発現させることにより、その生産量が増加することが報告されている2)。さらにCryptococcus neoformansでは、Mga2pがFAS1の転写を制御している5)ことから、MGA2ナンセンス変異 (Ser706*) がFAS1やFAS2の発現量を高めることにより、hia1株においてカプロン酸の生合成能が向上している可能性がある。もしそうであれば、カプロン酸生成能が向上しているhia1株にセルレニン耐性を付与することにより、低精白米仕込みにおいてもカプロン酸エチルを高生産できると考えた。
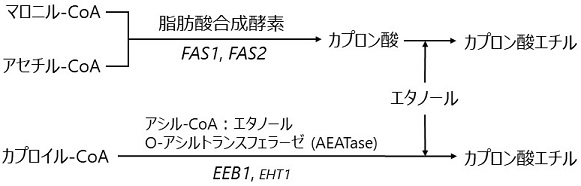
図5 カプロン酸エチル生合成経路
3-1 MGA2ナンセンス変異 (Ser706*) がカプロン酸生成量に及ぼす影響
精米歩合70%の原料米を用いて仕込んだ清酒醪 (もろみ) より回収した酵母菌体を用いて、RT-qPCRによるFAS1およびFAS2の発現解析および菌体内カプロン酸含量の測定を行ったところ、hia1株において両遺伝子の発現量および菌体内カプロン酸含量が増加していることが明らかとなった。さらに、図3に示すmMGA2を導入した実験室酵母BY4743株のMGA2破壊株では、FAS1およびFAS2の発現量の増加が認められたことから、MGA2のナンセンス変異 (Ser706*) がFAS1やFAS2の発現量を高めることが明らかとなった。
3-2 カプロン酸エチル高生産酵母変異株の育種
hia1株ではカプロン酸生成能が向上していたことから、この株にセルレニン耐性を付与することにした。hia1株に突然変異を誘発し、得られたセルレニン耐性株44株について発酵試験および精米歩合70%の清酒小仕込み試験を行い、製成酒のカプロン酸エチル濃度が親株の9倍以上になる変異株hec (high ethyl caproate) 株を3株 (hec2, 3, 6株) 取得した。hec株の製成酒では、カプロン酸エチル濃度は親株に比べ増加したが、一方で酢酸イソアミル濃度は低下していた。しかし市販の清酒に比べ明らかに高い値を示したことから、これらhec株を用いることにより、低精白米を用いてもカプロン酸エチルおよび酢酸イソアミルの両成分を高含有する清酒醸造が可能となった。そこで3株の中で製成酒の官能評価が最も高かったhec2株についてさらに詳細な解析を行った。
3-3 FAS2変異以外の要因がカプロン酸エチル高生産能に寄与する可能性
hec2株のFAS2配列を調べたところ、これまでの報告6)と同様の開始コドンから3,748番目のGがAに置換される優性変異 (Gly1250Ser) がホモ接合型で生じていた。しかしながら、hec株を用いた製成酒のカプロン酸エチル濃度は、広く一般的に吟醸造りに使用されているヘテロ接合型FAS2変異 (Gly1250Ser) 株 (きょうかい酵母K1801株) の場合に比べ著しく高いことから、カプロン酸エチル高生産能を付与するFAS2変異以外の因子も関与すると考えた。そこで、hia1株に人為的にホモ接合型のFAS2変異を導入した形質転換体を用いて清酒小仕込み試験を行ったところ、製成酒のカプロン酸エチル含量はhec2株のそれには遠く及ばなかった。したがって、hec2株で見られるカプロン酸エチル高生産能にはFAS2変異以外の因子が関与すると考えられる。
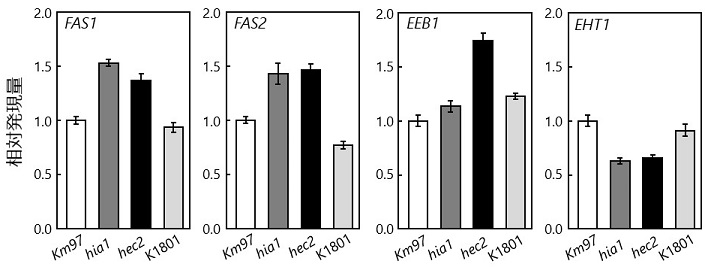
3-4 カプロン酸エチル生合成経路関連遺伝子の発現解析
FAS2変異以外の要因を探るため、精米歩合70%の原料米を用いて仕込んだ清酒醪より回収した酵母菌体を用いて、カプロン酸エチル生合成経路に関連する遺伝子のRT-qPCRによる発現解析を行った。hec2株では、FAS1、FAS2に加え、カプロイル-CoAとエタノールからカプロン酸エチルを生合成するAEATase (O-アシルトランスフェラーゼ) をコードする主要な遺伝子EEB1も高発現していた (図6)。またカプロイル-CoAとエタノールを基質としてAEATase活性を測定したところ、活性の増加も確認できた。

3-5 hec2株の全ゲノムDNA解析
さらにhec2株のカプロン酸エチル高生産能の原因を探るため、hec2株の全ゲノムDNA解析を行い、hia1株とhec2株間の一塩基多型を抽出した。その結果、ヘテロ接合型ミスセンス変異は92遺伝子中に93箇所 、ホモ接合型のミスセンス変異はFAS2変異 (Gly1250Ser) を含む27箇所検出された。興味深いことにFAS1にもホモ接合型のミスセンス変異 (Gly909Arg) が生じていた。その他にヘテロ接合型およびホモ接合型のナンセンス変異がそれぞれ1箇所ずつ検出された。
以上の結果より、hec2株においてカプロン酸エチル生産能が向上した原因は、カプロン酸エチル高生産能を付与する既知のFAS2ミスセンス変異 (Gly1250Ser) に加え、AEATaseをコードする主要な遺伝子EEB1が高発現し、酵素活性が増大したことも挙げられる。EEB1の発現量の増加は、FAS1、FAS2の発現量の増加およびFAS2変異に伴い、基質となるカプロイル-CoAの生成量が増加したためと考えられる。さらにFAS1のホモ接合型ミスセンス変異 (Gly909Arg) もカプロン酸エチル生合成能の向上に寄与している可能性があるが、この点については今後検討の余地を残している。
4.低精白米を用いた吟醸香成分含量が高い清酒の実用化
hec2株を用いて、菊正宗酒造株式会社菊栄蔵にて、精米歩合70%、総米6tの純米酒醸造を行い、製成酒を商品化処理 (ろ過→殺菌→ 4ヶ月貯蔵後→再度ろ過→殺菌) した後、香気成分分析を行った。その結果、カプロン酸エチル濃度は精米歩合70%の市販酒に比べて顕著に高く、精米歩合50%以下の高精白米を用いた大吟醸酒と同程度の高い値を示した。また、酢酸イソアミル濃度も既存の市販酒の酢酸イソアミル濃度に比べ顕著に高い値を示した (図7)。以上の結果より、hec2株を用いて醸造した清酒を純米酒「香醸」、普通酒「しぼりたてギンパック」として商品化した。なお、「しぼりたてギンパック」は、大吟醸酒や吟醸酒に混じり、普通酒として2017年度の「ワイングラスでおいしい日本酒アワード」メイン部門の最高金賞 (出品酒324品のうち18品) を受賞した。
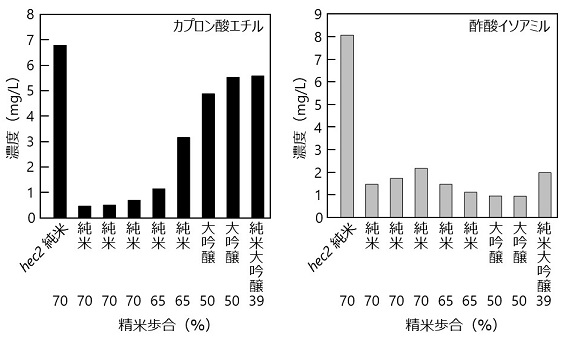
図7 hec2純米酒と市販酒の吟醸香成分量の比較
5.おわりに
大吟醸酒の人気が高まるなか、清酒業界では米の磨き競争が激しさを増している。確かに高精白することにより綺麗ですばらしい酒質になるのだが、磨きすぎるともったいない、と考えてしまうのは筆者だけであろうか。清酒は嗜好品であるという観点に立てば、磨きにこだわらない香り高いお酒があっても良いのではないだろうか。これからも「酒創り」という観点に立って、清酒の可能性を追求したいと思う次第である。
謝辞
本研究は菊正宗酒造株式会社総合研究所にて、多くの方々にご指導、ご協力を頂いて行われたものです。共同研究者の方々をはじめお世話になった皆様に心より感謝申し上げます。特にゲノム解析については、岩手大学 下飯 仁 教授ならびに奈良先端科学技術大学院大学 渡辺大輔 助教に心より感謝いたします。
文献
1) Fujii, T., Kobayashi, O., Yoshimoto, H., Furukawa, S., Tamai, Y.: Appl. Environ. Microbiol., 63, 910 (1997).
2) Furukawa, K., Yamada, T., Mizoguchi, H., Hara, S.: J. Biosci. Bioeng., 95, 448 (2003).
3) Choi, J. Y., Stukey, J., Hwang, S. Y., Martin, C. E.: J. Biol. Chem., 27, 3581 (1996).
4) Ichikawa, E., Hosokawa, N., Hata, Y., Abe, Y., Suginami, K., Imayasu, S.: Agric. Biol. Chem., 55, 2153 (1991).
5) Kraus, P. R., Boily, M. J., Giles, S. S., Stajich, J. E., Allen, A., Cox, G. M., Dietrich, F. S., Perfect, J. R., Heitman, J.: Eukaryot. Cell, 3, 1249 (2004).
6) Inokoshi, J., Tomoda, H., Hashimoto, H., Watanabe, A., Takeshima, H., Omura, S.: Mol. Gen. Genet., 244, 90 (1994).