【トピックス】
アリル炭化水素受容体と分子シャペロンHSP90複合体構造の解明
工藤 生、伊藤英晃
秋田大院・理工、秋田大院・理工
1.はじめに
アリル炭化水素受容体 (AhR) は、枯葉剤に含まれる2,3,7,8-テトラクロロジベンゾ-1,4-ジオキシン (TCDD) に代表される多環芳香族炭化水素 (PAHs) や、ポリ塩化ビフェニル (PCBs) をリガンドとする核内受容体スーパーファミリーの一員である。TCDDの他にも3-メチルコラントレン (3-MC) やβ-ナフトフラボン (β-NF) が毒性リガンドとして調べられている1)。細胞質内において、AhRは分子シャペロンHSP90やコシャペロンp23、XAP2と複合体を形成している。リガンドと結合後、AhRは核内に移行し、HSP90複合体から解離してAryl hydrocarbon receptor nuclear translocator (ARNT) とヘテロ2量体を形成し、Xenobiotic responsible element (XRE) に結合し、薬物代謝酵素シトクロムP450 1A1 (CYP1A1) の転写を誘導する。CYP1A1はリガンドを酸化し水溶性にして代謝しようと働くが、その結果かえってリガンドが毒性を強めたり、代謝経路で発生する活性酸素種がDNAダメージを与えたりすることにより、発がん性を提示するなどの悪影響も大きい。AhRはN末端側のbasic-helix-loop-helix/Per-Arnt-Sim (bHLH/PAS) ドメイン構造およびC末端側のグルタミンに富んだ転写活性化ドメイン (TAD) を持つ (図1)。bHLHドメインは核移行シグナル (NLS) と核外搬出シグナル (NES) を含み、細胞質-核間のシャトリング制御に関わっているほか、DNA上のXREに結合すること、ARNTとの2量体化に関わることが明らかになっている。また、HSP90との結合部位となることも示唆されている。PASドメインはリガンドとの結合やHSP90との結合に関わることが分かっている。HSP90はATP結合部位とATPase活性をもつNドメイン、中間のMドメイン、ホモ2量体化のためのCドメインからなる2)。HSP90のクライアントタンパク質は300種類以上とも言われ、一般にHSP90はATP結合によりオープンフォームからクローズドフォームへの立体構造変化を伴い、分子シャペロンとしての機能を呈する3)。これまでの研究から、細胞内やマウスにおけるAhR-HSP90複合体の薬物代謝作用機序やAhRによる毒性提示機構はよく解明されてきた4)。しかしAhRとHSP90との結合様式の解明については、グルタミンリッチなTADが大腸菌に及ぼす毒性や、発現後のAhRが不安定であることから、全長AhRの精製が困難なため十分になされていないのが現状である。また、リガンドが結合したAhR-HSP90複合体が細胞質から核内へと移行する際に、AhRからHSP90がどの段階で解離するのか、p23とXAP2が同時に核移行しているのかどうかということに関しても疑問が残ったままである。筆者らは in vitro でのAhRの各ドメインおよびHSP90の各ドメインの発現・精製法を確立してきた。本稿ではそれらを用いた、AhR-HSP90複合体の構造およびリガンド結合様式の解明について概説する。

図1 アリル炭化水素受容体 (AhR) のドメイン構造
2.AhR-PASドメインとHSP90結合の構造決定
初めに筆者らは、タグなしのAhR-PASドメイン、Hisタグ融合AhR-PAS,およびGSTタグ融合AhR-PASの発現・精製を試みた。その中でGST-AhR-PASのみが唯一発現・精製に成功したため、これを使用していくこととした。GST-AhR-PASドメインを用いて、リガンドとの結合およびHSP90との結合をβ-NFアフィニティ−樹脂カラム、およびグルタチオンアフィニティー樹脂カラムを用いたプルダウンアッセイでそれぞれ検討した。GST単独もしくはGST-AhR-PASをβ-NFアフィニティ−樹脂カラムに添加し洗浄した後には、GST-AhR-PASのみが溶出できた。また、精製HSP90とGSTもしくはHSP90とGST-AhR-PASをグルタチオンアフィニティー樹脂カラムに添加し洗浄した後には、GST-AhR-PASとともにHSP90が溶出できた。これらのことから、筆者らのGST-AhR-PASドメインの発現・精製は、リガンド結合およびHSP90結合の点から正しく行われていることが分かった。さらにGST-AhR-PASとHSP90との結合について調べるために、ATPおよび17- (Dimethylaminoethylamino) -17-demethoxygeldanamycin (17-DMAG) 存在下で、同様にGSTプルダウンアッセイを行った。17-DMAGはHSP90-NドメインのATP結合サイトに結合し、ATPase活性を阻害する。その結果、GST-AhR-PASとHSP90の結合はATPによる影響は受けなかった。一方、17-DMAG存在下ではGST-AhR-PASのみが溶出され、HSP90はほとんど溶出されなかったことから、GST-AhR-PASとHSP90の結合は17-DMAGにより阻害されることが分かった (図2)。このことから、AhR-PASドメインとHSP90との結合は、ATPase活性をもつHSP90-Nドメインによるものであることが考えられた。筆者らは次にPASドメインがリガンドと結合した条件下でも、HSP90との結合能を有するのかどうか検討した。GSTもしくはGST-AhR-PASをβ-NFとインキュベートした後、HSP90をATP存在下・非存在下で加え、GSTプルダウンアッセイを行った (図3)。その結果、PASドメインとHSP90との結合は、PASドメインとリガンド結合の前後に左右されず結合状態を維持できるということが、新しい知見として得られた5)。
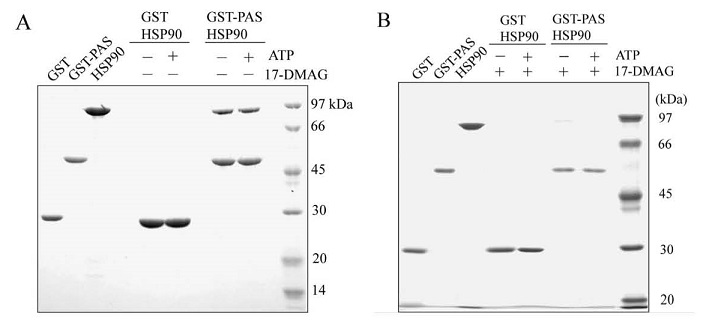
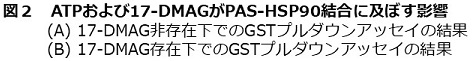
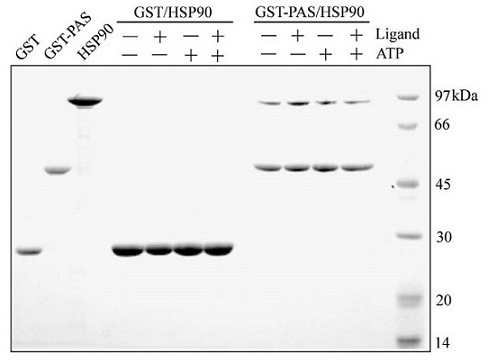
図3 リガンド反応後のPASドメインとHSP90のGSTプルダウンアッセイの結果
3.AhR-bHLHドメインとHSP90結合の構造決定
次に筆者らは、PASドメインと同様にHSP90との結合に関わるとされる6)、AhR-bHLHドメインについての結合様式の確定を試みるため、GST-AhR-bHLHドメインを精製した。精製したGST-AhR-bHLHドメインは、蛍光ラベルしたXREの塩基配列を用いたゲルシフトアッセイにて、電気泳動の移動度がシフトしたことから、XRE結合能を有することを確認した (図4)。そこで、GSTとHSP90もしくはGST-AhR-bHLHとHSP90をインキュベートした後、グルタチオンアフィニティー樹脂カラムを用いたプルダウンアッセイを行った結果、GST-AhR-bHLHとともにHSP90が溶出できた。このことからAhR-bHLHドメインもHSP90と直接結合できることが示された。さらに同様の実験をATPと17-DMAGの存在下・非存在下で行った (図5)。この結果から、bHLHドメインとHSP90の結合は、ATPおよび17-DMAGの影響を受けないことが明らかになった。さらにbHLHドメインとHSP90の結合様式を調べるため、筆者らはHSP90のN、M、C、ΔN、ΔM、ΔCドメインを精製し、GST-AhR-bHLHと各HSP90ドメインをインキュベートした後、GSTプルダウンアッセイを行った。この結果、GST-AhR-bHLHとともにHSP90-Nドメイン、-ΔMドメイン、-ΔCドメインが溶出された。またこのとき、これらの結合はATPの影響を受けなかった。したがって、AhR-bHLHドメインはHSP90-Nドメインと直接結合することが明らかになった7)。
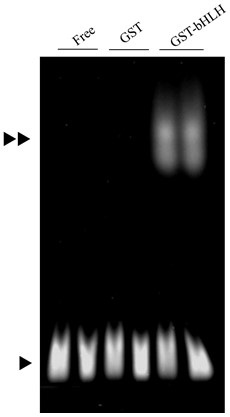
図4 GST-AhR-bHLHのゲルシフトアッセイの結果
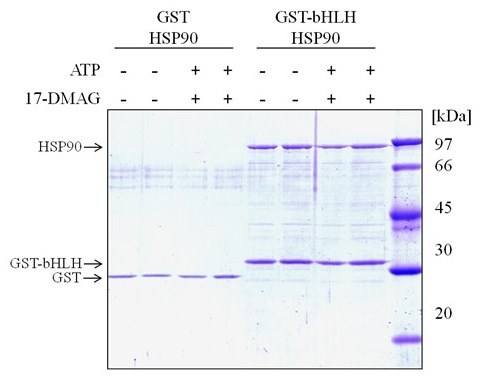
図5 ATPおよび17-DMAGがbHLH-HSP90結合に及ぼす影響
4.AhR-HSP90複合体の構造決定
以上の知見から、筆者らはAhR-HSP90複合体の構造モデルの構築を試みた。AhR-PASドメインとHSP90は結合するが、17-DMAGの存在により結合が阻害される。AhR-bHLHドメインはHSP90-Nドメインと結合し、17-DMAGの影響は受けない。これらのことと、図1で示したAhRドメイン構造およびHSP90ドメイン構造を照らし合わせると、AhR-bHLHはHSP90-NドメインのMドメイン近傍で結合し、AhR-PASドメインはHSP90-NドメインのATP結合部位があるN末端側で結合していることが推察される。加えてp23、XAP2の結合について調べると、p23、XAP2はHSP90を介してAhRと複合体を形成しており、p23はHSP90-Nドメイン、-Mドメインに結合する。XAP2はHSP90-Cドメインに結合している。これらをまとめたモデルが図6 (左図) である7)。リガンド結合部位であるAhR-PAS-BはHSP90のN末端より少し外側に位置しているため、リガンド結合とAhR-HSP90の結合順序に影響を及ぼさないのではないかと考えられる。リガンドが結合すると立体構造が微妙に変化してAhR-bHLHドメイン内のNLSが露出し (図6右図) 、インポーチンに認識されて核内へ移行することが考えられる。
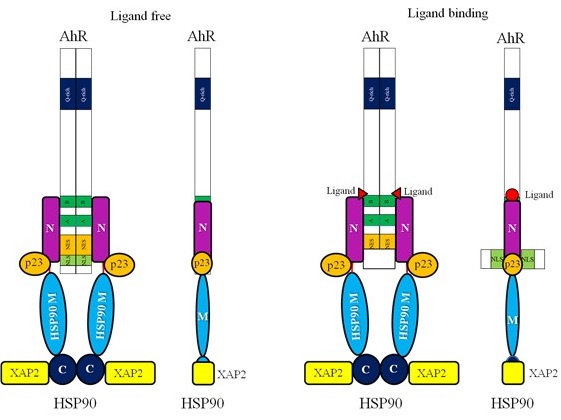
![]()
5.おわりに
このように、最近までほとんど進展の見られなかったAhR-HSP90複合体構造についての解析も、安定なAhRの精製法を確立しつつあることで、今後さらなる研究が進むと期待できる。AhRは多様なリガンドに対応していることもあり、我々のまだ知らない機能を有している可能性がある。最近ではAhRの持つ機能の1つとして、抗炎症作用などの免疫賦活化作用が報告されてきている8,9)。これは従来のAhRの薬物代謝機構とはまた別のシグナル伝達系への関与を示唆しており、AhR/CYP1A1によるリガンドの毒性を軽減できれば、有益な治療薬開発などの応用に繋がることとなるだろう。そのような観点からも、リガンドの違いによるAhR-HSP90複合体の構造変化、活性化機構の違いの解明が求められている。最近筆者らも内因性リガンドと外来性毒性リガンドでのAhRの構造体組成の違いを見出したので、鋭意研究を進めている。
謝辞
以上の成果は、秋田大学大学院理工学研究科、生化学・分子生物学研究室で得られたものです。日夜研究に励まれた学生の皆様に、この場を借りて心より御礼申しあげます。
文献
1) Mimura, J., Fujii-Kuriyama, Y.: Biochim. et Biophys. Acta,1619, 263 (2003).
2) Li, J., Buchner, J.: Biomed J., 36, 106 (2013).
3) Prodromou, C.: Biochim. et Biophys. Acta, 1823, 614 (2012).
4) Vondrá![]() ek, J., Machala, M.: Stem Cells Int., 2016, 4326194 (2016).
ek, J., Machala, M.: Stem Cells Int., 2016, 4326194 (2016).
5) Tsuji, N., Fukuda, K., Nagata, Y., Okada, H., Haga, A., Hatakeyama, S., Yoshida, S., Okamoto, T., Hosaka, M., Sekine, K., Ohtaka, K., Yamamoto, S., Otaka, M., Grave, E., Itoh, H.: FEBS Open Bio., 4, 796 (2014).
6) Fukunaga, B. N., Probst, M. R., Reisz-Porszasz, S., Hankinson, O.: J. Biol. Chem., 270, 29270 (1995).
7) Kudo, I., Hosaka, M., Haga, A., Tsuji, N., Nagata, Y., Okada, H., Fukuda, K., Okamoto, T., Grave, E., Itoh, H.: J. Biochem.,163, 223 (2018).
8) Tamura, T., Harama, D., Matsuoka, S., Shimokawa, N., Nakamura, Y., Okumura, K., Ogawa, H., Kitamura, M., Nakao, A.: Immunol. Cell Biol., 88, 685 (2010).
9) Busbee, P. B., Rouse, M., Nagarkatti, M., Nagarkatti, P. S.: Nutr. Rev., 71, 353 (2013).