【トピックス】
タンパク質の二次構造とアミノ酸の疎水性度に基づいた凝集に関連するホットスポットの合理的同定法
松井大亮、中野祥吾、Mohammad Dadashipour、淺野泰久
富山県大工・生工研セ/JST・ERATO、富山県大工・生工研セ/JST・ERATO/静岡県大・食栄・食品生命科学、富山県大工・生工研セ/ST・ERATO、富山県大工・生工研セ/JST・ERATO
1.はじめに
異種発現系で酵素遺伝子を大量に発現させる場合、封入体の形成などで活性が示されないことが大きな問題となる。これは、タンパク質のフォールディングに関する多くの課題が解明されていないことに起因するが、この問題を克服するためにシャペロンとの共発現や可溶性タグとの融合といった様々な方法1-6)が検討されてきた。しかし、これらの方法には操作の煩雑さやコスト面に問題点があり、また、どのようなタンパク質に適用できるのかの検討も十分には行われていない。以上のことから、汎用性が高く、安価かつ高精度な可溶性酵素の作製技術の開発が求められている。
近年、部位特異的変異を導入することで、不溶性酵素の可溶性を大幅に向上できることが報告されている。例えば、Asanoらは、大腸菌を宿主とした発現系において、キャッサバから見出されたヒドロキシニトリルリアーゼ (MeHNL, EC4.1.2.37) の野生型は不溶性酵素として発現するが、His103が疎水性残基 (Leu、Val、およびIle) に置換された、あるいはLys176、Lys199、Lys224がプロリンに置換された変異型は可溶性タンパク質として大量に発現されることを発見した7)。これは、可溶性を向上させる有用変異点、いわゆるaggregation hot-spotが不溶性タンパク質の配列内に存在し、これらを合理的に予測できれば、多くの不溶性酵素の可溶化が可能となることを示唆している。そこで、MeHNL以外の酵素に有用変異点を導入することにより発現タンパク質を可溶化できるかを検討し、さらに得られた変異型酵素での構造上の共通性を調査した。すなわち、分子進化工学や合理的設計に基づいた変異導入による可溶性タンパク質の発現法の可能性を探ることとした。
2.α-ヘリックス構造における疎水性度のミスマッチを利用した可溶性発現
酵母、シロイヌナズナ、およびキイロショウジョウバエのアミノ酸代謝に関連する酵素遺伝子それぞれ8種、11種、および23種 (合計42種) をpET11aに挿入し、大腸菌BL21(DE3)で発現させたところ、合計16種の酵素 (酵母酵素2種、シロイヌナズナ酵素2種、キイロショウジョウバエ酵素12種) が不溶性タンパク質として発現することを見出した。これらに加え、ヤンバルトサカヤスデ由来マンデロニトリル酸化酵素 (ChuaMOX, EC1.1.3.49)8)など、これまでに不溶性タンパク質として発現することが示されている酵素も本研究の対象にした。これらの不溶性タンパク質をコードする遺伝子にランダム変異を導入し、活性を持つ酵素として発現する変異型酵素を探索した。本研究では遺伝子修復能を欠損した大腸菌XL-1Red株を用いたランダム変異導入法を用いた。可溶性変異型酵素を迅速にスクリーニングするため、コロニーピッカーの使用、比色法での酵素活性の測定、メンブレンに転写したコロニーを直接呈色させるコロニーダイレクトアッセイ法、96穴マイクロプレートリーダーを使用した。
大腸菌で発現したシロイヌナズナ由来のL-アルギニン脱炭酸酵素 (AtADC, EC4.1.1.19) は不溶性であった。そこで、AtADC遺伝子をpET22bに導入し、大腸菌XL-1Redを用いて変異ライブラリーを構築した。L-Argの脱炭酸反応で生成するアグマチンをアミン酸化酵素で酸化し、生成する過酸化水素を比色測定する方法で活性型酵素をスクリーニングしたところ、Arg430がLeuに置換された変異型酵素、およびLeu435がAsnに置換された変異型酵素が活性を示した。本酵素のアミノ酸配列を二次構造予測プログラムPSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/) で解析した結果、20個のα-へリックス構造が存在することが推定され、変異箇所はN末端から13番目のα-へリックス構造 (RESCLLYVDQLKQRCVE) に含まれることが明らかとなった。様々な解析結果を基に描いたヘリカルホイールの図から、Arg430は「疎水性領域に存在する親水性アミノ酸」、一方、Leu435は「親水性領域に存在する疎水性アミノ酸」であることが明らかとなった (図1)。また、両アミノ酸残基を他のアミノ酸に置換した結果、活性型変異酵素ではArg430がハイドロパシーインデックス値の高い (疎水度が高い) アミノ酸に、またはLeu435がハイドロパシーインデックス値の低い (親水度が高い) アミノ酸に置換されていることが明らかとなった (図1)。さらに、Arg430とLeu435の両方を置換した変異体では活性が増加したことから、複数の変異導入により、活性型変異酵素の生産量の増加が可能であると考えられた。なお、ヘリカルホイールは、軸上の視点からα-へリックス構造上のアミノ酸を重ねた状態を模式的に描いたものである。実際のα-へリックス構造は1周で3.6個のアミノ酸が存在するので、ずれを補正して2周7個のアミノ酸として描いている。
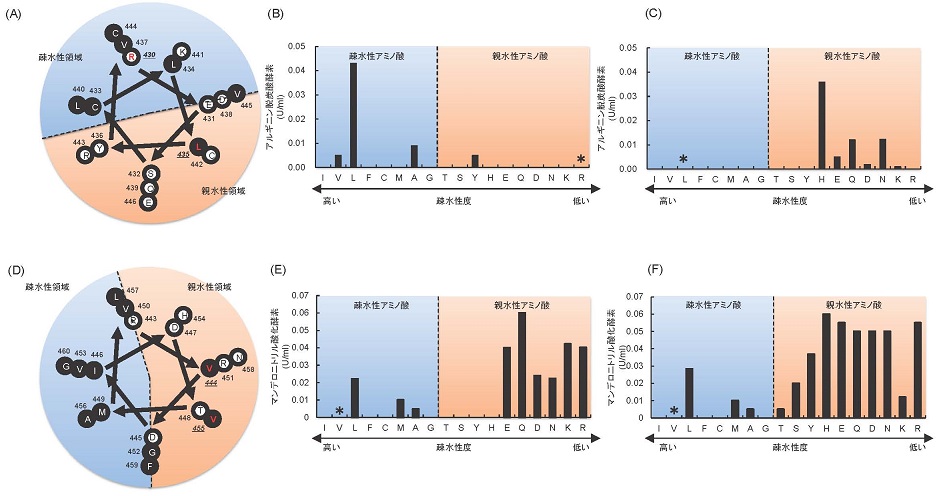

大腸菌で不溶性タンパク質として発現するChuaMOX遺伝子の変異型酵素ライブラリーを構築し、(R/S)-マンデロニトリルを基質として酸化活性を比色法で測定したところ、Val455がAlaに置換された変異型酵素が活性を示すことを見出した (表1)。そこで、Val455を他のアミノ酸に飽和変異した結果、Valよりもハイドロパシーインデックス値が低い (親水度が高い) アミノ酸に置換した変異体で酵素活性が高く、特に、親水性アミノ酸 (Glu、Gln、Asp、Asn、Lys、Arg) に置換した酵素は高い酸化活性を示した (図1)。次に、二次構造予測プログラムPSIPREDを用いて本酵素の二次構造を推定したところ、変異箇所のVal455は、α-へリックス構造のアミノ酸配列 (RVDIDTMVRGVHVALNFG) 中に存在することが明らかになった。また、ヘリカルホイールを描いた結果、Val455は親水性領域に存在する疎水性アミノ酸であった (図1)。従って、Val455のAlaへの置換は、α-へリックス構造内への変異の導入であり、さらに、親水性領域に存在するハイドロパシーインデックス値の低い(親水度が高い)アミノ酸への変異であることが明らかとなった。
![]()

また、Val444は、Val455と同じα-へリックス構造内にある「親水性領域に存在する疎水性アミノ酸」である。そこで、Val444を19種類のアミノ酸に置換したところ、Val455と同様に、ハイドロパシーインデックス値の低いアミノ酸への変異により活性型酵素として発現することが明らかになった (図1)。
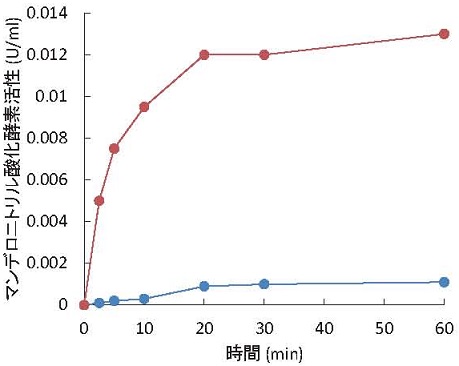
野生型酵素と変異型酵素V455Eの封入体 (両者ともに10 mg) を8 Mグアニジン溶液で可溶化後、還元剤DTTと補酵素FADを含む緩衝液に滴下し、経時的に活性を測定して、リフォールディングの速度を比較した。その結果、野生型酵素よりも変異型酵素の方がリフォールディング効率が高く (図2)、ニッケルアフィニティーカラムを用いた精製においても、変異型酵素の方が収量も高かった。したがって、α-へリックス構造上に存在するアミノ酸残基への変異がChuaMOXのフォールディングに影響していることが明らかとなった。

以上の結果から、これらの酵素は、「α-へリックス構造部分の親水性領域に存在する疎水性アミノ酸、または同部分の疎水性領域に存在する親水性アミノ酸」に変異を導入することにより、可溶性の活性酵素として発現できることが明らかとなった (「α-へリックス法」)10)。
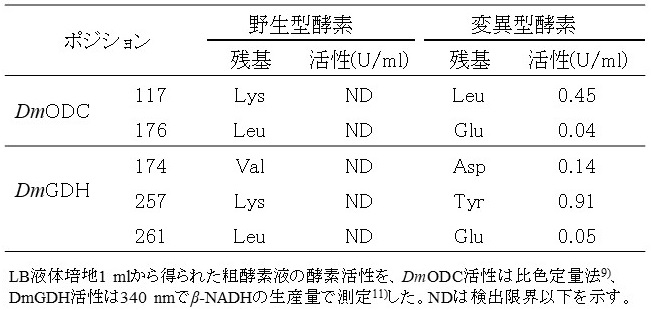
これらの結果をふまえて、他の不溶性発現酵素についても二次構造を予測し、α-へリックス構造の部分を抽出してヘリカルホイール図を描いた。その図から「親水性領域に存在する疎水性アミノ酸」もしくは、「疎水性領域に存在する親水性アミノ酸」を特定し、それらの残基に対して飽和変異プライマーでライブラリーを構築して活性型酵素を探索した。その結果、キイロショウジョウバエ由来L-オルニチン脱炭酸酵素 (DmODC, EC4.1.1.17)、L-グルタミン酸脱水素酵素 (DmGDH, EC1.4.1.2) の活性型酵素を発現することに成功した (表2)。
表2 α-へリックス構造に着目した変異導入法による可溶性発現
3.一次配列解析ソフトINTMSAlignを利用した可溶性発現
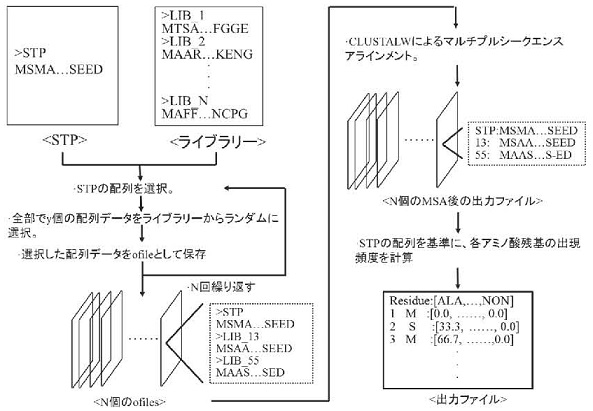
上記の実験結果より、アミノ酸残基の疎水性度に注目することで、aggregation hot-spotの合理的予測が可能になるのではないかと考えた。そこでERATO浅野酵素活性分子プロジェクトの中野研究員が中心となって開発した一次配列解析ソフトINTMSAlign12)に、HiSol値というパラメーターをを新たに定義した。INTMSAlignはアミノ酸配列の組み合わせを様々に変えてマルチプルシーケンスアライメント (MSA) を行い、最終的にその結果を統合する新規のMSA法である。具体的な解析手順は以下の通りである。INTMSAlignの解析に必要となるデータは、研究対象のアミノ酸配列 (STP) とSTPと相同な配列からなるライブラリー (配列数の制限はなし) の2つである。ここでSTPのアミノ酸残基数をx、ライブラリー中から選択する配列の数をyと定義する (x、yはいずれも整数、図3)。INTMSAlignは、STPとy個 (10個未満) の配列をライブラリーからランダムに選択した配列データセット (dataN) を複数個 (ここではN個) 作成し、次に、すべてのデータセットに関してClustalWなどの既存のMSA法を用いてアラインメントを行い (ResultN)、その後にSTPのx残基目 (1 ≦ x ≦ n, nはSTPの残基数に一致) について、20種類のアミノ酸およびギャップに関する出現頻度を計算する方法である。出現頻度はResult1からResultNの全てのファイルをまとめて計算される。最終的に出現頻度は21 (20種類のアミノ酸およびgapの出現頻度) ×nの行列として出力される12) (図3)。HiSol値は、上述したINTMSAlignの出力データと、アミノ酸残基のハイドロパシーインデックスの値を用いることで算出されるスコア値である。本スコアを用いることで、可溶化させたいタンパク質 (上記のSTP) の中に存在する、ファミリー配列と比較して疎水性度に矛盾のあるアミノ酸残基 (aggregation hot-spot) を選択することが可能となる。
![]()
実際に、HiSol値を用いることで、Asanoらが発見したMeHNLのaggregation hot-spot (His103) を予測できるか検証した。配列ライブラリーには、MeHNLの配列をBlastpにより解析することで得られた計823個のファミリー配列を用いた。解析の結果、His103のHiSol値は-2.28であり、全アミノ酸残基の中で最小であった。ファミリー配列中においては、His103は疎水性残基 (Leu、Ile、Valなど) として保存されていることが示された。His103を疎水性残基に置換するとMeHNLの可溶性が向上することが過去に報告されていることからも、HiSol値はaggregation hot-spotの予測に有用であることが示唆された。
次に、Sporosarcina ureae由来のL-フェニルアラニン脱水素酵素 (SuPDH) のaggregation hot-spotの予測が可能かどうかを検証した。SuPDHは、L-フェニルアラニンに高い特異性を示すものの、大量に発現した酵素は不溶性画分として回収される問題点があった。そこでSuPDHをSTPとしてINTMSAlignを用いて解析したところ、K148I (-2.75)、Q225V (-2.23)、K374I (-2.02)、Q337I (-1.949)、およびQ243V (-1.81) の5変異で可溶性向上が期待されることが予測された (括弧内はHiSol値)。次に上記5つの変異体を作成して菌体比活性を測定したところ、Q225VとQ337Iの可溶性が向上しており、37℃での培養後に可溶性画分に回収されたこれらの変異型の量は、野生型の20倍程度に増加した7)。INTMSAlignはweb版公開に向けて鋭意開発中であるが、現在の所まだ公開されていない。もし利用を検討されている場合、著者らにご一報頂けると幸いである。
4.α-へリックス法と一次配列解析ソフトINTMSAlignを併用した可溶性発現
以上の結果から、HiSol値および「α-へリックス法」がaggregation hot-spotの予測に有効であることが判明した。そこで更なる予測精度向上を目指し、これら2つの手法を組み合わせた方法を開発した12)。例えば大腸菌で活性 (発光) を検出できなかった海洋性プランクトン由来ルシフェラーゼについて、α-へリックス構造上の疎水性領域中の親水性残基、および親水性領域中の疎水性残基のHiSol値を求め、HiSol値が高い候補残基としてIle80とAla177を特定し、前者ではLys、後者ではAspが、高い比率で保存されていることを明らかにした。次に、I80KとA177Dの変異型酵素を作成し、両変異型酵素で発光活性が増加することを確認した (図4)。続いて、アフィニティーカラムを用いて、変異導入酵素を単離精製し、活性型変異酵素であることを確認した。
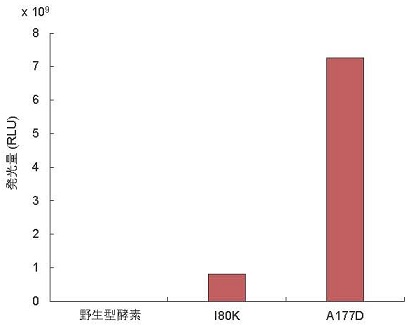
![]()
5.おわりに
本研究では、ランダム変異法で得られた活性型変異酵素の変異点について調べ、二次構造予測法で推定されるα-へリックス構造とアミノ酸の疎水性度に共通性があることを見出した。また、このα-へリックス法を、一次配列解析ソフトINTMSAlign、およびHiSol値の絶対値が高い残基を抽出する追加機能と組合わせて用いることにより、置換するアミノ酸残基の位置だけでなく、置換に用いる候補アミノ酸も予測することが可能になった。これらの方法により、検討した23酵素中、およそ50%の酵素を活性型酵素として得ることができた。現在の可溶性発現量はまだ低く、高い発現量を得るためには複数の変異の組合せなどのさらなる検討が必要である。これまでに報告された方法と比べると、本研究で開発した変異による可溶性発現法は、酵素の構造と可溶性の関連性に着目して従来からの難問に切り込んだ初めての手法であり、かつ、操作の簡便性などにおいて優れている。ただ、今回の研究からは、酵素の可溶性発現にはさらに多くのファクターが関わっていることも示されており、今後も種々の手法、例えば活性を指標としたスクリーニングをさらに継続することで、より有効な手段の発見につながると考えている。
謝辞
本研究は独立行政法人科学技術振興機構 (JST) の戦略的創造研究推進事業 (ERATO) を受けて行われたものです。本研究にご協力いただいた多くの共同研究者の方々に感謝申し上げます。
文献
1) 西原和代、柳 秀樹、由良 隆:特開平11-9274.
2) 廣瀬修一、野口 保、五島直樹、森 正敏:特開2012-116816.
3) 井上等敏:特開2012-179062.
4) 嶋本伸雄:特開平11-335392.
5) 角田達朗、奈良貴幸、冨樫秀彰、関川千里、水上富士夫、坂口謙吾:特開2011-46686.
6) 木川隆則、松田貴意、青木雅昭、横山茂之、篠崎一雄、関 原明:特開2004-105070.
7) Asano, Y., Dadashipour, M., Yamazaki, M., Doi, N., Komeda, H.: Protein Eng. Des. Sel., 24, 607 (2011).
8) Ishida, Y., Kuwahara, Y., Dadashipour, M., Ina, A., Yamaguchi, T., Morita, M., Ichiki, Y., Asano, Y.: Sci. Rep., 6, 26998 (2016).
9) Sugawara, A., Matsui, D., Takahashi, N., Yamada, M., Asano, Y., Isobe, K.: J. Biosci. Bioeng., 118, 496 (2014).
10) Matsui, D., Nakano, S., Dadashipour, M., Asano, Y.: Sci. Rep., 7, 9558 (2017).
11) Asano, Y., Nakazawa, A., Endo, K.: J. Biol. Chem., 262, 10346 (1987).
12) Nakano, S., Asano, Y.: Sci. Rep., 5, 8193 (2015).
13) Takenaka, Y., Masuda, H., Yamaguchi, A., Nishikawa, S., Shigeri, Y., Yoshida, Y., Mizuno, H.: Gene, 425, 28 (2008).