【トピックス】
酵素とゲルを使ってガンを殺す?
丸山達生
神戸大院・工
1.はじめに
筆者は主に酵素ユーザーのため、「酵素を使ってこんなことが・・・」という視点で、筆者らが取り組んでいる「酵素応答性ゲル化剤によるガン細胞の殺傷」について紹介する。ゲルの定義は、現代においても人により様々であり、ここでは「液体の性質を併せ持ちながら、流動性を失ったもの」という広義の意味で取り扱う。ゲルの歴史は相当に古く、例えば食品の分野では人類によるゲルという認識以前から広く用いられてきた。そのほとんどが高分子 (ポリマー) によるゲルである (ゼラチン、寒天等)。一方、高分子を使わず低分子化合物のみでゲルを作ることも可能である (低分子ゲル化剤あるいは低分子版超分子ゲル化剤)。この低分子ゲル化剤は一般に分子量1000以下程度であり、非共有結合性の分子間相互作用によりナノファイバー状 (他形態も有り) の自己組織体を形成し、このナノファイバーが絡み合うまたは枝分かれすることにより溶媒をゲル化する (図1)。この低分子ゲル化剤の代表例は、廃油処理に使う「固めるテンプル (ジョンソン・エンド・ジョンソン株式会社)」であり、分子量たった300程度の12-ヒドロキシステアリン酸 (天然油脂由来) が主成分である。このように低分子ゲル化剤には天然物もあるが、近年精力的に研究されているのは合成物である。一般に低分子ゲル化剤は、高分子に比して分子デザインに基づく精密な合成が可能であり、種々の刺激 (熱、pH、酵素等) に対する応答性をその分子構造に書き込むことができる。水をゲル化する低分子ハイドロゲル化剤について、2000年前後から興味深い研究例がいくつも報告されている。水中では、酵素を積極的に利用可能であるため、酵素に応答する低分子ゲル化剤の研究が思いつく。この酵素応答性低分子ゲル化剤の開発では、多くの場合ゲル化能を抑制したゲル化剤前駆体を合成する。酵素による部位特異的な加水分解反応により前駆体構造が変化し、ゲル化剤分子の自己組織化が進行し、水をゲル化するという研究例が多い。
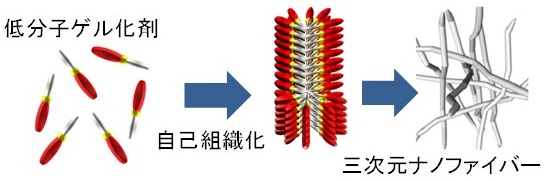
図1 低分子ゲル化剤分子の自己組織化によるナノファイバー形成、ゲル化
2.酵素応答性低分子ゲルによる細胞殺傷
酵素と低分子ゲル化剤を用いた細胞死の誘導に関する最初の研究例は、Xuら (現在米国Brandeis大学) により報告されている1)。彼らは、細胞内エステラーゼで加水分解すると自己組織化を経て、ゲル化する低分子ゲル化剤前駆体1を開発した (図2)。この前駆体分子の分子量は600程度と比較的小さく、またナフタレン環を有することから比較的疎水性が高く、細胞に取り込まれやすい。さらに分子末端のカルボキシ基の存在により、生理的条件下では前駆体分子間に静電反発が生じ、このままでは自己組織化しにくいように設計されている。この低分子ゲル化剤前駆体1 (0.08 wt%) をHeLa細胞 (ヒト子宮頸ガン由来) に添加したところ、1日後には85%以上のHeLa細胞が死滅した。一方、細胞内エステラーゼ活性が低いNIH3T3細胞 (マウス線維芽細胞由来) では死滅効果が見られなかった。つまり、HeLa細胞内エステラーゼによる加水分解が細胞内での低分子ゲル化剤1の自己組織化を誘導し、生じたナノファイバー (細胞内ゲル化) が細胞死を引き起こしたと考えられる。
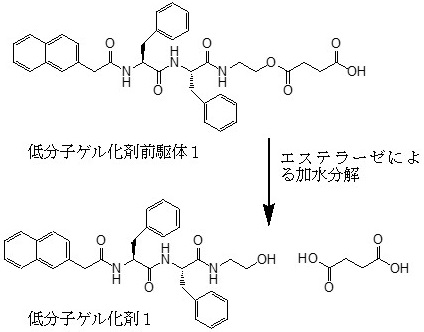
図2 細胞内エステラーゼに応答してゲル化する低分子ゲル化剤前駆体11)
またXuらは、キナーゼやホスファターゼによるリン酸化・脱リン酸化によりゾル化・ゲル化を引き起こす低分子ゲル化剤も開発した2) (図3)。この分子も前述同様、リン酸基のマイナス電荷により前駆体分子間には静電反発が生じ、前駆体のままでは自己組織化しにくいように設計されている。そこでこれをホスファターゼが過剰発現するように遺伝子組換えした大腸菌に取り込ませ、細胞内でゲル化剤前駆体の脱リン酸化させることで、細胞死を誘導することに成功した3)。具体的には、IPTG添加によりホスファターゼを過剰発現させた大腸菌に対してだけ、低分子ゲル化剤前駆体2は高い毒性を示した。死滅した大腸菌内を分析したところ、菌破砕液から前駆体2の分解物である低分子ゲル化剤2が検出され、細胞による取り込みと細胞内での低分子ゲル化剤の明確な蓄積が確認された。死滅した菌破砕液は加熱冷却後ゲル化し、この破砕液中に低分子ゲル化剤によると思われるナノファイバーも観測している。つまりXuらの研究により、酵素応答性低分子ゲル化剤が細胞死を引き起こしうることが示された。
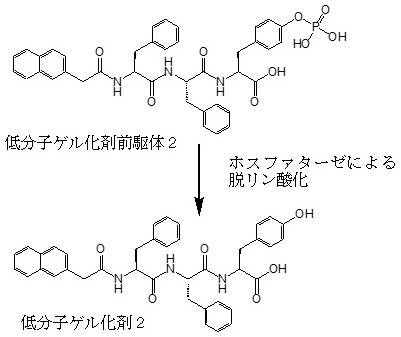
図3 ホスファターゼの作用によりゲル化する低分子ゲル化剤22,3)
さらにXuらは低分子ゲル化剤を、ナノファイバーを形成可能な低濃度 (最低ゲル化濃度以下) で用いることで、低分子ゲル化剤3 (図4) がHeLa細胞と悪性脳腫瘍細胞 (T89G) に対して強い細胞毒性を示すことを発見した4)。興味深いことに、この低分子ゲル化剤は、ある閾値 (300µM) 以下では毒性を示さず、この閾値を超えると毒性を示すことを報告している。これは、低分子ゲル化剤3がナノファイバーを形成する最低濃度が約300µMであり、このナノファイバーが細胞内の微小管やアクチンフィラメントと相互作用し、これがアポトーシスを引き起こしたと彼らは論じている。
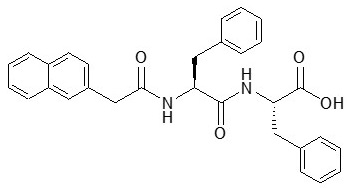
図4 低分子ゲル化剤3の分子構造4)
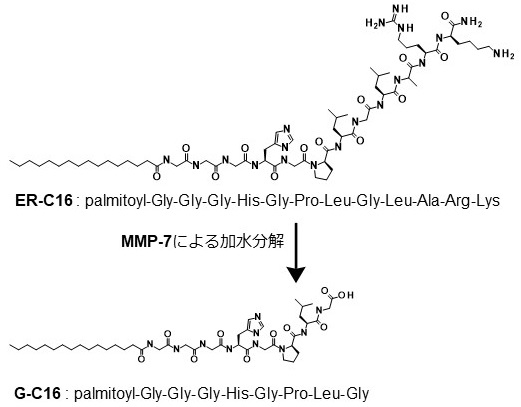
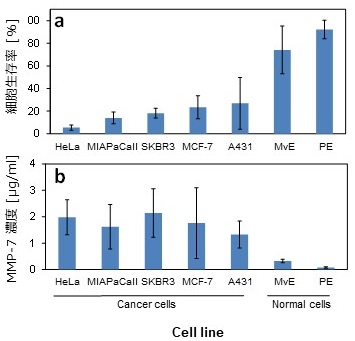
筆者らはこれらの研究にヒントを得、病気に関わる酵素に応答する低分子ゲル化剤を開発した。酵素としては、一部のガン細胞が多量に分泌する酵素マトリックスメタロプロテイナーゼ7 (MMP-7) に注目し、このプロテイナーゼの加水分解作用に応答してゲル化するペプチド脂質型低分子ゲル化剤前駆体 (ER-C16) を開発した (図5)5)。この前駆体分子は、ペプチド鎖末端にリジンとアルギニンを有し、生理的条件下では前駆体分子がプラスに帯電するよう設計した。つまり自己組織化能を封印し、前駆体のままではゲル化能を示さないようにした。この前駆体ペプチド鎖がMMP-7によりアミノ酸配列特異的に分解されると、生じたゲル化剤 (G-C16) がナノファイバーを形成し、溶液をゲル化する。この低分子ゲル化剤前駆体 (0.02 wt%) をHeLa細胞 (ガン細胞) とヒト皮膚微小血管内皮細胞 (MvE、正常細胞) に添加したところ、HeLa細胞はその多くが死滅し、MvE細胞に対しては死滅効果を示さなかった (図6)6)。種々のガン細胞 (MIAPaCaII, SKBR3, MCF-7, A431細胞) と二つのヒト由来正常細胞 (ヒト皮膚微小血管内皮細胞、ヒト膵上皮細胞) に対する、低分子ゲル化剤前駆体 (ER-C16) の細胞毒性試験を行ったところ、やはりゲル化剤前駆体はガン細胞に対して強い毒性を示すが、正常細胞に対しては明らかに低毒性であった (図7a)。ここでは、ガン細胞から分泌されるMMP-7によって、ゲル化剤前駆体が細胞毒性のあるゲル化剤へと変換されると想定している。そこで各細胞のMMP-7分泌量 (活性量) を測定したところ、ガン細胞が正常細胞に比べてMMP-7をより多く分泌しており、かつMMP-7活性とゲル化剤前駆体の細胞毒性に相関があることが明らかになった (図7b) 。
![]()
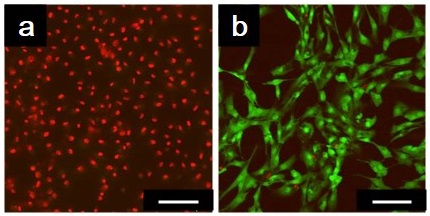


また蛍光ラベル化した低分子ゲル化剤類似化合物をHeLa細胞に添加し、その取り込み挙動を顕微鏡により調べたところ、ゲル化剤分子が細胞質に存在し、しかも細胞質の流動性が明確に低下していることが判明した。このことは細胞内の一部がゲル化したことを示唆している。またこの低分子ゲル化剤前駆体により死滅したHeLa細胞の破砕液には、MMP-7の加水分解反応により生じたゲル化剤分子 (G-C16) が検出された。しかも細胞破砕液を加熱・冷却したところ、破砕液のゲル形成を確認した。つまり低分子ゲル化剤前駆体がガン細胞の分泌するMMP-7によって加水分解され、ガン細胞に取り込まれ、細胞内部で自己組織化することで細胞毒性を示していることが示唆された。ここでは、ガン細胞に特徴的な酵素に応答する低分子ゲル化剤を設計したため、ガン細胞選択的な殺傷が可能になったと考えている。
3.おわりに
以上のように、特定の細胞が産生する酵素に応答する低分子ゲル化剤前駆体を設計することで、酵素機能に応じた自己組織化orゲル化をプログラムすることが可能である。これを細胞系に応用することで、細胞内という場所を特定してゲル化させ、細胞死を誘導することが可能である。ここで紹介した研究例では、低分子ゲル化剤分子一つでは何ら機能を有さないが、ゲル化剤分子が多数集まり自己組織化することで、単一分子ではなしえなかった生理活性を発現している。上述の報告例は低分子ゲル化剤を用いた細胞死の誘導だけであるが、今後細胞を機能化する新たな方法論として、低分子ゲル化剤の新たな展開を期待したい。
文献
1) Yang, Z. M., Xu, K. M., Guo, Z. F., Guo, Z. H., Xu, B.: Adv. Mater., 19, 3152 (2007).
2) Yang, Z., Liang, G., Wang, L., Xu, B.: J. Am. Chem. Soc., 128, 3038 (2006).
3) Yang, Z., Liang, G., Guo, Z., Guo, Z., Xu, B.: Angew. Chem. Int. Ed., 46, 8216 (2007).
4) Kuang, Y., Xu, B.: Angew. Chem. Int. Ed., 52, 6944 (2013).
5) Koda, D., Maruyama, T., Minakuchi, N., Nakashima, K., Goto, M.: Chem. Commun., 46, 979 (2010).
6) Tanaka, A., Fukuoka, Y., Morimoto, Y., Honjo, T., Koda, D., Goto, M., Maruyama, T.: J. Am. Chem. Soc., 137, 770 (2015).