【トピックス】
酵素はどこまで進化させられるのだろうか?
杉森大助
福島大・共生システム理工
1.はじめに
酵素研究者は酵素の触媒作用メカニズムを解明し、その機能を改良すべく遺伝子工学を導入し、酵素の立体構造情報に基づいた合理的設計法 (rational design)、そして近年では進化分子工学的手法により酵素の機能改変を行っている。どちらの手法に関しても、これまでに多くの成功をもたらしている1,2)。しかしながら、どちらの手法もある程度の成果は期待できるが、酵素機能の大幅な改良や複数の機能を向上させるには限界を感じている酵素研究者も多いのではないだろうか。例えば、酵素の耐熱性が向上しても比活性が低下する等の他方の機能低下 (トレードオフ) が生じることが少なくない。その一方で、産業用酵素として社会実装するには基質特異性に優れ、比活性、耐熱性、組換え発現量が高いなど、複数の高い性能が要求される。では、いったい酵素はどこまで進化 (機能改変) させられるのだろうか?、用いている手法の限界なのか?、酵素を構成するアミノ酸配列 (1次構造) から決定される立体構造 (2, 3次構造) のバリエーションの制約 (タンパク質の立体構造の収斂進化による制約) に基づく限界なのか?、という疑問が沸いてくる。
本稿では、筆者らが挑んだ “酵素機能改変におけるトレードオフ問題への挑戦 (酵素の耐熱化と基質特異性改変)” に関する最新の研究事例を紹介する。
1-1 酵素の分子進化
酵素・タンパク質は概してgeneralistからspecialistに進化してきたと考えられており、耐熱性や比活性は高いが基質特異性が低い “
1-2 進化分子工学と人工タンパク質設計
立体構造情報が得られない酵素についてはrational designよりもランダム変異導入法が効果的である。しかし近年では、酵素のアミノ酸配列さえ入手できれば公共データベースに登録された立体構造情報を利用して研究対象とする酵素の立体構造モデルをほとんど予測できるようになってきた。また、予測精度も高くなってきているためモデル構造に基づいたrational designが一般化してきており、従来のX線結晶構造情報に基づいたrational designとともに部位特異的アミノ酸置換によって多数の成功例が報告されている。そのなかには、アミノ酸一カ所を置換するだけで機能向上に成功した例も多数報告されている。例えば、ホタルルシフェラーゼ3,4)やGFPなどの蛍光タンパク質の蛍光色変化5)、プロテアーゼの耐熱性向上6,7)、トランスアミナーゼの基質特異性改変8)が報告されている。ところが、rational designでは個々の変異導入の効果は周辺の構造環境に依存するため、ある酵素の耐熱化に寄与する変異導入が別の酵素の耐熱化に寄与するわけではなく、昨今ではrational designによる酵素の耐熱化の成功率は決して高くはないと考えられている。
一方、ランダム変異導入法などを利用した進化分子工学でも多数の成功例が報告されているが、膨大な遺伝子ライブラリーから耐熱化した酵素をコードする遺伝子をスクリーニング、あるいは選択するための方法をあらかじめ開発する必要があり、必ずしも簡便かつ効率的な方法とは言えない。また、以上のように多数の成功事例があるにもかかわらず、その知見や法則性は必ずしもすべての酵素に適用できるわけではなく、依然としてケースバイケースであることが多いのが現状である。さらに、先述したように複数の機能向上が困難であったり、一部機能の低下 (トレードオフ) が生じる場合も多々ある。
そこで筆者は、rational designで改変が困難な酵素は従来の進化分子工学的手法でも改変が困難 (つまり原理的な限界) であり、従来とは異なる方法を適用する必要があると考えた。本稿では最初に予測構造モデルに基づいたrational designによる基質特異性の大幅な改変に成功した例を紹介し、次に最新の人工タンパク質設計法により耐熱性を大幅に向上させた例を紹介する。
2.Rational designによる基質特異性の大幅改変
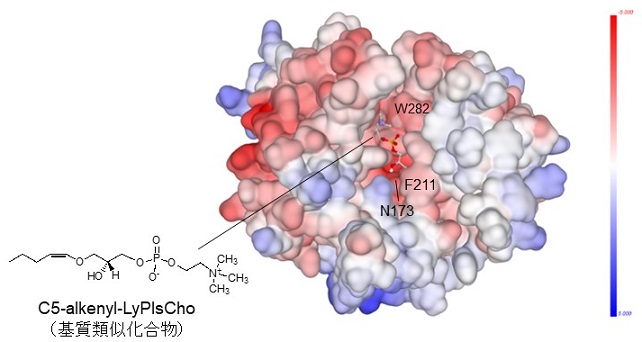
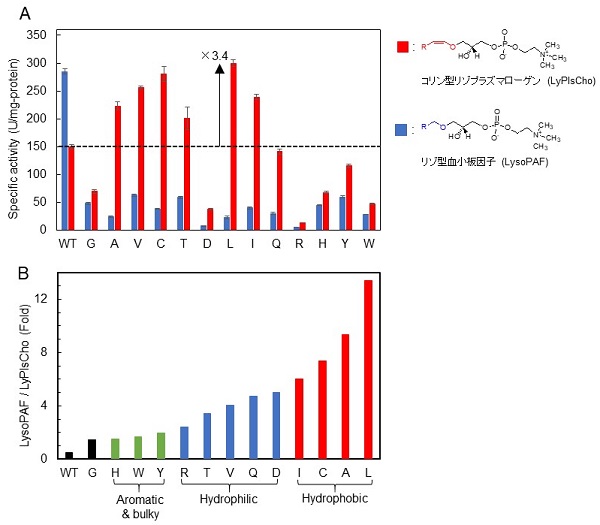
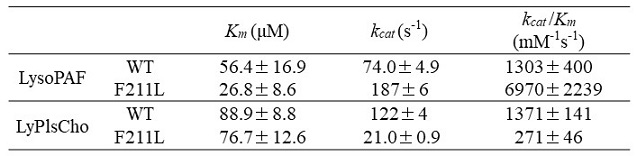
プラズマローゲン (Pls, 図1) は、sn-1位にアルケニルエーテル結合を持つリン脂質で脳細胞の酸化防止など生体内で重要な役割を担っている。近年、Plsがアルツハイマー型軽度認知障害や冠動脈疾患等のバイオマーカーとなることが報告され、血中Plsを測定することによりこれら疾患の早期発見が期待されている。これまでに、我々はコリン型リゾプラズマローゲン特異的ホスホリパーゼD (LyPlsCho-PLD) を発見9)し、図1に示すようなPlsの酵素定量法を開発した10)。本酵素の触媒作用とアミノ酸配列から本酵素はPLDおよびglycerophosphodiester phosphodiesterase (GDPD) ファミリーに属すると推定されたが、いずれの酵素とも基質特異性が大きく異なっている。この基質特異性に関しては、学術研究および産業応用の両面において興味深いものである。例えば、産業応用を考えた場合には、エタノールアミン型リゾプラズマローゲンやアルキルエーテル型リン脂質 (リゾ型血小板因子:LysoPAF) への基質特異性改変が必要とされる。そこで筆者らは、本酵素の基質認識メカニズムを解明するとともに基質特異性改変を目指して研究を進めてきた。本酵素については立体構造が未解明であったため、ホモロジーモデリング (HHpredサーチとModellerを利用) と基質類似化合物とのドッキングシミュレーション (AutoDockを利用) により酵素-基質 (ES) 複合体を予想した (図2)。推定したES複合体の情報とGDPDの既知構造情報から、触媒残基や活性中心、基質結合ポケットを予想し、基質分子と相互作用しそうなアミノ酸を推定してアミノ酸置換を導入していった。具体的には、基質のsn-1位アルケニルエーテル鎖とホスホコリンの認識に関与しそうなAsn173、Phe211、Trp282等に着目し、部位特異的アミノ酸置換を行った。本稿では紙面の都合上、非常に興味深い結果が得られたF211飽和変異について紹介する。F211変異体は一様にLyPlsChoに対する活性が大幅に低下し、アミノ酸側鎖のサイズが小さいIleやLeuに置換するとLysoPAFに対する活性が著しく増加した。一方、極性あるいは嵩高い側鎖を持つArg、Asp、His、Tyr、Trpに置換すると、いずれの基質に対しても活性が著しく低下することがわかった (図3)。変異体のうち、特に興味深い結果を与えたF211L変異体はLyPlsChoに対する活性が1/10以上低下し、LysoPAFに対する活性が3.4倍増強した。LysoPAF/LyPlsCho比は約0.5から13まで向上させることができ、LyPlsCho-PLDからLysoPAF特異的PLDに改変させることに成功した (表1)。これによって、LysoPAFの定量が可能となり、LP-PLA2 (リポタンパク質関連ホスホリパーゼA2) 活性測定法の開発に結びついた。現在、本酵素を利用した心血管疾患と脳卒中のリスク評価測定キットへの応用が進められている11,12)。
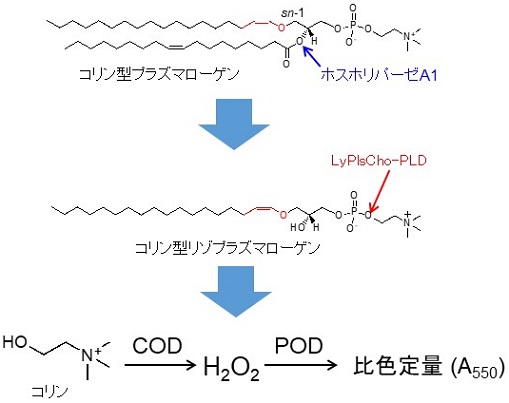

![]()
![]()
表1 LyPlsCho-PLD (WT) とF211L変異体の動力学定数
3.人工タンパク質設計法によるL-グルタミン酸オキシダーゼの耐熱性向上
L-グルタミン酸オキシダーゼ (LGOX) はL-グルタミン酸の検出・定量用酵素として産業上有用であり、食品分野や肝機能診断 (AST/ALT測定) に広く利用されつつある。さらに近年では、LGOXを利用したバイオセンサーの開発も期待されている。1980年代に国内グループが放線菌Streptomyces sp. X-119-6株由来LGOX (LGOXX119) の実用化に成功している13)。しかしながら、組換え生産酵素の熱安定性が大きな課題となっていた。そこで筆者らはスクリーニングにより、LGOXX119よりも高い比活性と耐熱性を示すLGOXを生産するStreptomyces sp. NT-1株を取得した。NT1株LGOX (LGOXNT1) の大腸菌組換え発現系を構築した後、温度因子 (B-factor) 解析を利用した部位特異的置換法と人工タンパク質設計法による耐熱化を試みた。
温度因子解析を利用した部位特異的置換法では、先述と同様に立体構造予測により作成した構造モデル中にあるB-factor値 (各アミノ酸残基を構成する原子の “ゆらぎの大きさ” の指標となる温度因子の値) から、ゆらぎが大きく不安定なアミノ酸を見出し、対象分子全体のゆらぎが小さくなるアミノ酸に置換するという方法である。LGOXNT1の立体構造モデルに対するB-factor解析の結果、耐熱性向上が期待できるアミノ酸置換体としてD397E/A/K/Sを候補として選出した。これら置換体を大腸菌発現させた結果、30 min のインキュベート後に100%の残存活性を示す温度の上限が野生型酵素 (WT) では55℃であったのに対し、D397E/Aでは60℃まで向上した (図4A)。また、両変異体の比活性はいずれも向上していた。Alaは硬い (ゆらぎが少ない) アミノ酸として知られており、D397Aの結果はリーズナブルと言えるがD397Eのメチレン基1つの違いによる耐熱性向上メカニズムは今のところ不明である。B-factor解析については酵素あるいは構造によってケースバイケースであり、必ずしも予想した通りの結果が期待できない点で精度が高いとは言えない。事実、D397E/A以外の置換体では耐熱性向上が認められなかったことからも、これ以上の耐熱性向上は期待できないと結論づけた。そこで従来とは全く異なるコンセプトである人工タンパク質設計法によるLGOXNT1の耐熱性向上を試みることにした。
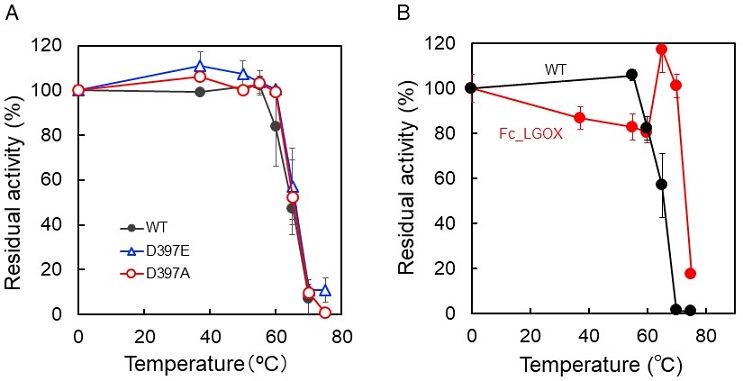

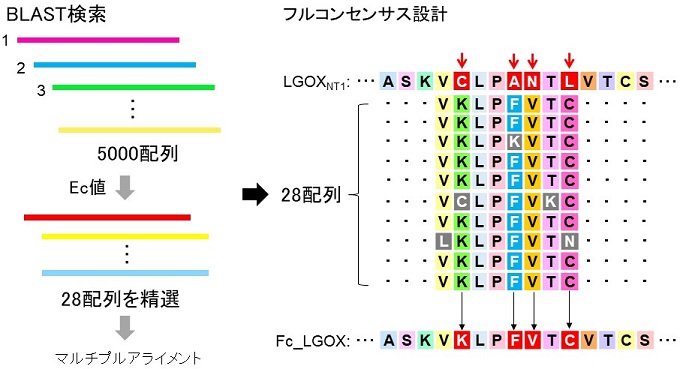
人工タンパク質設計法には数種類の方法がある14-16)。本稿では、そのうちの一つであるフルコンセンサス (Fc) 設計によるLGOXNT1の耐熱性向上を試みた結果について紹介する。人工タンパク質設計に関しては、静岡県立大・伊藤創平准教授、中野祥吾助教、富山県立大・浅野泰久教授との共同研究により行った。図5に示すように、フルコンセンサス設計では、まず耐熱化させたい酵素のアミノ酸配列 (STP) をクエリーとして公共データベースでBLASTサーチし、相同配列として数千配列を入手する。次に、Ec (conservation energy) 値14,17)を指標として、ある特定のアミノ酸を所定の位置に有する数十配列を精選し、人工設計を行うためのライブラリーとする。耐熱化させたい酵素のアミノ酸配列 (STP) とライブラリー間でマルチプルアライメントを行い、STP中で使用されているアミノ酸のうちライブラリー中の相同配列では出現頻度が低いアミノ酸をコンセンサスな (使用頻度が高い) アミノ酸に置換することによりFc型LGOXNT1 (Fc_LGOX) を設計した。Fc_LGOXではLGOXNT1を構成する690個のアミノ酸のうち104カ所にアミノ酸置換が施され (図6)、両者のアミノ酸配列相同性は84%となり、系統樹解析では独立した枝を形成した。Fc_LGOX遺伝子は大腸菌発現に最適化して全合成し、pET24aとE. coli BL21 (DE3) を用いて菌体内に可溶性発現させた。発現Fc_LGOXは高い発現量 (菌体破砕液画分:約8 kU/L-culture、約400 U/g-wet cells、精製サンプル: 725 U/L-culture、24 mg-protein/L-culture、37 U/g-wet cells、1.23 mg-protein/g-wet cellsの精製Fc_LGOXを得ることができた) と比活性 (菌体破砕液画分:約8 U/mg-protein、精製Fc_LGOX:約30 U/mg-protein) を示した。精製Fc_LGOXの至適pHは7付近、至適温度は60℃付近であり、基質特異性と触媒効率は低下していないことが確認された。また、耐熱性に関しては30 min インキュベート後に100%の残存活性を示す温度の上限が70℃まで向上した (図4B)。
![]()
4.おわりに
本稿ではモデル構造を利用したrational designにより運良く基質特異性の大幅改変と最新の人工タンパク質設計法による耐熱性向上の例を紹介した。特に、人工タンパク質設計法では、これまでの常識 (自然進化、進化分子工学) では到底たどり着くことができそうもない機能改変をハイスループットで成功させることができた。そのアミノ酸置換数は690アミノ酸あたり104カ所にのぼり、表面とサブユニット界面を中心に変異が入っている点が実に興味深い。最近、タンパク質の溶媒露出表面への変異が機能改変に効果的であるという報告が増えているようである18)。また、最近になって名古屋大学の荘司らは、アミノ酸置換せずにデコイ分子を利用して酵素の基質特異性改変に成功している19)。これらの結果を目のあたりにすると、酵素にはまだまだ隠された機能があり、如何にそのベールをはがすかが今後の酵素工学発展の鍵を握っていると思われる。
これまで酵素研究者の多くは、報告例がない酵素を自然界から探索するオールドバイオ (wet実験) を地道にやってきたわけであるが、近年では自然界には存在しない触媒活性を持つ酵素を創製する人工タンパク質設計の研究も進められており、既に10年前にはその成果も報告されている15,20)。また、分子動力学法を適用した酵素の設計でも成功例が次々と報告15,21)されていることから、酵素のデノボ設計・合成が可能になる日も近いと思われる。自然界から酵素を探索するwet実験が不要となるまでは、本稿で紹介した手法を含め今後ますます増えるだろうコンピューターシミュレーションを利用した人工タンパク質設計 (dry実験) をうまく融合させた研究が重要になるだろう。いずれにしても酵素研究はまだまだ夢がある研究対象ではないだろうか。実に、イジり甲斐がある面白い分子と感じられる昨今である。
謝辞
本研究の一部はJSPS科研費基盤C (JP15K05557))、JST探索タイプ (AS251Z00099P))、福島大学学内競争的研究資金 (18RI011))、旭化成ファーマ (株))、 (公財) 小柳財団、 (公財) 日本応用酵素協会、 (公財) 高橋産業経済研究財団による支援を受けたものであり、この場をお借りして謝意を表する。構造活性相関に関しては東北大院・村山和隆准教授、LP-PLA2測定法に関しては旭化成ファーマ (株) 酒瀬川信一博士、山浦沙樹氏、人工タンパク質設計については静岡県立大伊藤創平准教授、中野祥吾助教、富山県立大学浅野泰久教授に大変お世話になった。この場をお借りして厚く御礼申し上げたい。また、研究を進めてくれた卒業・修了生を含め研究室学生らに深謝する。
文献
1) 松井知子, "タンパク質工学・進化分子工学を利用した産業用酵素の開発": 生物工学会誌, 85, 394 (2007).
2) 松井知子,"タンパク質工学を利用した産業用酵素の開発実際に使われている手法,応用,開発例の紹介": 化学と生物, 57, 153 (2019).
3) Kajiyama, N., Nakano, E.: Protein Eng., 4, 691 (1991).
4) 日本生物工学会編: ひらく、ひらく「バイオの世界」 (2012).
5) Zhao, Y., Araki, S., Wu, J., Teramoto, T., Chang, Y-F., Nakano, M., Abdelfattah, A. S., Fujiwara, M., Ishihara, T., Nagai, T., Campbell, R. E.: Science, 333, 1888 (2011).
6) Imanaka, T., Shibazaki, M., Takagi, M.: Nature, 324, 695 (1986).
7) Yoshiki, M., Nishikawa, K., Aoshima, H., Inouye, K., Kubo, M.: J. Biochem., 135, 547 (2004).
8) Almahboub, S. A., Narancic, T., Fayne, D., O’Connor, K. E.: Sci. Rep., 8, 17397 (2018).
9) Matsumoto, Y., Kashiwabara, N., Oyama, T., Murayama, K., Matsumoto, H., Sakasegawa, S., Sugimori, D.: FEBS Open Bio, 6, 1113 (2016).
10) 特許第6185466号 (2017.8.4).
11) Yamaura, S., Sakasegawa, S., Koguma, E., Ueda, S., Kayamori, Y., Sugimori, D., Karasawa, K.: Clin. Chim. Acta, 481, 184 (2018).
12) 国際公開番号WO2017/221795.
13) Arima, J., Tamura, T., Kusakabe, H., Ashiuchi, M., Yagi, T., Tanaka, H., Inagaki, K.: J. Biochem., 134, 805 (2003).
14) Nakano, S., Motoyama, T., Miyashita, Y., Ishizuka, Y., Matsuo, N., Tokiwa, H., Shinoda, S., Asano, Y., Ito, S.: Biochem., 57, 3722 (2018).
15) 中野祥吾: 生物工学会誌, 95, 22 (2017).
16) 松井大亮, 中野祥吾, Mohammad, D., 浅野泰久: 酵素工学ニュース, 80, 14 (2018).
17) Jackel, C., Bloom, J. D., Kast, P., Arnold, F. H., Hilvert, D.: J. Mol.Biol., 399, 541 (2010).
18) Nakano, S., Asano, Y.: Sci. Rep., 5, 8193 (2015).
19) 唐澤昌之, 荘司長三: バイオサイエンスとインダストリー, 77, 46 (2019).
20) Rothlisberger, D., Khersonsky, O., Wollacott, A. M., Jiang, L., DeChancie, J., Betker, J., Gallaher, J. L., Althoff, E. A., Zanghellini, A., Dym, O., Albeck, S., Houk, K.N., Tawfik, D. S., Baker, D.: Nature, 453, 190 (2008).
21) Wijma, H. J., Floor, R. J., Bjelic, S., Marrink, S. J., Baker, D., Janssen, D. B.: Angew. Chem., 127, 3797 (2015).