【トピックス】
タンパク質間相互作用によるフラボノイド生合成酵素の活性制御:カルコン合成酵素の特異性あいまいさの矯正
和氣駿之、高橋征司、中山 亨
東北大院・工
1.はじめに
フラボノイドは、陸上植物において生産される植物特化代謝産物の一群であり、植物の環境適応や生殖に重要な役割を果たす。細胞内における生合成は、タンパク質間相互作用を介した酵素複合体 (メタボロン) により効率化されていることが推定されており、これまでに様々な植物種においてフラボノイド生合成酵素間の相互作用ネットワークが明らかにされてきた。しかし、メタボロン形成による具体的な代謝上のメリットはほとんど明らかにされていなかった。最近、フラボノイド生合成の初発酵素であるカルコン合成酵素において、陸上植物に普遍的に保存されたタンパク質間相互作用を介した活性制御機構が明らかにされたので紹介する。
2.陸上植物におけるフラボノイド生合成経路
フラボノイドは陸上植物 (コケ植物、シダ植物、裸子植物、被子植物) において普遍的に生産される植物特化代謝産物の一群である。C6-C3-C6の共通の基本骨格を有し、C3部分 (C環) の構造の違いに基づきカルコンやイソフラボン、アントシアニンなどのサブクラスに分類される (図1)。これらフラボノイドは、水酸化や配糖体化、アシル配糖体化、メチル化、プレニル化など多様な修飾を受け、主に植物細胞の液胞に貯蔵される。植物種の違いや蓄積する組織、生育ステージなどに応じて、結合する糖の種類や位置、アシル化、メチル化などの修飾が異なる様々な形のフラボノイドが存在し、これまでに7000を超える構造多様性が知られている1)。植物におけるこれらフラボノイドの機能は多岐にわたり、例えばアントシアニンは、赤色~青色の花色の呈色物質として受粉媒介者の誘因に寄与する。一方、ダイズなどのマメ科植物に含まれるイソフラボンは、病原体に対する抗菌物質として機能するとともに、根から分泌されるイソフラボン類は共生微生物である根粒菌の誘引物質としても機能する。このように、フラボノイドは植物の生殖や環境適応に重要な役割を果たし、多様な植物の生存戦略に必須な化合物群となっている。
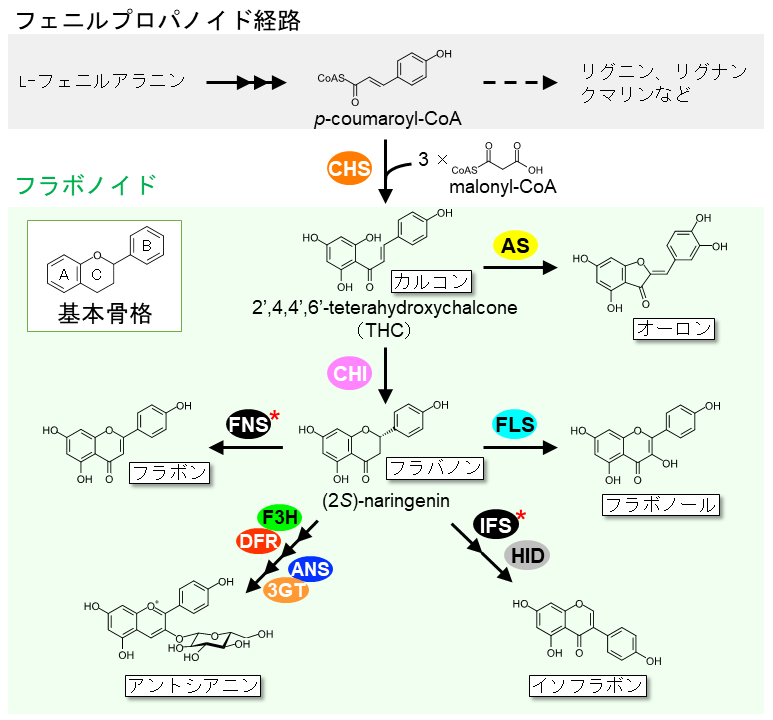

フラボノイド生合成の初発酵素はⅢ型ポリケチド合成酵素 (Ⅲ型PKS) に分類されるカルコン合成酵素 (CHS) である2)。CHSはフェニルプロパノイド経路により合成されるp-coumaroyl-CoAを開始基質としてmalonyl-CoAのC2単位を3回縮合した後、分子内環化反応によりカルコン (2́,4,4́,6́-tetrahydroxychalcone,THC) を生成する (図1)。in vitroにおいては、THCは自発的に環化してフラバノンのラセミ体 (2R/2S)-naringeninを与えるが、植物細胞内では引き続くカルコン異性化酵素 (CHI) の作用により立体特異的に異性化され、(2S)-naringeninが生成する3)。このCHIにより生成した (2S)-naringeninから、複数の酵素による多段階反応を経てフラボノールやイソフラボン、アントシアニンなどの各カテゴリーのフラボノイドが生合成される (図1)。図1に示すフラボノイド生合成経路に関与する酵素のうち、*をつけた酵素は小胞体膜結合型のシトクロムP450であり、それ以外の酵素は可溶性酵素であるとされる。ダイズやキンギョソウなどいくつかの植物種において、CHSやCHIはシトクロムP450と相互作用することが示されており4,5)、シトクロムP450は以下に述べるフラボノイドメタボロンの足場タンパク質としても機能することが示唆されている6)。
3.フラボノイドメタボロン
植物細胞内においてフラボノイドを効率良く生産する分子メカニズムとして、タンパク質-タンパク質間相互作用を介したフラボノイド生合成酵素群の多酵素複合体 (メタボロン) の形成が想定されている。フラボノイド生合成酵素によって形成されるメタボロン (フラボノイドメタボロン) の概念は、細胞内での高効率なフラボノイド生合成を説明する分子機構として1974年にStaffordにより提唱された7)。メタボロンの形成により特定の代謝酵素群が細胞内の一部の領域に局在化されることで、代謝酵素間の基質受け渡しが迅速に行われ (基質チャネリング)、細胞内代謝機能の高効率化が図られていることが想定されている。フラボノイド生合成では、これまでに,シロイヌナズナなどの植物種において、CHSを含むいくつかの可溶性酵素が小胞体膜上に局在することが示されており8)、フラボノイドメタボロンは小胞体膜結合型シトクロムP450を核としてこれに可溶性酵素が可逆的に解離会合することで、小胞体膜の細胞質側表面に形成されることが提唱されている5,6)。しかし、メタボロン形成に関与するタンパク質間相互作用は非常に弱いと推定され、フラボノイドメタボロン形成に関わる酵素複合体が直接単離された例はない。また、実際のフラボノイド代謝に対してどのようなメリットがあるか、不明な点が多い。
4. 陸上植物に保存されたカルコン合成酵素 (CHS) の活性制御機構
4-1 カルコン合成酵素 (CHS) の特異性あいまいさ
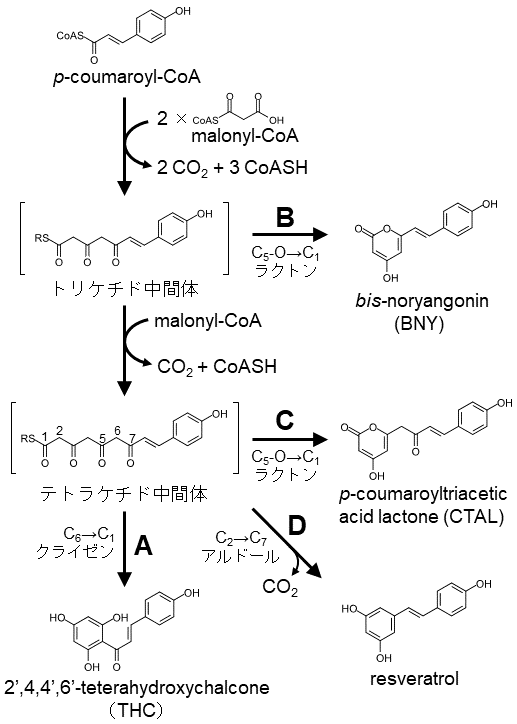
CHSはフェニルプロパノイド経路からフラボノイド生合成への分岐点を触媒する鍵酵素である。しかし、その機能の重要性にもかかわらず、CHSの生成物特異性は低く、主生成物であるカルコンの他に副生成物を多量に生成してしまうことが知られている。CHSは開始基質であるp-coumaroyl-CoAに3分子のmalonyl-CoAを順次縮合させジケチド中間体、トリケチド中間体、テトラケチド中間体を生成し、最終的にテトラケチド中間体の分子内クライゼン環化によりTHCを生成する (図2、反応A)。しかし同時に、トリケチド中間体またはテトラケチド中間体が酵素の活性部位から遊離して分子内ラクトン化した副生成物、bis-noryangonin (BNY) またはp-coumaroyltriacetic acid lactone (CTAL) がそれぞれ生じる (図2、反応B、C) 9,10)。また、テトラケチド中間体がアルドール環化を受けることでresveratrolが生成されることも報告されている9) (図2、反応D)。これら副生成物の生成比率はCHSの起源や反応条件により様々であるものの、一般的にCHSは主にCTALを副生成物として生成し、総生成物量に占めるCTALの生成比率は30~90 mol%にも達する6,9,10)。こうしたCHSの生成物特異性のあいまいさはフラボノイド代謝を考える上で非常に非効率的であり、生体内にはこれを克服する機構の存在が想定されていたが、最近まで不明のままであった。
![]()
4-2 カルコン異性化酵素類似タンパク質 (CHIL) の機能の発見
2014年にアサガオの花弁の色が淡くなる突然変異体の原因遺伝子としてカルコン異性化酵素類似タンパク質 (CHIL) が同定された11)。CHILはCHIフォールドファミリーのⅣ型に分類されるタンパク質であり、CHIと似た一次構造と立体構造を有するが、CHIとしての触媒残基を有しておらずCHI活性は示さない12)。しかし、CHILの欠失・抑制は、アサガオやペチュニア、トレニア、シロイヌナズナ13)などの被子植物だけでなく、コケ植物であるゼニゴケ14)においてもフラボノイド蓄積量の大幅な減少に繋がることが報告された。また、CHILは特定のフラボノイドではなく、その組織に蓄積するすべてのフラボノイドに影響を与えることから、CHILはフラボノイド生合成の上流部分を活性化することでフラボノイド生合成経路全体の生産増強に寄与することが示唆された。そのため、CHILはその機能に基づきenhancer of flavonoid production (EFP) と命名されている11)。
4-3 CHILはフラボノイドメタボロンに参画しCHSの生成物特異性のあいまいさを矯正する
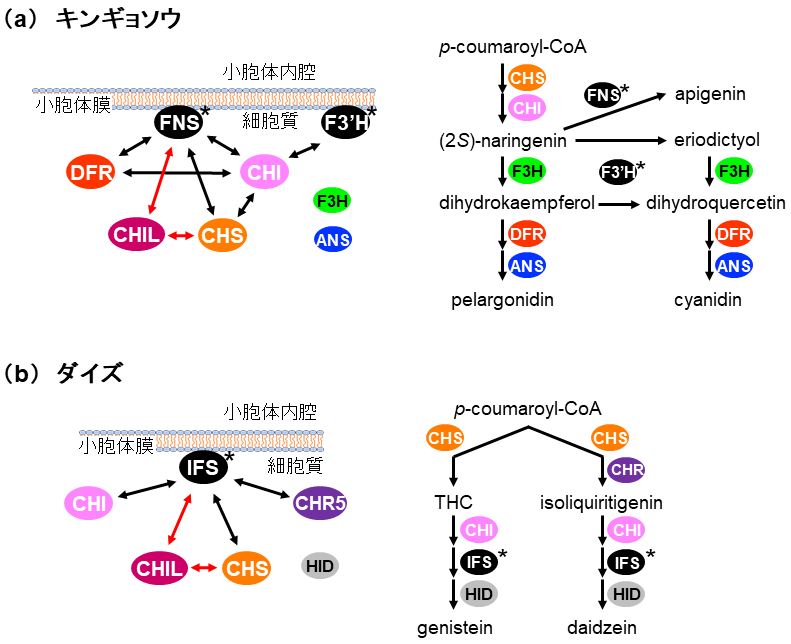
CHILがどのようにしてフラボノイド生産増強に寄与しているかを明らかにするため、フラボノイドメタボロンへのCHILの関与が調べられた。フラボノイドメタボロンがよく研究されているキンギョソウおよびダイズにおいて、CHILとフラボノイド代謝酵素群との相互作用が酵母ツーハイブリッド法および2分子蛍光補完法により総当たり的に解析された6)。その結果、CHILはCHSやシトクロムP450 [キンギョソウではII型フラボン合成酵素 (FNS)、ダイズでは2-ヒドロキシイソフラバノン合成酵素 (IFS) ] と相互作用することが明らかになった (図3)。また、上述のように、CHILはフラボノイド生合成上流の酵素に寄与することが想定されており、上流の酵素としてフラボノイド初発酵素であるCHSが着目され、様々な植物種においてCHILとCHS間の相互作用解析が行われた。その結果、現在までに、コケ植物であるヒメツリガネゴケおよびゼニゴケ、シダ植物のイヌカタヒバ、裸子植物のイチョウ、単子葉植物のイネ、双子葉植物のシロイヌナズナ、ダイズ、キンギョソウ、アサガオ、トレニア、ホップ、アジサイ、ブドウなど、解析された陸上植物すべてにおいてCHSとCHIL間の相互作用が普遍的であることが明らかとなった6,13,15)。

次に、CHILがCHSの活性に与える影響が解析された。その結果、CHILはCHSの活性を大きく増大させることが示され15)、さらにCHS反応により生じる副生成物 (CTAL) の生成を抑制することが明らかとなった6,16) (図4)。したがって、CHILはCHSと相互作用することでCHSの生成物特異性のあいまいさを“矯正”し、フラボノイド初発物質であるカルコン (THC) を優先的に生成するように作用することが明らかになった。さらに、このCHILによる活性制御は陸上植物に進化的に高度に保存されていることが示され6)、陸上植物における効率的なフラボノイド生合成にはCHSとCHILの相互作用が必須の役割を果たしてきたことが示唆された。
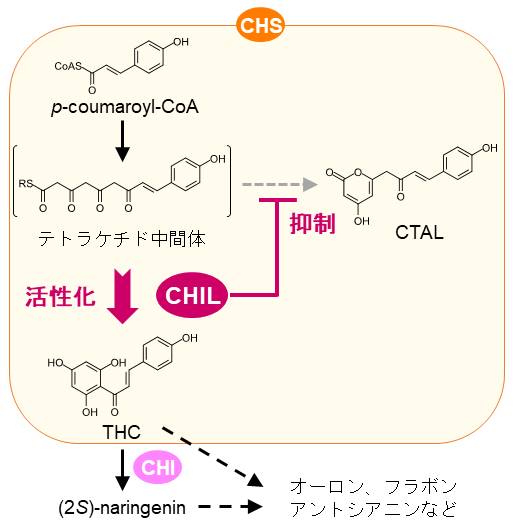
図4 CHILがCHS反応に及ぼす影響
CHSは陸上植物に保存されるPKSであり、植物Ⅲ型PKSの中でスーパーファミリーを形成している。このCHSスーパーファミリーには、CHSと同様にp-coumaroyl-CoAに3分子のmalonyl-CoAを縮合させるがCHSと異なるカルボニル求核付加反応を主経路とするスチルベン合成酵素 (STS) (図2、反応Dを主に触媒する) やクマロイル三酢酸合成酵素 (CTAS) (図2、反応Cを主に触媒する) が存在する。これらⅢ型PKSホモログとCHS間の配列類似度は非常に高い (一般に90%以上)。しかしながら、CHILはこれらⅢ型PKSホモログとは相互作用せずCHILによる上述の機能も発揮されないことが示された6)。したがって、CHILはⅢ型PKSの中でもCHS特異的に作用することが示され、CHSスーパーファミリーにおけるPKSの機能分化・分散進化にはCHILとの相互作用が重要な役割を果たしてきたことが想定された。
5.おわりに
CHILの機能の発見は、フラボノイド代謝におけるメタボロン形成の重要性・意義を明確に示すものであり、その機能は酵素学・生化学の観点からも非常に新奇性の高いものである。フラボノイド生合成にはCHSの他にも特異性があいまいな酵素がいくつか参画しており、メタボロン形成に与る酵素・タンパク質間の相互作用を介する特異性のあいまいさの矯正機構は、他の代謝酵素でも一般に生じている可能性がある。また、図3に示すように、CHSとCHILの相互作用を中心としたメタボロン形成の様式は植物種ごとに異なることが示され、これは植物種に特徴的なフラボノイドの構造の多様性を反映していると考えられる。今後、フラボノイドの構造の多様性とメタボロン形成がどのようにして決定されてきたのか、酵素間の相互作用と酵素活性の両面から評価していく必要がある。
謝辞
本研究の一部は科学研究費 (18H03938) による助成を受けています。
文献
1) Arita, M., Suwa, K.: BioData Mining, 1, 7 (2008).
2) Austin, M. B., Noel, J. P.: Nat. Prod. Rep., 20, 79 (2003).
3) Mol, J. N. M., Robbinst, M. P., Dixon, R. A., Veltkamp, E.: Phytochemistry, 24, 2267 (1985).
4) Waki, T., Yoo, D., Fujino, N., Mameda, R., Denessiouk, K., Yamashita, S., Motohashi, R., Akashi, T., Aoki, T., Ayabe, S., Takahashi, S., Nakayama, T.: Biochem. Biophys. Res. Commun., 469, 546 (2016).
5) Fujino, N., Tenma, N., Waki, T., Ito, K., Komatsuzaki, Y., Sugiyama, K., Yamazaki, T., Yoshida, S., Hatayama, M., Yamashita, S., Tanaka, Y., Motohashi, R., Denessiouk, K., Takahashi, S., Nakayama, T.: Plant J., 94, 372 (2018).
6) Waki, T., Mameda, R., Nakano, T., Yamada, S., Terashita, M., Ito, K., Tenma, N., Li, Y., Fujino, N., Uno, K., Yamashita, S., Aoki, Y., Denessiouk, K., Kawai, Y., Sugawara, S., Saito, K., Yonekura-Sakakibara, K., Morita, Y., Hoshino, A., Takahashi, S., Nakayama, T.: Nature Commun., 11, 870 (2020).
7) Stafford, H. A.: Ann. Rev. Plant Physiol., 25, 459 (1974).
8) Saslowsky, D., Winkel ‐ Shirley, B.: Plant J., 27, 37 (2001).
9) Yamaguchi, T., Kurosaki, F., Suh, D. Y., Sankawa, U., Nishioka, M., Akiyama, T., Shibuya, M., Ebizuka, Y.: FEBS Lett., 460, 457 (1999).
10) Jez, J. M., Bowman, M. E., Noel, J. P.: Biochemistry, 40, 14829 (2001).
11) Morita, Y., Takagi, K., Fukuchi-Mizutani, M., Ishiguro, K., Tanaka, Y., Nitasaka, E., Nakayama, M., Saito, N., Kagami, T., Hoshino, A., Iida, S.: Plant J., 78, 294 (2014).
12) Ngaki, M. N., Louie, G. V., Philippe, R. N., Manning, G., Pojer, F., Bowman, M. E., Li, L., Larsen, E., Wurtele, E. S., Noel, J. P.: Nature, 485, 530 (2012).
13) Jiang, W., Yin, Q., Wu, R., Zheng, G., Liu, J., Dixon, R. A., Pang, Y.: J. Exp. Bot., 66, 7165 (2015).
14) Berland, H., Albert, N. W., Stavland, A., Jordheim, M., McGhie, T. K., Zhou, Y., Zhang, H., Deroles, S. C., Schwinn, K. E., Jordan, B. R., Davies, K. M., Andersen, O. M.: Proc. Natl. Acad. Sci. USA, 116, 20232 (2019).
15) Ban, Z., Qin, H., Mitchell, A. J., Liu, B., Zhang, F., Weng, J. K., Dixon, R. A., Wang, G.: Proc. Natl. Acad. Sc.i USA, 115, E5223 (2018).
16) Ni, R., Zhu, T.-T., Zhang, X.-S., Wang, P.-Y., Sun, C.-J., Qiao, Y.-N., Lou, H.-X., Cheng, A.-X.: J. Exp. Bot., 71, 290 (2019).