【トピックス】
C–N 結合形成反応を触媒するシトクロムP450 酵素を利用したC–S 結合の導入
森 貴裕
東大院・薬
1.はじめに
天然から単離される二次代謝産物は、複雑な構造を有し、高い生物活性と構造多様性を備えたものが多く、医薬品資源としても重要視されている。しかし、天然資源からの抽出、精製という天然物の従来の方法論による医薬品シード化合物の探索、供給には、大量の天然資源が必要である。また、過去から現在にかけて多くの天然化合物が報告されており、新規活性化合物、特に、新規骨格を有する天然化合物の取得は非常に困難になりつつある。二次代謝産物は生体内においてそれぞれの生合成遺伝子にコードされる二次代謝酵素により合成される。これら酵素群の中には、広範な基質特異性を示すものがあり、合成基質などを作用させることで非天然型の新規化合物を生産することが可能となる。また、酵素の立体構造情報を基盤とし、基質特異性や触媒反応に重要なアミノ酸残基に変異を加えることで反応性や基質特異性を変化させた機能改変酵素を創出することが可能となる。このように作成した機能改変酵素や、有用物質生合成反応の律速段階となる酵素に対して進化工学の手法などにより反応性を向上させれば、有用生理活性物質の生産量を改善することができる。
テレオシジン類は1960年に旧藤沢薬品工業株式会社 (現アステラス製薬) の高島らにより放線菌Streptomycesmediocidicusより殺魚成分として単離され、その後の詳細な生理活性研究によりPKC活性化による発がん作用が明らかとされた1-3)。テレオシジン類は9員環ラクタム構造を有するインドラクタムVとインドール環に結合したテルペン部分からなり、テルペン部分の鎖長の違い、環化する際の環化様式などにより多様性が構築されている4-10) (図1)。これまでにテレオシジン誘導体の構造活性相関研究が行われ、インドラクタムVの構造が活性発現に必須であることが判明している11)。また近年ではインドラクタムVにES細胞の膵臓組織への分化誘導作用があることも見出されており、生化学試薬としての応用が期待されている12)。
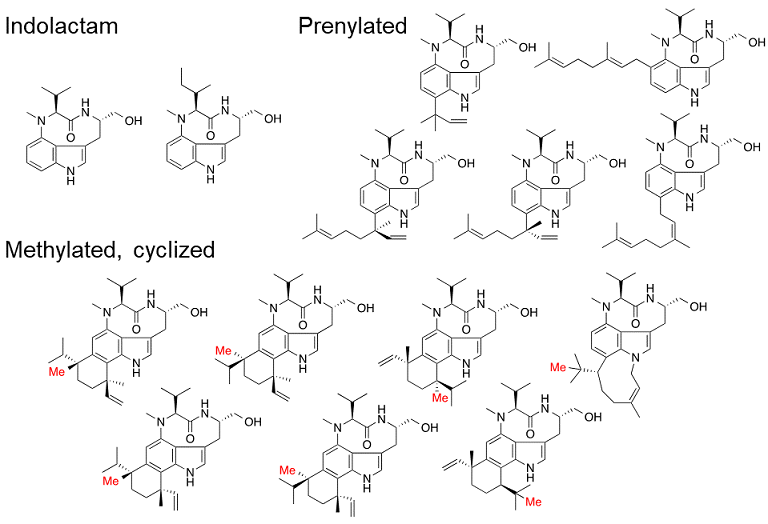
図1 テレオシジン類の構造
テレオシジン類生合成においてはまず、非リボソーム型ペプチド合成酵素 (NRPS) TleAによりバリンのメチル化とN-メチルバリンとトリプトファンの縮合が進行し、還元的に酵素から切り離されることによってN-メチルバリルトリプトファノール (NMVT) が形成する (図2)13)。続いてシトクロムP450酸化酵素TleBによりNMVTの分子内の二級アミンN13位とインドール環の4位炭素原子の間でC-N結合が形成され、インドラクタムVが生成する。その後、プレニル基転移酵素TleC14)やメチル基転移酵素TleD13,15)によるプレニル化とメチル化を伴った環化反応により最終産物であるテレオシジンBが生成する。
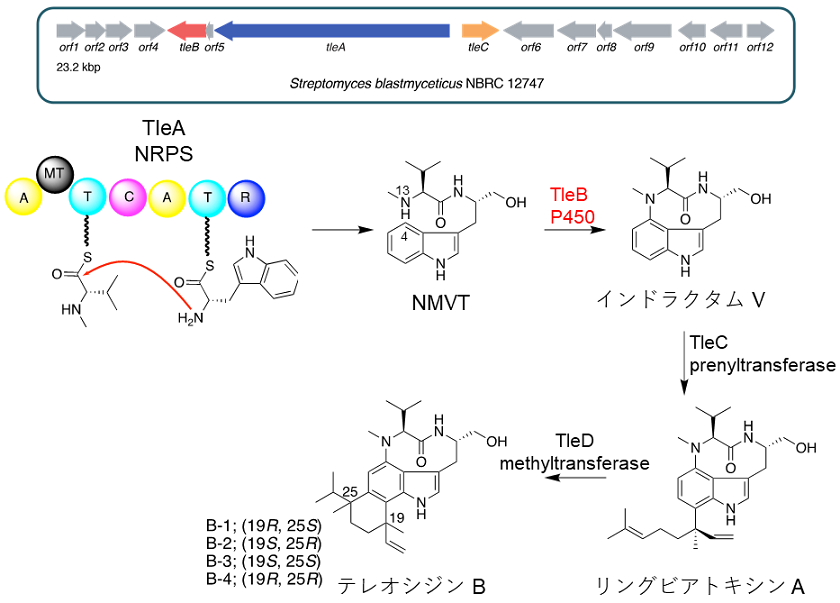
図2 テレオシジン類の生合成
このTleBによるC-N結合形成反応は、ジペプチド化合物の二級アミンN13位と比較的反応性の低いインドール環C4位との間に形成される。一方、数多く行われているテレオシジン類やインドラクタムVの全合成研究において、このC-N結合は合成初期に導入される16-20)。インドール環のC4位炭素を活性化には金属触媒の利用や高温条件下での反応が必要であり、特にヘテロ原子の導入に関する報告例は数が限られている。したがって、TleBは非常に不利な反応を温和かつ環境負荷の低い条件で進行させることができる触媒であり、C-N結合形成に変わって他のヘテロ原子を導入することができれば分子骨格の多様性創出に大きく寄与し得る。本稿では、C-N結合反応を触媒するシトクロムP450酸化酵素の反応メカニズムに基づいて設計した合成基質による新規インドラクタム類縁体化合物の創出についての成果を紹介する21)。
2.TleBの反応機構に基づいた合成基質の設計
著者らは、近年X線結晶構造解析および合成基質を利用した酵素反応メカニズム解析によりTleBの触媒するC-N結合形成反応機構を以下のように提唱した22)。まず、活性部位に基質が結合し、生成したフェリルオキソ中間体によってN1位の水素原子が引き抜かれ、ラジカルが生じることで反応が開始する。次に、C4位へのラジカルの移動に伴って活性部位内でのコンフォメーション変化が起こり、N13位が近づくことでこの部位にもラジカルが発生し、C4位とN13位の間でラジカルカップリングが進行することで9員環ラクタム骨格が形成する (図3)。13位のN-メチル基を水酸基、メトキシ基、アミノ基へと変更した合成化合物を基質として酵素反応を行ったところ、13位原子上でのラジカルの安定性がラジカルカップリング反応に重要であると示唆された22)。そこで、本研究内においてはNMVTの13位にある2級アミンよりラジカルが安定化されると期待されるチオール基を持つ化合物1を合成した (図4)。1を基質としてTleBの酵素反応を行い、反応生成物を分析した結果、酵素依存的に二種類の化合物2及び3の生成を確認した。酵素反応生成物を大量調製しNMR解析を行ったところ、2はS13位とインドール環4位の間でチオエーテル結合が形成した、チオインドラクタム骨格を有する化合物であると明らかとなった。3はNMRシグナルのブロード化により帰属が困難な部分構造が存在したため、結晶スポンジ法23)を用いて最終的な構造決定を行った。その結果、3はC2位とS13位の間でC-S結合を形成した特徴的な6/5/8縮環構造を有する化合物と決定した。興味深いことに、他のヘテロ原子で置換した基質アナログからは8員環構造は形成されず、この反応は硫黄原子の高い求核性が関与していると推察される。2はインドラクタムと同様インドール環C4位上に生じたラジカルとS13位上に生じたラジカルがカップリング反応によりC-S結合を形成すると考えられる。一方、3はN1位にラジカルが生じた後にC3位の水酸化が進行した中間体 (もしくはC2-C3の間にエポキシ化した中間体) を与えたのちに、S13位からC2位への求核攻撃により閉環して形成されると考察する。その際、S13位はre面からC2位に接近し、C-S結合を形成することでC2-H結合とC3-O結合がアンチペリプラナーになり、脱水反応が進行し5員環の芳香性が回復すると考えられる (図4B)。
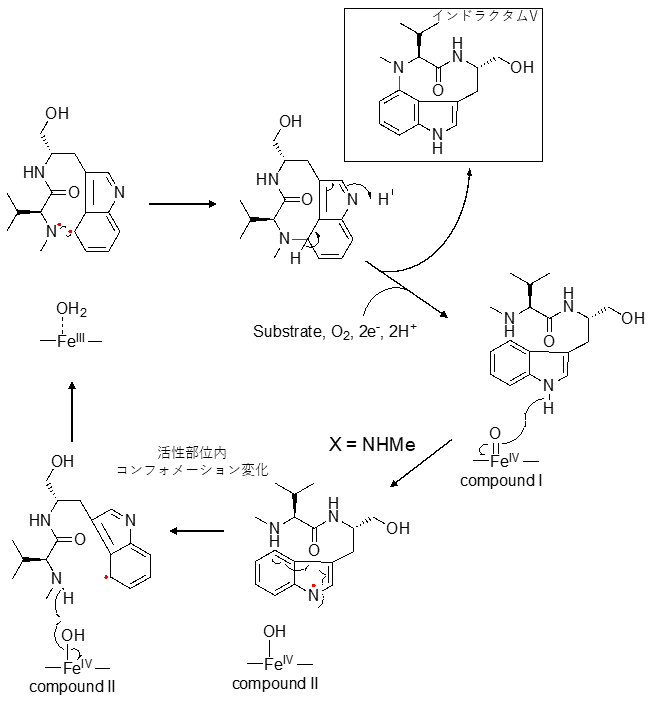
図3 TleBによるC-N結合形成反応の触媒メカニズム
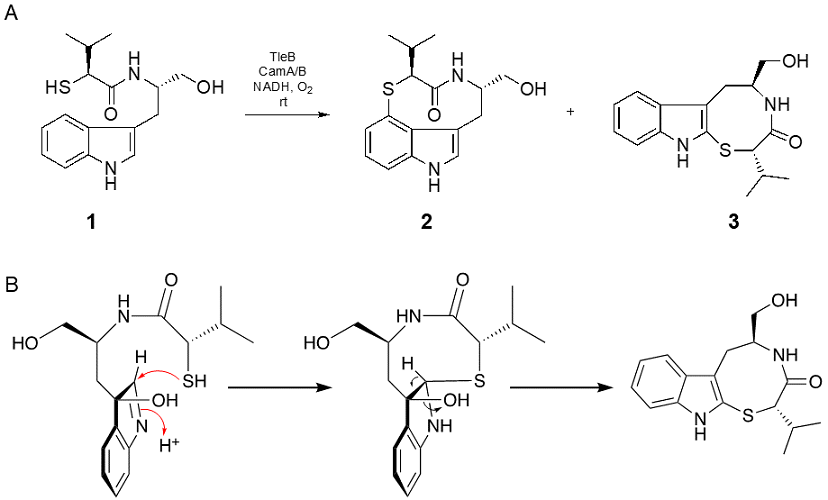
図4 合成基質を用いた酵素反応(A)設計した合成基質1と酵素反応生成物(B)3の推定生成メカニズム
3.チオインドラクタムVの立体配座解析と生物活性
インドラクタム誘導体は、溶液中においてシス-ラクタムアミド (TWIST型) とトランス-ラクタムアミド (SOFA型) に起因する2種類の安定配座の平衡混合物として存在し、その比率が各誘導体の生物活性に影響を与えることが知られている24,25) (図5)。化合物2のNOESY解析及び結晶構造解析の結果、2は溶液中では主にSOFA型として存在しており、TWIST型を主配座とするインドラクタムVとは異なることが示唆された。そこでDFT計算によって2が理論上取りうる各配座に関して溶液中における熱力学的安定性を解析した結果、SOFA配座が72.3%と最も安定で存在比が最大であることが判明した (図6)。しかしながら、r-trans-FOLDと呼ばれる配座が21.7%と高い割合で存在しており、NMRなどの観測結果と一致しなかった。また、2のメタダイナミクス計算を行ったところ、SOFA配座とr-trans-FOLD配座は室温で相互変換できないことが示唆された (図6)。インドラクタムVは、計算上においてはC5–C4–N–C12の二面角により分類される二種類の配座グループと取り得るが、天然から単離、あるいは全合成されたインドラクタムVはr-配座と呼ばれるグループBの配座は取っていないことが明らかとされている26,27) (図5)。また、以前のTleBとホモログ酵素HinDの結晶構造解析において、基質の活性部位における2つの異なる結合様式を取得し、活性部位でのN1位水素原子の引き抜き後、NMVTは活性部位内においてコンフォメーション変化が起きることを提唱した22)。1つ目の結合様式ではN1位の水素原子を引き抜くためN1位が活性中心のヘムに近づいた反応初期の結合様式を表しており、2つ目の結合様式では、N13位がC4原子をsi面から求核攻撃する閉環時のコンフォメーションを表していると考察される。合成基質1とTleBの複合体構造は取得できていないが、化合物構造、触媒される反応の類似性から同様な結合様式を取ることが考えられる。すなわち、インドラクタムVや2の形成反応においては、酵素活性部位における基質のコンフォメーションを制御することにより、酵素依存的に特定の配座のみが生成していると考えられる。2のDFT計算ではランダムに配座を作り出したのちに安定な構造に収束させる (モンテカルロ法) ために、室温では変換しないr-trans-FOLDが結果に現れてきたものと推察される。
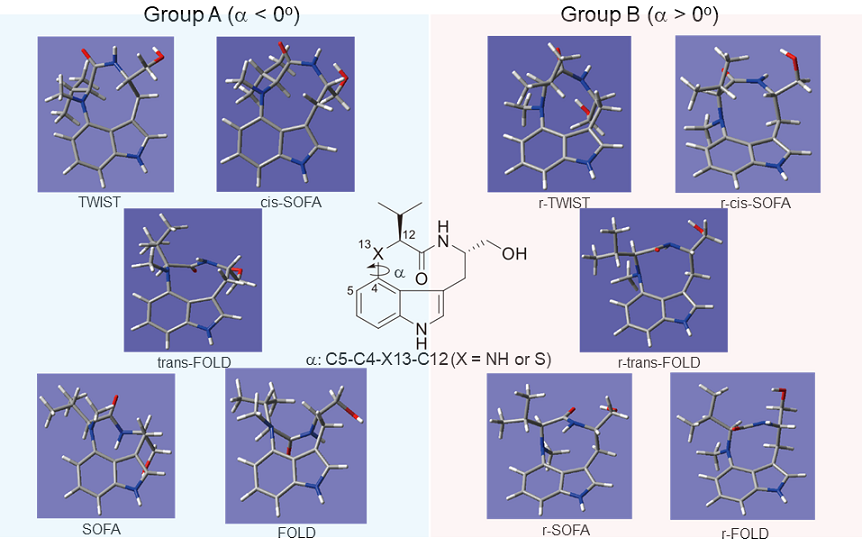
図5 インドラクタムが取りうる10種類の配座、インドラクタムVはTWIST型とSOFA型2:1の比率で存在している。
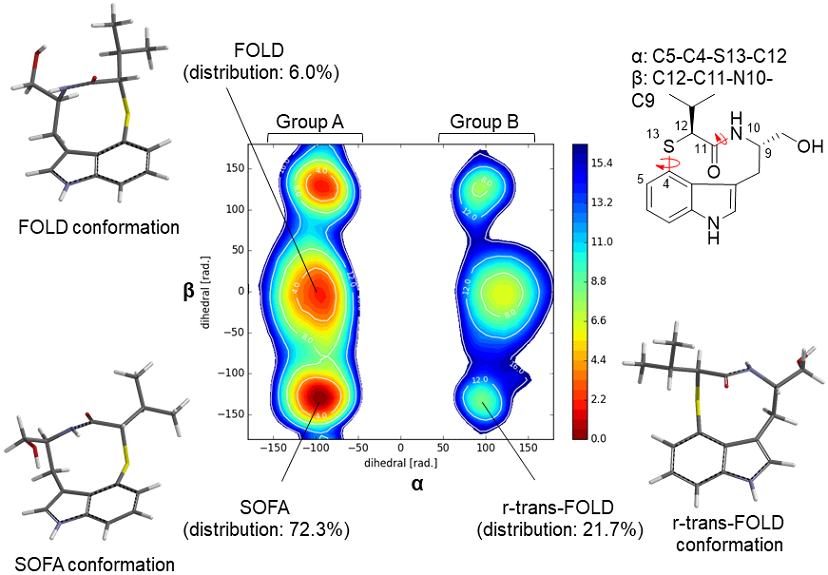
図6 2のメタダイナミクス計算
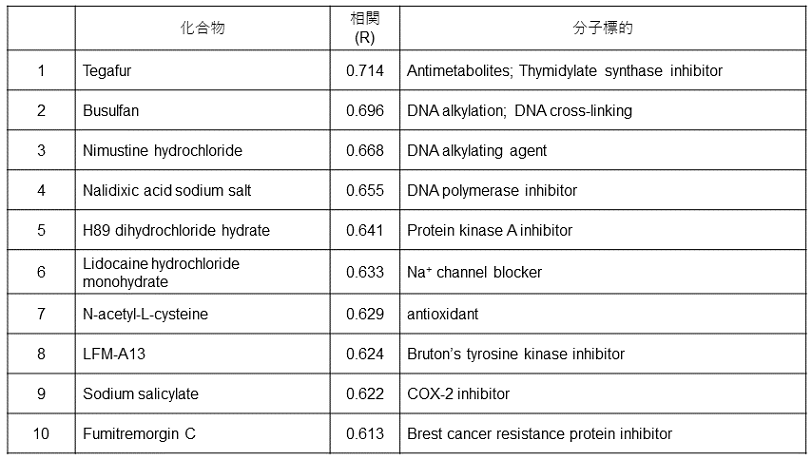
以上のことから、インドラクタムVと2では主に存在している配座が異なることが示唆された。上述したように、化合物の安定配座の比率が各誘導体の生物活性に影響する29,30)。特に、インドラクタムVのSOFA型配座はPKCの特定のサブタイプに対する特異性を示すことが報告されている30)。従って、2においてもその配座の違いにより分子標的の選択性が異なることが期待されたため、2の生物活性試験を行った。39種のヒトがん細胞に対する成長阻害活性を算出し、各細胞株に対する活性の強さのパターン (フィンガープリント) を、データベースにある既知化合物のものと比較することで分子標的を予測した。その結果、2はいくつかのがん細胞に対して弱い成長阻害活性を示すことが示され (GI50=~27µM)、表1に示した化合物と分子標的が同じ、または近いと考えられた。データベース上には数種類のPKC活性化化合物が含まれていたものの、2のフィンガープリントはそのどれとも類似性を示さなかったことから、2はその構造類似性に反してインドラクタムVとは異なる分子標的や選択性を持つと考えられる。
表1 分子標的の類似性が予測された既知化合物
4.おわりに
著者らは、酵素の試験管内での機能解析、X線結晶構造解析の手法を用い、より詳細な酵素機能や反応メカニズムを深く理解した上で、反応メカニズムに基づいた合理的な基質設計により新規化合物を創出することに成功した。今後、合成基質の設計とX線結晶構造解析に基づく論理的な部位特異的変異の導入、あるいは酵素に対してランダムな変異を導入し、ハイスループットの活性評価スクリーニング系を用いて酵素を進化させる進化工学技術を組み合わせることで、分子多様性と生物活性を備えた広大な非天然型化合物ライブラリーの構築への展望が期待される。
謝辞
本研究は東京大学薬学系研究科天然物化学教室と東京大学大学院薬学系研究科 大和田智彦教授、東京大学大学院工学系研究科 藤田誠教授のグループとの共同研究で行われたものです。また、JSPS 科研費 (16H06276、JP16H06443、JP18K19139、JP19K15703) とJSTSICORP (JPMJSC1701)、AMED (JP19ak0101101) の支援を受けて実施された研究です。
文献
1) Takashima, M., Sakai, H.: Bull. Agr. Chem. Soc. Japan, 24, 647 (1960).
2) Takashima, M., Sakai, H.: Bull. Agr. Chem. Soc. Japan, 24, 652 (1960).
3) Umezawa, K., Weinstein, I. B., Horowitz, A., Fujiki, H., Matsushima, T., Sugimura, T.: Nature, 290, 411 (1980).
4) Sakai, S., Aimi, N., Yamaguchi, K., Hitotsuyanagi, Y., Watanabe, C., Yokose, K., Koyama, Y., Shudo, K., Itai, A.: Chem. Pharm. Bull., 32, 354 (1984).
5) Hitotsuyanagi, Y., Fujiki, H., Suganuma, M., Aimi, N., Sakai, S., Endo, Y., Shudo, K., Sugimura, T.: Chem. Pharm. Bull., 32, 4233 (1984).
6) Yamashita, T., Imoto, M., Isshiki, K., Sawa, T., Naganawa, H., Kurasawa, S., Zhu, B., Umezawa, K.: J. Nat. Prod., 51, 1184 (1988).
7) Sun, H. H., White, C. B., Dedinas, J., Cooper, R.: J. Nat. Prod., 54, 1440 (1991).
8) Sakai, S., Hitotsuyanagi, Y., Aimi, N., Fujiki, H., Suganuma, M., Sugimura, T., Endo, Y., Shudo, K.: Tetrahedron Lett., 27, 5219 (1986).
9) Cardellina II, J. H., Marner, F. J., Moore, R. E.: Science, 204, 193 (1979).
10) Aimi, N., Odaka, H., Sakai, S., Fujiki, H., Suganuma, M., Moore, R. E., Patterson, G. M.: J. Nat. Prod., 53, 1593 (1990).
11) Fujiki, H., Suganuma, M., Nakayasu, M., Tahira, T., Endo, Y., Shudo, K., Sugimura, T.: Gann, 75, 866 (1984).
12) Thatava, T., Nelson, T. J., Edukulla, R., Sakuma, T., Ohmine, S., Tonne, J. M., Yamada, S., Kudva, Y., Terzic, A., Ikeda, Y.: Gene Ther., 18, 283 (2011).
13) Awakawa, T., Zhang, L., Wakimoto, T., Hoshino, S., Mori, T., Ito, T., Ishikawa, J., Tanner, M. E., Abe, I., J. Am.: Chem. Soc., 136, 9910 (2014).
14) Mori, T., Zhang, L., Awakawa, T., Hoshino, S., Okada, M., Morita, H., Abe, I.: Nat. Commun., 7, 10849 (2016).
15) Yu, F., Li, M., Xu, C., Sun, B., Zhou, H., Wang, Z., Xu, Q., Xie, M., Zuo, G., Huang, P., Guo, H., Wang, Q., He, J.: Biochem. J., 473, 4385 (2016).
16) Endo, Y., Shudo, K., Furuhata, K., Ogura, H., Sakai, S., Aimi, N., Hitotsuyanagi, Y., Koyama, Y.: Chem. Pharm. Bull., 32, 358 (1984).
17) Endo, Y., Shudo, K., Itai, A., Hasegawa, M., Sakai, S.: Tetrahedron, 42, 5905 (1986).
18) Masuda, T., Nakatsuka, S., Goto, T.: Agric. Biol. Chem., 53, 2257 (1989).
19) Noji, T., Okano, K., Tokuyama, H.: Tetrahedron, 71, 3833 (2015).
20) Nakamura, H., Yasui, K., Kanda, Y., Baran, P. S.: J. Am. Chem. Soc., 141, 1494 (2019).
21) Morita, I., Mori, T., Mitsuhashi, T., Hoshino, S., Taniguchi, Y., Kikuchi, T., Nagae, K., Nasu, N., Fujita, M., Ohwada, T., Abe, I.: Angew. Chem. Int. Ed., 59, 3988 (2020).
22) He, F., Mori, T., Morita, I., Nakamura, H., Alblova, M., Hoshino, S., Awakawa, T., Abe, I.: Nat. Chem. Biol., 15, 1206 (2019).
23) Inokuma, Y., Yoshioka, S., Ariyoshi, J., Arai, T., Hitora, Y., Takada, K., Matsunaga, S., Rissanen, K., Fujita, M.: Nature, 495, 461 (2013).
24) Endo, Y., Shudo, K., Okamoto, T.: Chem. Pharm. Bull., 30, 3457 (1982).
25) Endo, Y., Hasegawa, M., Itai, A., Shudo, K., Tori, M., Asakawa, Y., Sakai, S.: Tetrahedron Lett., 26, 1069 (1985).
26) Endo, Y., Shudo, K., Itai, A., Hasegawa, M., Sakai, S.: Tetrahedron, 42, 5905 (1986).
27) Kawai, T., Ichinose, T., Endo, Y., Shudo, K., Itai, A.: J. Med. Chem., 35, 2248 (1992).
28) Irie, K., Hagiwara, N., Koshimizu, K.: Tetrahedron, 43, 5251 (1987).
29) Ohno, M., Endo, Y., Hirano, M., Itai, A., Shudo, A.: Tetrahedron Lett., 34, 8119 (1993).
30) Masuda, A., Irie, K., Nakagawa, Y., Ohigashi, H.: Biosci. Biotechnol. Biochem., 66, 1615 (2002).